麻杏石甘湯對流感病毒感染小鼠腸道菌群及趨化因子CCL5、CXCL10的影響
王 平,趙 澄,盧芳國*,吳 濤,張香港,陳純靜,肖 榮,寧 毅,魏 科,李 玲,蔡 琨,田維毅
麻杏石甘湯對流感病毒感染小鼠腸道菌群及趨化因子CCL5、CXCL10的影響
王 平1, 2,趙 澄1,盧芳國1*,吳 濤1,張香港1,陳純靜1,肖 榮1,寧 毅1,魏 科1,李 玲1,蔡 琨2,田維毅2
1. 湖南中醫藥大學,湖南 長沙 410208 2. 貴州中醫藥大學,貴州 貴陽 550025
探索麻杏石甘湯(Maxing Shigan Decoction)通過影響小鼠腸道菌群組成及趨化因子產生而防治流感病毒感染的潛在機制。通過鼻腔接種法建立A型流感病毒感染小鼠模型,經ig給藥3 d和7 d后,觀察小鼠體質量等一般情況;HE染色檢測結腸組織病理變化;免疫組化檢測結腸組織趨化因子CCL5、CXCL10的表達;酶聯免疫法檢測結腸組織中CCL5、CXCL10含量,并取小鼠腸內容物進行16S rRNA基因V3~V4可變區測序、物種注釋及聚類,進行Alpha多樣性和Beta多樣性分析,線性判別式分析 [linear discriminant analysis(LDA)effect size,LEfSe] 篩選組間差異物種,冗余分析及Spearman等級相關系數分析腸道菌群與CCL5、CXCL10的關聯性。給藥3 d后,模型組小鼠體質量下降(<0.01),腸黏膜固有層中炎性細胞明顯浸潤且高表達CCL5和CXCL10(<0.01),結腸組織勻漿中CCL5和CXCL10含量增加(<0.01);與模型組比較,各藥物組小鼠體質量明顯增加,炎性細胞浸潤減少,CCL5、CXCL10陽性表達細胞減少,腸組織勻漿中CCL5、CXCL10含量降低,以奧司他韋組和麻杏石甘湯組差異顯著(<0.05、0.01)。菌群多樣性分析和物種差異分析結果顯示,給藥3 d后,模型組小鼠腸道菌群組成與對照組及各藥物組存在明顯差異。模型組小鼠變形菌門、埃希菌屬相對豐度較對照組明顯增加(<0.05),厚壁菌門、乳桿菌屬、糞球菌屬相對豐度明顯降低(<0.05、0.01);與模型組比較,各藥物組變形菌門、埃希菌屬相對豐度降低(<0.05),奧司他韋組和麻杏石甘湯組厚壁菌門相對豐度顯著增加(<0.01),抗病毒顆粒組顫螺旋菌屬相對豐度增加(<0.05),麻杏石甘湯組乳桿菌屬、糞球菌屬相對豐度增加(<0.05、0.01)。給藥7 d后,模型組小鼠結腸組織病變減輕,趨化因子表達下降,變形菌門、埃希菌屬相對豐度較給藥3 d后明顯降低(<0.01);與模型組比較,各藥物組疣微菌門相對豐度明顯降低(<0.05、0.01),擬桿菌門相對豐度明顯升高(<0.05)。關聯性分析顯示,小鼠結腸組織中CCL5、CXCL10含量與埃希菌屬、克雷伯菌屬、梭菌屬、糞球菌屬等相對豐度顯著相關(<0.05、0.01)。A型流感病毒感染可引起小鼠腸道菌群結構紊亂及免疫功能失衡,麻杏石甘湯通過調節腸道菌群結構并影響趨化因子的產生,對流感病毒引起的腸道免疫損傷有一定的保護作用。
A型流感病毒;麻杏石甘湯;腸道菌群;趨化因子;CCL5;CXCL10
流行性感冒(以下簡稱流感)是由流感病毒(influenza virus)引起的一種急性呼吸道傳染病。A型流感病毒(influenza A virus,IAV)是引起人和動物感染的主要病原體。流感臨床表現多樣,常見的癥狀包括發熱、咳嗽、頭痛、乏力,并常伴有惡心、嘔吐、腹瀉、腹痛等消化道癥狀。有研究報道,流感患者胃腸道癥狀發生率為30.9%[1]。流感病毒感染致腸道菌群失調及黏膜局部免疫功能紊亂可能是流感容易出現消化道癥狀的重要原因[2]。
腸道菌群從生命早期開始逐步有序地定植在消化道內,形成穩定的腸道微生態系統。腸道菌群及其代謝產物與宿主的能量代謝、免疫穩態以及健康狀況密切相關。越來越多的證據表明,腸道菌群種類和比例改變對流感病毒感染的結局可能產生積極影響或負面作用,這與腸道菌群及其代謝產物對宿主免疫功能的影響密不可分[3]。研究發現,流感病毒感染后,腸道菌群結構組成發生改變,并且腸上皮細胞可以釋放過量的趨化因子和促炎細胞因子,腸道菌群與黏膜局部炎癥因子之間相互作用,進而影響流感的進程[2,4]。Wang等[2]研究發現,流感病毒感染可促進肺源性CCR9+CD4+T細胞進入腸道,分泌γ干擾素(interferon-γ,IFN-γ)干擾腸道微生物群穩態,引起腸道菌群失調,而紊亂的腸道菌群又可促進小腸上皮細胞分泌白細胞介素-15(interleukin-15,IL-15),誘導Th17細胞極化,促進IL-17等細胞因子的產生,進而加重腸組織損傷。Li等[4]研究發現,流感病毒感染可促進腸道中變形菌門腸桿菌科細菌生長,破壞黏膜屏障功能,誘導腸上皮細胞過度表達IL-22、IFN-α、IL-17A等促炎細胞因子,引起炎癥反應和腸組織損傷。趨化因子CCL5(CC chemokine ligand 5)和CXCL10(C-X-C motif chemokine ligand 10)是引起流感免疫病理損傷的重要炎癥因子,能強烈趨化炎癥細胞向病灶部位聚集,與流感病毒感染引起的炎癥損傷程度呈正相關[5-6]。研究發現大腸埃希菌或肺炎克雷伯菌等可以促進CCL5及CXCL10等趨化因子的表達,從而加重炎性損傷程度[7-8]。因此,修復腸道微生態失衡,改善黏膜局部微環境對于防治流感有重要意義。源自漢代張仲景《傷寒論》的麻杏石甘湯(Maxing Shigan Decoction,MXSGD)是常用的防治流感的中藥經方。本課題組前期研究發現,該方具有干預病毒吸附、抑制病毒增殖、抑制趨化因子及炎癥介質釋放等作用[9-11]。本研究以流感病毒感染BALB/c小鼠為模型,探討流感病毒對小鼠腸道菌群及腸黏膜局部趨化因子的影響,及MXSGD的干預作用,以期為腸道菌群作為流感防控新策略中的重要靶點提供依據,并進一步揭示MXSGD防治流感的可能機制,為拓展其臨床應用提供理論支持和實驗數據。
1 材料
1.1 動物
6~8周BALB/c雄性小鼠60只,體質量(18±2)g,購于湖南斯萊克景達實驗動物有限公司 [許可證號SCXK(湘)2016-0002,動物批號43004700062561],于湖南中醫藥大學實驗動物中心[許可證號SCXK(湘)2015-0003] 飼養。飼養條件:溫度(23±1)℃,濕度(65±5)%。所有實驗符合湖南中醫藥大學動物實驗倫理學規定。
1.2 病毒株
流感病毒小鼠肺適應株(A型,IAV,A/PR/8/34),由湖南師范大學病毒研究室惠贈。10日齡雞胚尿囊腔接種培養傳代,血凝效價1∶640以上者用于實驗。正式實驗前根據文獻方法[12],測定小鼠病毒半數致死量(LD50)為1×10?3.77,每0.1 毫升病毒液用滅菌生理鹽水稀釋成50 LD50,置于冰袋中備用。
1.3 藥物與試劑
MXSGD(麻黃9 g、杏仁9 g、石膏18 g、炙甘草6 g):麻黃(批號1901029)、杏仁(批號2019032702)、石膏(碎,棉裹,批號1905250032)、炙甘草(批號1806004),購自湖南中醫藥大學附屬第一醫院門診藥房,經湖南中醫藥大學第一附屬醫院藥學部戴冰教授鑒定為正品,符合《中國藥典》2020年版的要求;磷酸奧司他韋膠囊(規格75 mg/粒,批號M1050,意大利Roche S.p.A. 公司生產,上海羅氏制藥有限公司分裝)購自中南大學湘雅二附院門診藥房,用蒸餾水充分溶解,制成質量濃度為2.165 mg/mL的混懸液;抗病毒顆粒(規格9 g/袋,批號1906311,四川光大制藥有限公司)購自湖南中醫藥大學附屬第一醫院門診藥房,用蒸餾水充分溶解,制成質量濃度為0.39 g/mL的溶液。以上實驗用藥4 ℃避光保存備用。兔抗小鼠RANTES抗體(批號ab189841)、CXCL10多克隆抗體(批號ab9938);驢抗兔IgG熒光二抗(批號ab175772)均購于Abcam公司;通用二步法試劑盒(批號PV-9000,北京中杉金橋生物技術有限公司);小鼠CXCL10/IP-10 ELISA試劑盒(批號F10933,上海西唐生物科技有限公司)、CCL5/ Rantes ELISA試劑盒(批號F11450,上海西唐生物科技有限公司)。
1.4 主要儀器
BSC-1300 IIA2生物安全柜(蘇州安泰空氣技術有限公司);SW-CJ-1FD超凈工作臺(蘇州安泰空氣技術有限公司);Axioscope 5光學掃描顯微鏡+Axiocam 503 color 顯微鏡攝像頭 [蔡司科技(蘇州)有限公司];BBY24M高通量組織細胞破碎儀(美國Next Advance公司);Spark多功能酶標儀(瑞士Tecan公司);TP-200D電子分析天平(湘儀天平儀器設備有限公司);RMZ135精密輪轉切片機(德國LEICA公司);TGL 20M高速冷凍離心機(長沙湘智離心機儀器有限公司);IlluminaMiseq測序儀(美國Illumina公司)。
2 方法
2.1 動物分組
實驗設對照組、模型組、奧司他韋組(化學藥對照組)、抗病毒顆粒組(中藥對照組)和MXSGD組,每組12只小鼠。
2.2 MXSGD水煎液的制備
參照文獻方法[13-14],采用麻黃先煎方法制備MXSGD水煎液。按其組成比例分別稱量5劑藥的藥材量。先取麻黃45 g,加入藥材總量10倍體積的蒸餾水,武火煎煮,待沸騰后,調整為文火煎煮25 min,去沫,再加入石膏90 g、杏仁45 g、炙甘草30 g,繼續文火煎煮30 min,煎煮完畢后濾過;二煎加入7倍體積蒸餾水武火煮沸后再文火煎煮20 min,煎煮完畢后濾過,合并2次濾液,水浴濃縮至含生藥0.605 g/mL,4 ℃避光保存備用。
2.3 模型制備及給藥
實驗動物適應性飼養2~3 d后稱質量。除對照組外,各組小鼠按照本課題前期研究已建立的方法建立A型流感病毒感染模型[15]。用乙醚輕度麻醉小鼠后,每只小鼠鼻孔內均勻滴入50 LD50流感病毒液0.05 mL,建立模型。對照組小鼠隔離飼養在同等條件下的房間,并按同樣方法鼻腔接種0.9%氯化鈉溶液0.05 mL。
按臨床等效劑量(臨床等效劑量按動物每千克體質量占人體表面積的比值計算[16])于感染后24 h開始ig給藥,每天1次,每次0.2 mL,連續給藥3 d和7 d。奧司他韋、抗病毒顆粒、MXSGD的給藥劑量分別為20.14 mg/(kg?d)、4.03 mL/(kg?d)、5.22 g/(kg?d)。對照組和模型組均ig等量生理鹽水。
2.4 標本采集
分別于感染后第4天和第8天(給藥后第3天和第7天),禁水禁食8 h后,每組隨機選取6只小鼠,稱質量后,摘眼球放血法處死小鼠,轉移至超凈工作臺內解剖,用無菌鑷子將部分結腸段內容物取下,置于EP管中,凍存于?80 ℃冰箱。收集一部分結腸組織置于4%多聚甲醛中固定;另一部分稱重后,液氮迅速冷凍保存備用。
2.5 結腸組織病理學觀察
蘇木素-伊紅(HE)染色檢測結腸組織病理變化,用4%多聚甲醛固定結腸組織、石蠟包埋、切片(4~5 μm)、HE染色后,在光學顯微鏡下(×200)觀察病理變化。
2.6 免疫組織化學檢測趨化因子CCL5、CXCL10在腸黏膜表達
PV-9000通用二步法檢測腸組織中趨化因子CCL5、CXCL10蛋白表達水平。石蠟切片常規脫蠟,水化,抗原修復,阻斷內源性過氧化物酶,與CCL5、CXCL10一抗37 ℃孵育60 min,陰性對照組用PBS緩沖液代替一抗,PBS緩沖液沖洗后滴加反應增強液,室溫孵育20 min,滴加增強酶標山羊抗兔IgG聚合物,室溫孵育20 min,加DAB顯色劑處理5~8 min,蘇木素復染1 min,流水沖洗30 min,氨水返藍,脫水、透明、封片,鏡下觀察結果。細胞膜和細胞質棕褐色或者棕黃色著色為陽性細胞,以細胞不著色為陰性。用Axiocam 503 color采集圖像,選取結構完整的1張切片,在高倍鏡下(×200),每張切片任選5個視野,用Image-proplus分析軟件進行陽性顯色的平均積分光密度測定(陽性區域面積陽性強度),代表陽性細胞目的蛋白的表達量,然后求其平均值,作為該樣本的相對表達量。
2.7 ELISA法檢測CCL5、CXCL10在腸組織勻漿中的含量
從液氮中取出凍存結腸標本,標本融化后,剪碎,加入一定量預冷的PBS(pH 7.4),將標本充分勻漿(制備成10%勻漿),離心20 min(4 ℃、2000 r/min),嚴格按ELISA試劑盒說明書進行操作,運用酶標儀進行檢測。
2.8 16S rRNA基因V3~V4區測序
采用Macherey-Nagel Kit試劑盒抽提腸內容物DNA,通過Qubit Fluorometer對DNA濃度進行定量,并通過瓊脂糖凝膠電泳對DNA完整性進行評價,DNA質量符合的樣本進行文庫構建。取30 ng DNA樣品及融合引物(341F:5’-ACTCCTACGGGA- GGCAGCAG-3’;806R:5’-GGACTACHVGGGTWT- CTAAT-3’)進行PCR擴增(16S rRNA基因V3~V4區)。純化后溶于Elution Buffer,貼上標簽,文庫構建完成。采用IlluminaMiseqPE 300高通量測序平臺對檢測合格的文庫進行雙末端(paired-end,PE)測序,獲得PE讀段(reads)。16S rRNA基因測序分析由武漢華大醫學檢驗所有限公司高通量實驗室完成。
2.9 生物信息學分析
下機數據經過數據過濾,去除低質量的reads,使用FLASH(Fast Length Adjustment of Short reads,v1.2.11)軟件,利用重疊關系將雙末端測序得到的成對reads拼接成原始序列(raw tags);raw tags經進一步去除嵌合體、短序列后得到優質序列(clean tags)。利用UPARSE軟件在97%相似度下將優質序列進行聚類,獲得操作分類單元(operational taxonomic units,OTUs),通過RDP classifer軟件將OTU代表序列與數據庫Greengene比對,得到每個樣本的物種分類信息,并在各個水平(門,綱,目,科,屬,種)進行物種注釋。基于聚類結果,進行Alpha多樣性分析 [Chao1指數()、Ace指數(Ace)、香農指數(Shannon index)、辛普森指數()]和Beta多樣性分析 [層級聚類樹分析(hierarchical clustering tree analysis)和主成分分析(principal component analysis,PCA)]。采用線性判別式分析 [linear discriminant analysis(LDA)effect size,LEfSe] 找到組間在豐度上有差異的物種,結果用LDA值分布柱狀圖及進化分支圖表示,LDA值(log 10)>2的物種被認為具有顯著性差異[17]。使用冗余分析(redundancy analysis,RDA)及Spearman系數分析腸道菌群與趨化因子水平的相關性。
2.10 統計學方法處理
3 結果
3.1 一般情況觀察
給藥3 d后,對照組小鼠食欲旺盛、外觀肥滿、被毛光澤、行動敏捷、呼吸均勻、大小便正常、體溫正常、體質量無明顯變化。模型組食欲減退、被毛雜亂、豎毛明顯、弓背、扎堆、精神萎靡、倦怠懶動、呼吸短促、腹式呼吸明顯,小便正常,大便稀軟不成形,體溫降低、體質量下降。與對照組比較,模型組小鼠體質量差異有統計學意義(<0.01,圖1)。各藥物治療組小鼠呼吸漸平穩,被毛光澤度良好,大便濕潤成型,體質量減輕后漸恢復。與模型組比較,各藥物治療組體質量差異有統計學意義(<0.01,圖1)。給藥7 d后,對照組和各藥物組小鼠一般情況良好,模型組小鼠精神狀態好轉,大便漸成形,體質量增加,但與對照組和MXSGD組比較,差異仍有統計學意義(<0.05,圖1)。
3.2 小鼠結腸組織病理變化
光學顯微鏡下觀察各組小鼠結腸組織病理切片,結果見圖2。給藥3 d后,對照組結腸組織結構完整,黏膜排列整齊,腺體無萎縮,黏膜下未見明顯炎性細胞浸潤。模型組結腸黏膜上皮水腫,部分腺體萎縮,黏膜固有層可見大量炎性細胞浸潤。經藥物干預后,結腸組織損傷得到不同程度改善,固有層細胞浸潤明顯減輕。給藥7 d后,炎性細胞浸潤程度較給藥3 d后有所減輕,各藥物組結腸黏膜結構完整,層次清晰,與對照組結構相似。
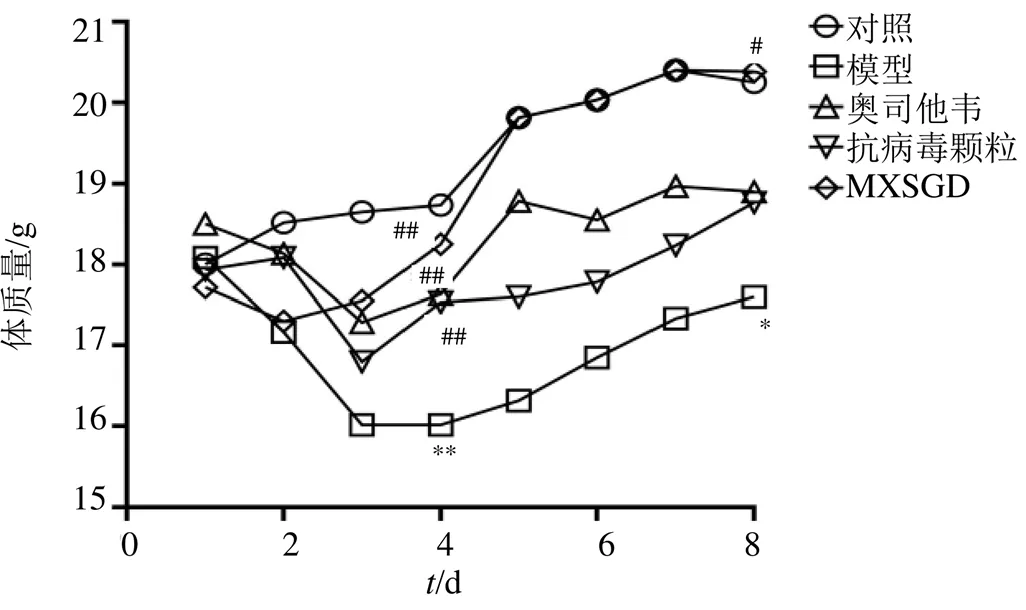
與對照組比較:*P<0.05 **P<0.01;與模型組比較:#P<0.05 ##P<0.01
3.3 小鼠結腸組織CCL5、CXCL10蛋白表達
由圖3、4可見,CCL5和CXCL10主要表達于胞漿或胞膜上。模型組結腸黏膜固有層中可見大量陽性表達細胞,對照組和各藥物組小鼠腸黏膜中也可見少量陽性表達細胞,尤其以CCL5表達更廣泛。由表1可知,給藥3 d后,模型組CCL5表達量較對照組顯著升高(<0.01),奧司他韋組、MXSGD組CCL5表達量較模型組顯著降低(<0.01);模型組CXCL10表達量較對照組顯著升高(<0.01),奧司他韋組、MXSGD組CXCL10表達量較模型組顯著降低(<0.01)。給藥7 d后,模型組CCL5表達量較對照組明顯升高(<0.05),MXSGD組CCL5表達量較模型組明顯降低(<0.05);各組CXCL10表達無顯著差異。由上述結果可知,正常情況下,小鼠結腸組織中少量表達CCL5和CXCL10。流感病毒感染可致結腸組織CCL5和CXCL10過量表達。經藥物治療后,CCL5和CXCL10表達均有不同程度下降,與抗病毒顆粒比較,奧司他韋與MXSGD能更好地降低CCL5和CXCL10表達水平。給藥7 d后,模型組CCL5仍高于對照組(<0.05),MXSGD組CCL5表達低于模型組(<0.05)。
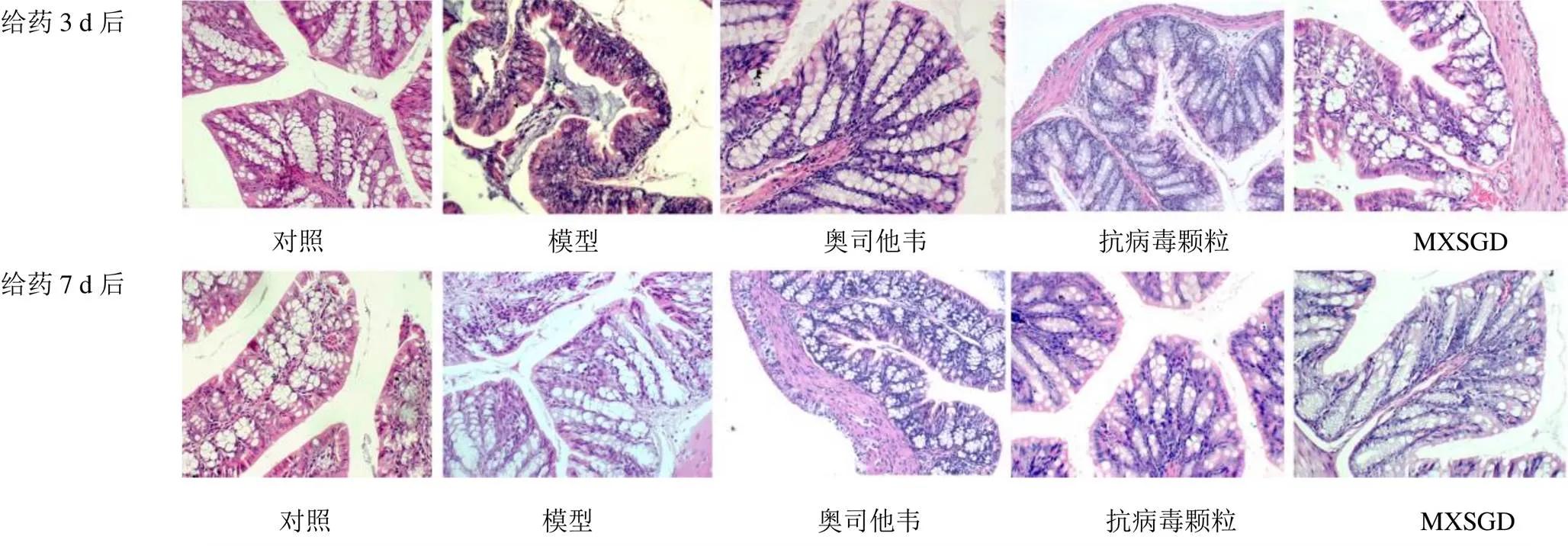
圖2 各組小鼠結腸組織病理變化 (HE染色,×200)
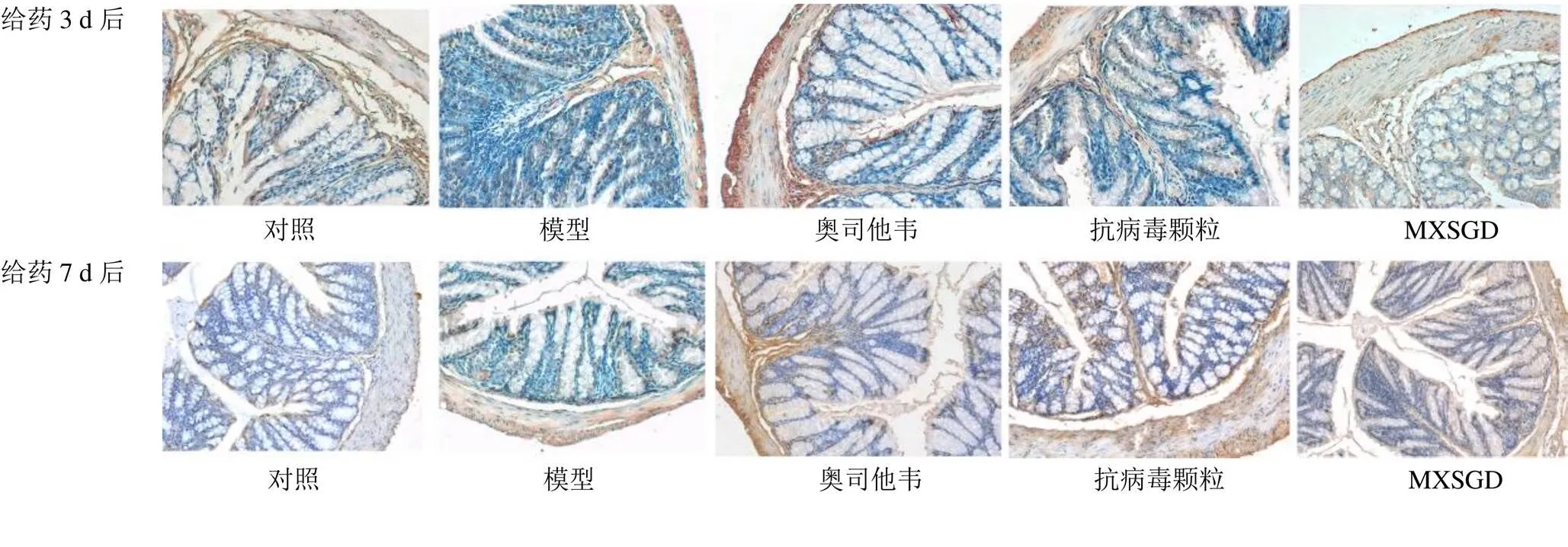
圖3 CCL5在各組小鼠結腸組織中的表達 (PV-9000通用二步法,×200)
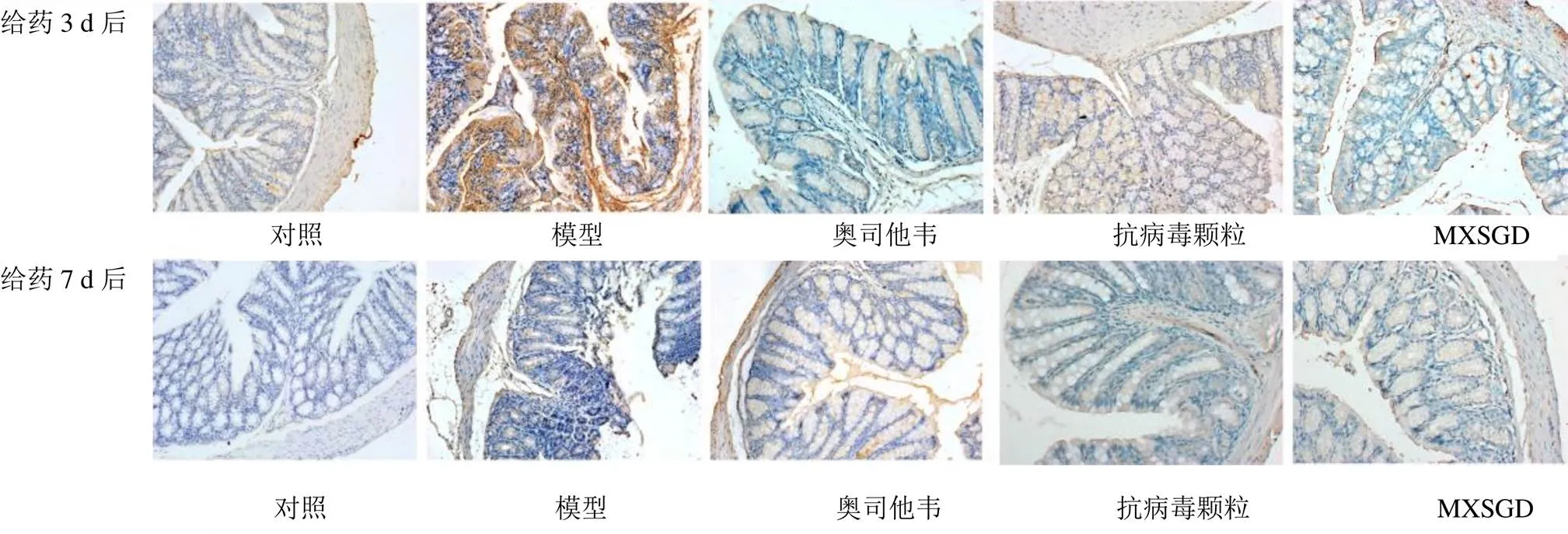
圖4 CXCL10在各組小鼠結腸組織中的表達 (PV-9000通用二步法,×200)
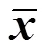
表1 各組小鼠結腸組織CCL5、CXCL10平均光密度值(±s, n = 6)
與對照組比較:*<0.05**<0.01;與模型組比較:#<0.05##<0.01,圖5同
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group, same as Figure 5
3.4 小鼠結腸組織中CCL5、CXCL10的含量
結果見圖5。給藥3 d后,模型組小鼠結腸組織中CCL5含量明顯高于對照組(<0.01);奧司他韋組、MXSGD組CCL5含量明顯低于模型組(<0.05);給藥7 d后,各組小鼠結腸組織中CCL5含量無顯著差異。給藥3 d后,模型組小鼠結腸組織中CXCL10含量明顯高于對照組(<0.01);奧司他韋組、抗病毒顆粒組、MXSGD組CXCL10含量明顯低于模型組(<0.05、0.01);給藥7 d后,各組小鼠結腸組織中CXCL10含量無顯著差異。
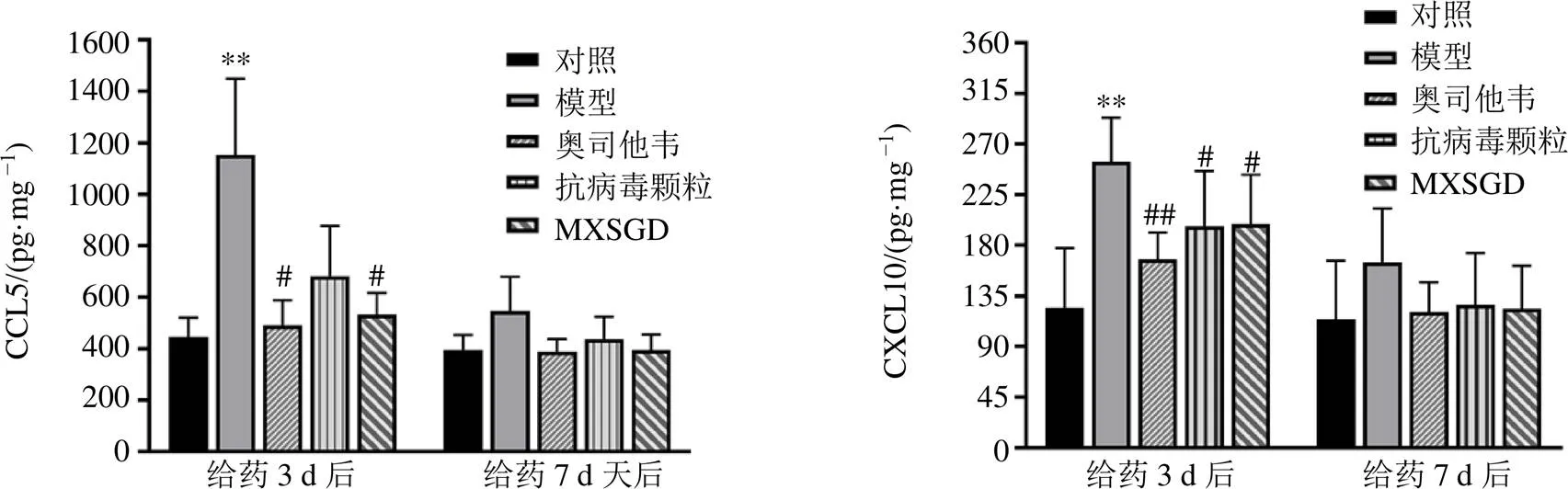
圖5 各組小鼠結腸組織勻漿CCL5和CXCL10含量
3.5 OTU聚類分析
5組小鼠2個時間點共收集30個結腸內容物樣品(每組每個時間點3個樣品),全部建庫合格,共獲得1 086 473條高質量的tags,以97%相似度聚類,共獲得483個OTU,測序覆蓋深度(覆蓋指數)0.998 8,平均每個樣品288個OTU,歸屬于9個門、50個屬。
3.6 物種分布——微生物群落結構分析
3.6.1 門(Phylum)水平分布 給藥治療后,各組小鼠的腸道優勢菌門構成及相對豐度如圖6和表2所示。腸道菌群優勢菌門以厚壁菌門(Firmicutes)和擬桿菌門(Bacteroidetes)為主。給藥3 d后,與對照組比較,模型組厚壁菌門相對豐度顯著降低(<0.01),變形菌門(Proteobacteria)相對豐度明顯增加(<0.05),厚壁菌門與擬桿菌門比值(F/B)降低,但差異不顯著;與模型組比較,奧司他韋組和MXSGD組厚壁菌門相對豐度顯著增加(<0.01),F/B值明顯增加(<0.05);各藥物組變形菌門相對豐度明顯降低(<0.05)。給藥7 d后,模型組疣微菌門(Verrucomicrobia)相對豐度較對照組明顯增加(<0.05);與模型組比較,奧司他韋組、抗病毒顆粒組、MXSGD組疣微菌門相對豐度明顯降低(<0.05、0.01),擬桿菌門相對豐度明顯升高(<0.05)。與給藥3 d后比較,給藥7 d后,模型組變形菌門相對豐度顯著下降(<0.01),F/B值明顯增加(<0.05)。
3.6.2 屬水平分布 各組小鼠腸道菌群優勢菌屬構成及相對豐度如圖7及表3所示。給藥3 d后,正常菌群優勢菌屬包括:(10.97%)、顫螺旋菌屬(6.76%)、艾克曼菌屬(6.27%)、(5.29%)、擬桿菌屬(2.62%)、乳桿菌屬(1.90%)、糞球菌屬(1.11%)、瘤胃球菌屬(3.46%)等;與對照組比較,模型組糞球菌屬、乳桿菌屬、普雷沃菌屬相對豐度明顯降低(<0.05),埃希菌屬()相對豐度明顯增加(<0.05);與模型組比較,奧司他韋組、抗病毒顆粒組和MXSGD組埃希菌屬相對豐度明顯降低(<0.05),抗病毒顆粒組顫螺旋菌屬相對豐度明顯增加(<0.05),MXSGD組糞球菌屬、乳酸桿菌屬相對豐度明顯增加(<0.05、0.01)。給藥7 d后,對照組優勢菌屬包括:普雷沃菌屬(11.19%)、顫螺旋菌屬(8.01%)、乳桿菌屬(5.84%)、瘤胃球菌屬(2.00%)等;與對照組比較,模型組顫螺旋菌屬相對豐度明顯下降(<0.05);與給藥3 d后比較,給藥7 d后,模型組埃希菌屬相對豐度顯著下降(<0.01)。
3.7 Alpha多樣性指數分析
常用的Alpha多樣性指數包括Chao1指數、ACE指數、Shannon指數和Simpson指數。Chao1指數和ACE指數用來評價菌群的豐富度,數值越大,說明該菌群豐富度越高。Shannon指數和Simpson指數主要用來評價菌群多樣性,Shannon指數值越大,Simpson指數值越小,說明樣品的物種多樣性越高。給藥3 d和7 d后各組小鼠腸道菌群Alpha多樣性指數見表4。給藥3 d后,與對照組比較,模型組Chao1、ACE、Shannon指數降低,Simpson指數增高(<0.05、0.01);與模型組比較,抗病毒顆粒組Chao1、ACE指數升高,差異有統計學意義(<0.05)。奧司他韋組、抗病毒顆粒組、MXSGD組Shannon指數均顯著增高,Simpson指數均顯著降低(<0.01);給藥7 d后,與對照組比較,模型組Shannon指數明顯降低(<0.05);與模型組比較,抗病毒顆粒組Shannon指數明顯增高(<0.05)。上述結果提示,流感病毒感染4 d后(給藥3 d后),模型組小鼠腸道菌群豐富度和多樣性明顯降低,抗病毒顆粒能增加小鼠腸道菌群豐富度和多樣性;奧司他韋、MXSGD能增加小鼠腸道菌群多樣性;流感病毒感染8 d后(給藥7 d后),模型組小鼠腸道菌群多樣性仍低于對照組,抗病毒顆粒可以增加小鼠腸道菌群多樣性。
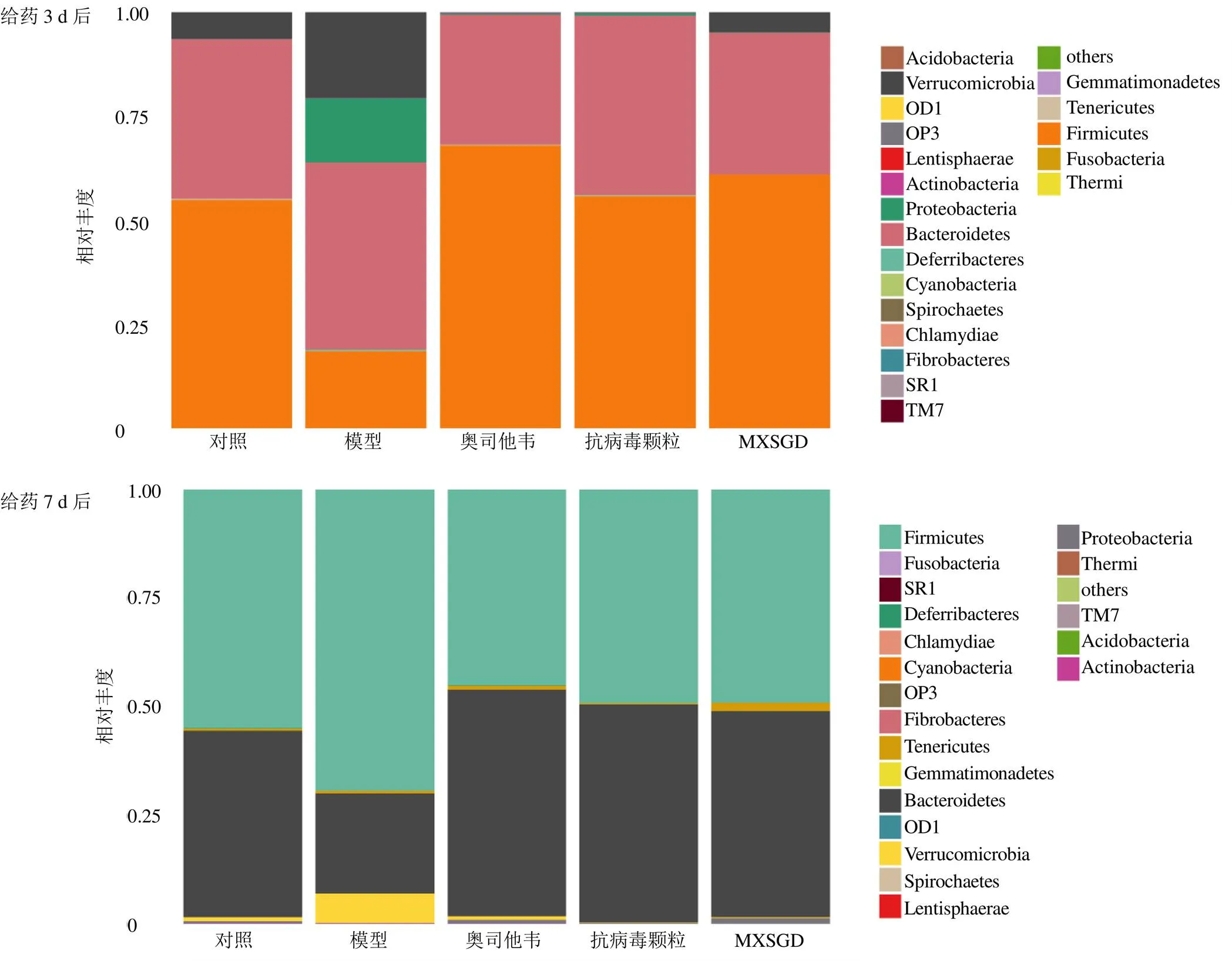
圖6 各組小鼠腸道菌群在門水平上分布
表2 各組小鼠腸道菌群門水平相對豐度 (±s, n = 3)
與對照組比較:*<0.05**<0.01;與模型組比較:#<0.05##<0.01;與給藥3 d后比較:^<0.05 ^^<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group; ^< 0.05 ^^< 0.01corresponding groups after 3 d of administration
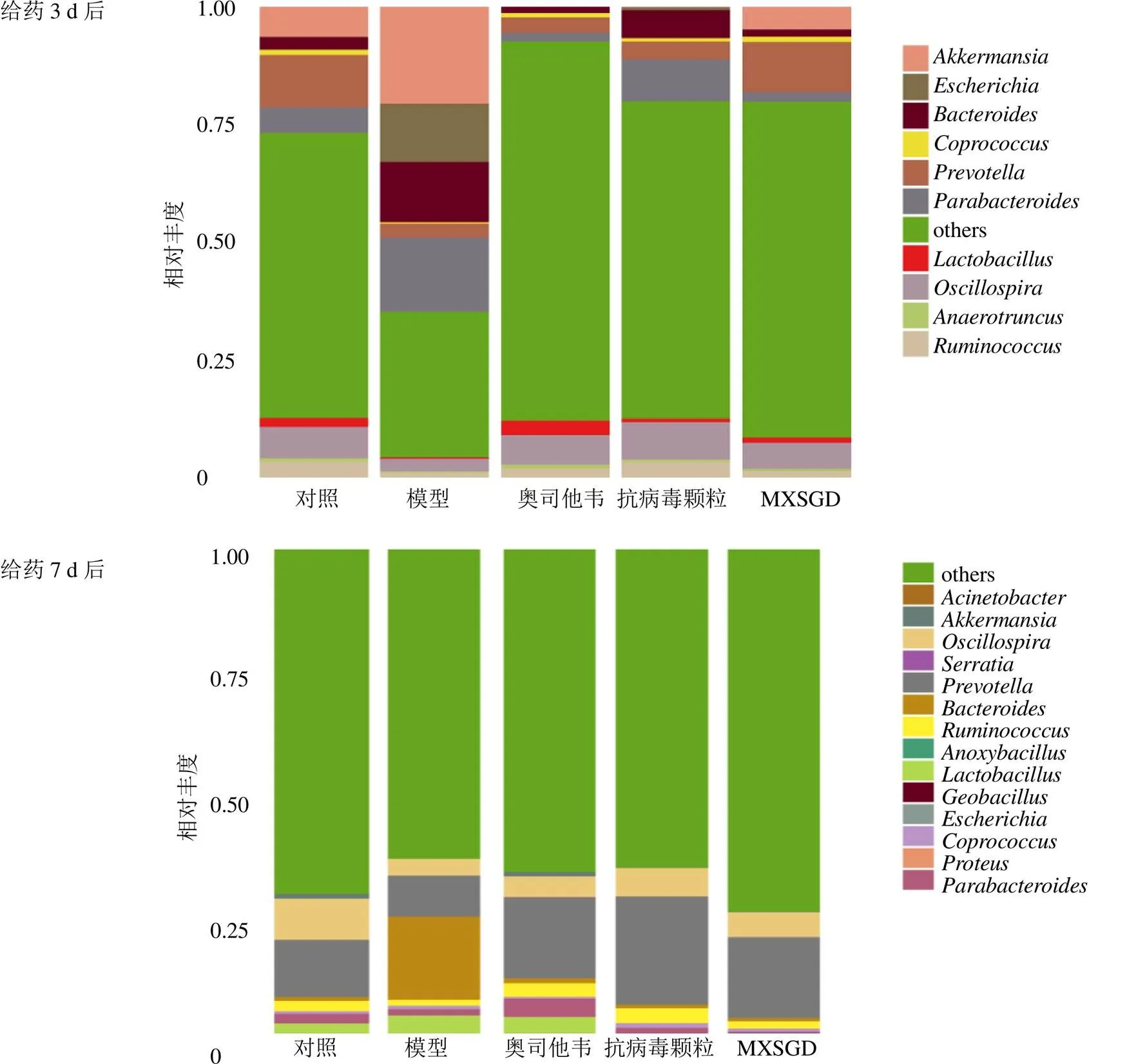
圖7 各組小鼠腸道菌群在屬水平分布
表3 各組小鼠腸道菌群屬水平相對豐度(±s,n=3)
與對照組比較:*<0.05**<0.01;與模型組比較:#<0.05##<0.01;與給藥治療3 d比較:^<0.05 ^^<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model control group; ^< 0.05 ^^< 0.01corresponding groups after 3 d of administration
3.8 Beta多樣性分析
Beta多樣性分析主要對不同樣品/不同組間樣品微生物群落構成進行比較分析,常用PCA和層級聚類樹分析。PCA是常用的一種降維分析方法,通過將方差進行分解,將多組數據的差異反映在二維坐標圖上,圖中兩樣品點距離越近,表示它們的物種組成越相似,反之亦然。層級聚類樹可以清楚看出每個樣品的距離遠近,根據樹枝的距離可以劃分出不同的分組。PCA結果(圖8-a)提示,給藥3 d后,模型組各樣品點與對照組樣品點距離較遠,表明兩組樣品之間細菌群落組成存在明顯差異,說明流感病毒感染可以影響正常小鼠腸道菌群的組成和結構。藥物治療組各樣品點與對照組各樣品點距離接近,且明顯偏離于模型對照組各樣品點,提示藥物組群落組成與對照組更相似。層級聚類樹分析結果(圖8-b)提示,模型組細菌群落結構與其他各組有明顯差異。說明奧司他韋、抗病毒顆粒和MXSGD均可以調節流感病毒感染后小鼠腸道菌群組成結構。給藥7 d后,各組PCA與層級聚類樹分析結果(圖8-c、d)提示,PCA結果顯示模型組樣品點仍然偏離于其余各組樣品點,各藥物組樣品點與對照組樣品點間距離較給藥3 d后更接近。層級聚類樹分析結果顯示,MXSGD組與對照組腸道菌群組成更相似。
表4 各組小鼠腸道菌群Alpha多樣性指數統計分析結果(±s,n=3)
與對照組比較:*<0.05**<0.01;與模型組比較:#<0.05##<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group
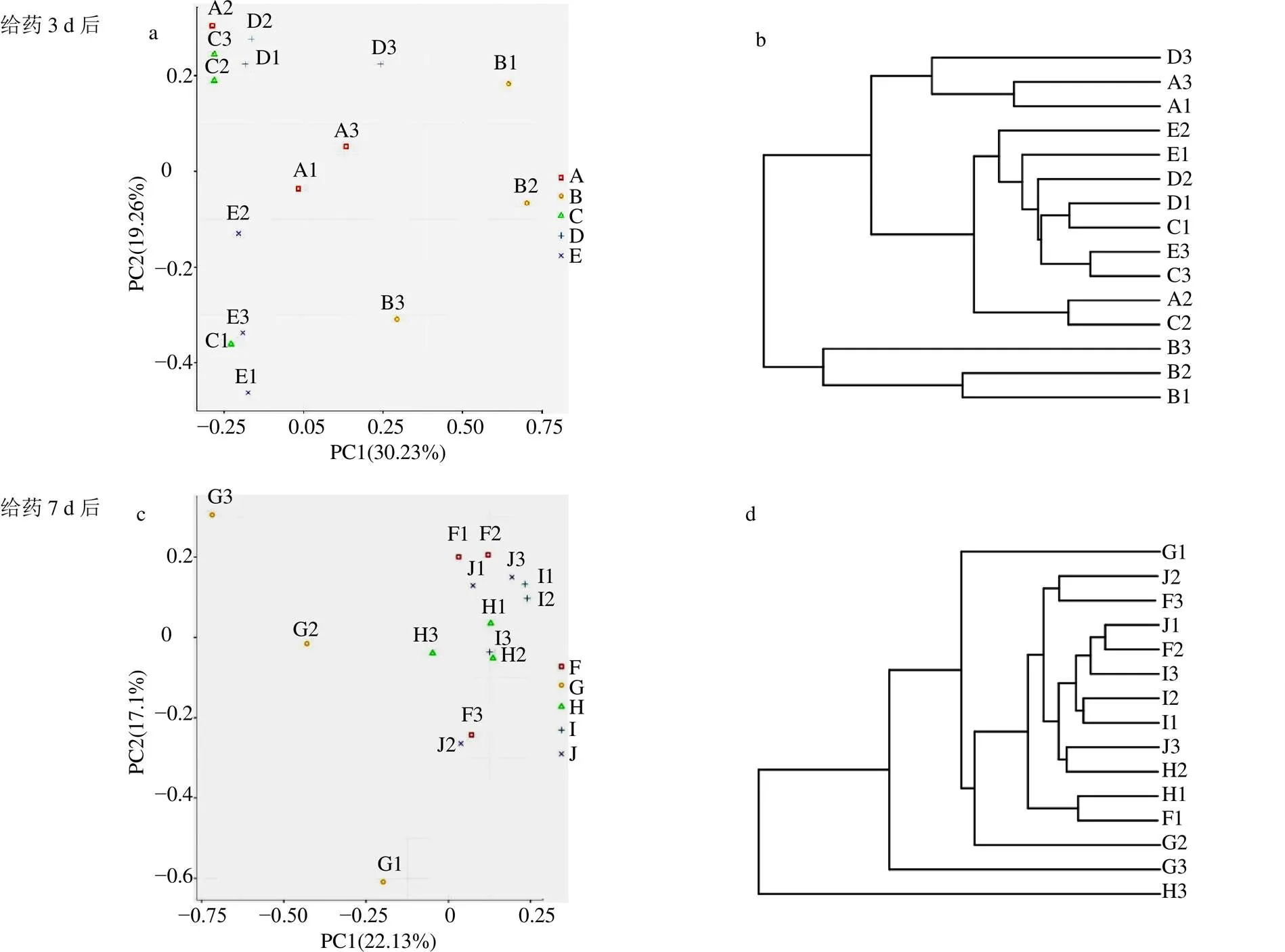
a、c-PCA b、d-層級聚類樹分析 A1~A3、F1~F3-對照組 B1~B3、G1~G3-模型組 C1~C3、H1~H3-奧司他韋組 D1~D3、I1~I3-抗病毒顆粒組 E1~E3、J1~J3-MXSGD組
3.9 組間差異物種的篩選
采用LEfSe篩選組間具有顯著差異的物種。LDA值超過設定值(常以>3.5為篩選標準)的物種,即被認為是組間具有統計學差異的生物標記物(biomarker),并根據差異物種繪制物種進化分支圖。在進化分支圖中,由內至外輻射的圓圈代表由界至屬(或種)的分類級別。在不同分類級別上的每一個小圓圈代表該水平下的一個分類,小圓圈直徑大小與相對豐度大小呈正比。無顯著差異的物種統一著色為黃色,差異物種生物標記物跟隨組進行著色。圖9-a~h顯示,給藥3 d后,模型組與其他各組比較具有顯著差異的優勢物種為變形菌門、γ-變形桿菌綱(Gammaproteobacteria)、腸桿菌目(Enterobacteriales)、腸桿菌科(Enterobacteriaceae)、埃希菌屬、克雷伯菌屬、沙雷氏菌屬、變形桿菌屬,疣微菌門、疣微菌綱(Verrucomicrobiae)、脫鐵桿菌目(Deferribacterales)、脫鐵桿菌屬、多拉菌屬等;與模型組比較,對照組具有顯著優勢的物種為厚壁菌門、梭菌綱(Clostridia)、瘤胃菌科(Ruminococcaceae)、瘤胃菌屬、顫螺旋菌屬、毛螺菌科(Lachnospiraceae)、糞球菌屬、紅蝽菌綱(Coriobacteriia)、紅蝽菌目(Coriobacteriales)、紅蝽菌科(Coriobacteriaceae)、羅斯氏菌屬等;奧司他韋組具有顯著優勢的物種為厚壁菌門、梭菌綱、瘤胃球菌科、顫螺旋菌屬、乳桿菌目(Lactobacillales)等;抗病毒顆粒組具有顯著優勢的物種為厚壁菌門、梭菌綱、瘤胃球菌科、顫螺旋菌屬;MXSGD組具有顯著優勢的物種為普雷沃菌科(Prevotellaceae)、普雷沃菌屬、厚壁菌門、梭菌綱、瘤胃球菌科、顫螺旋菌屬、乳桿菌目、乳桿菌科(Lactobacillaceae)、乳桿菌屬、毛螺菌科、糞球菌屬、丁酸梭菌屬等。給藥7 d天后,各組間顯著差異物種不明顯(LDA值<3.5)。
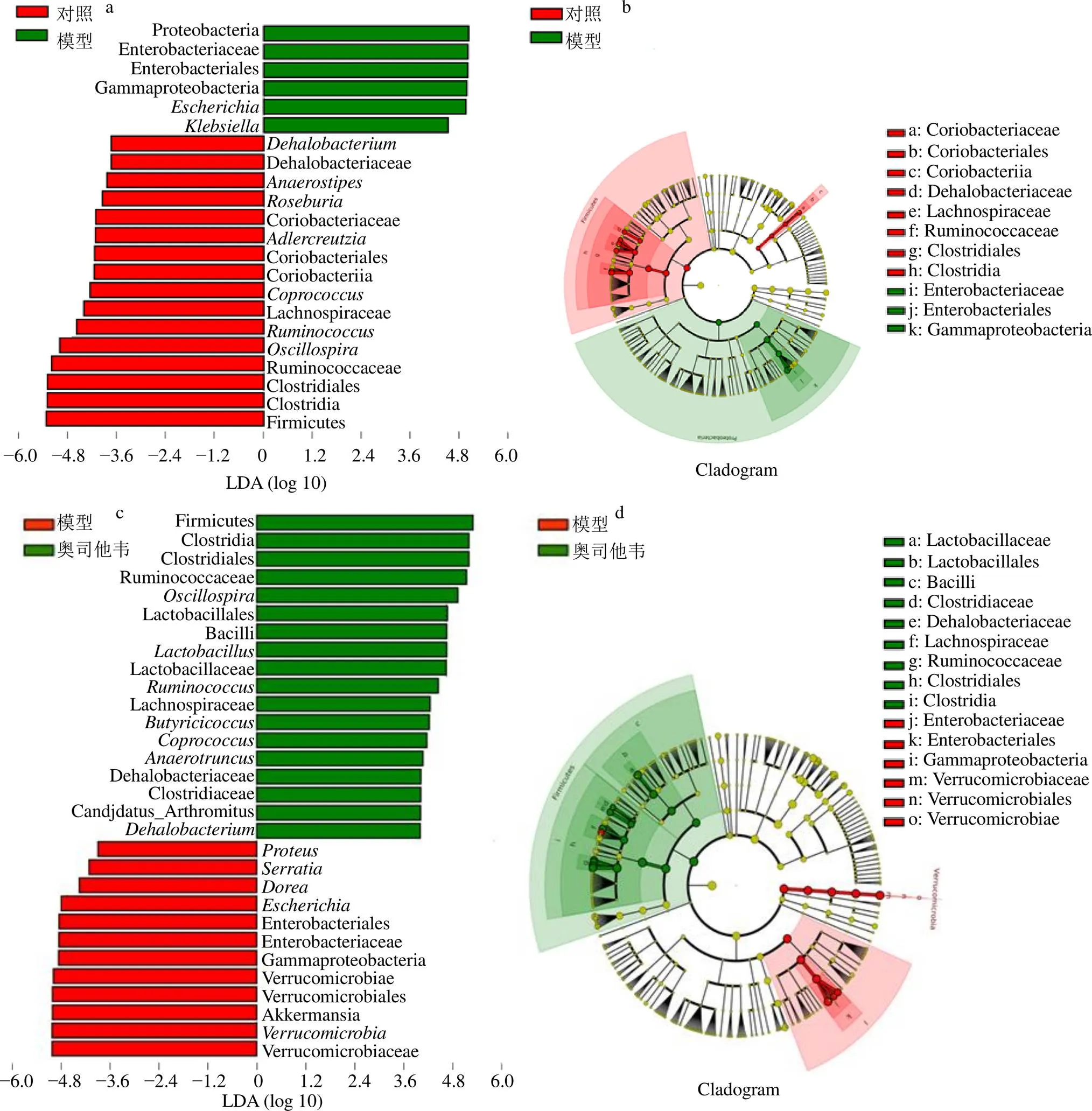
a-對照組和模型組LDA值分布柱狀圖 b-對照組和模型組進化分支圖 c-模型組和奧司他韋組LDA值分布柱狀圖 d-模型組和奧司他韋組進化分支圖 e-模型組和抗病毒顆粒組LDA值分布柱狀圖 f-模型組和抗病毒顆粒組進化分支圖 g-模型組和MXSGD組LDA值分布柱狀圖 h-模型組和MXSGD組進化分支圖
a-histogram of LDA scores in normal control group and model control group b-cladogram in normal control group and model control group c- histograms of LDA scores in model control group and oseltamivir group d-cladogram in model control group and oseltamivir group e-histograms of LDA scores in model control group and antivirus granule group f-cladogram in model control group and antivirus granule group g-histograms of LDA scores in model control group and MXSGD group h-cladogram in model control group and MXSGD group
圖9 各組小鼠腸道菌群LEfSE差異分析結果
Fig. 9 LEfSE difference analysis in various groups
3.10 腸道菌群與趨化因子關聯性分析
通過RDA及Spearman等級相關系數分析各組小鼠結腸組織中趨化因子CCL5、CXCL10與腸道菌群的關聯性。結果(圖10)顯示,小鼠腸道菌群的分布與腸黏膜趨化因子CCL5和CXCL10含量的相關性具有顯著性差異。在門水平上:變形菌門、疣微菌門、脫鐵桿菌門、擬桿菌門與CCL5和CXCL10含量呈正相關;厚壁菌門、放線菌門(Actinobacteria)與CCL5和CXCL10含量呈負相關。在屬水平上:埃希菌屬、梭菌屬、變形桿菌屬、克雷伯菌屬、沙雷氏菌屬、擬桿菌屬、屬與CCL5和CXCL10含量呈正相關;乳桿菌屬、厭氧棒狀菌屬、糞球菌屬、顫螺旋菌屬、普雷沃菌屬、瘤胃球菌屬、丁酸梭菌屬、低嗜鹽細菌屬與CCL5和CXCL10含量呈負相關。其中,埃希菌屬、克雷伯菌屬、梭菌屬、變形菌屬、沙雷氏菌屬、糞球菌屬、厭氧棒狀菌屬與CCL5和CXCL10相關性顯著(<0.05、0.01);低嗜鹽細菌屬、擬桿菌屬、乳桿菌屬與CCL5相關性顯著(<0.05、0.01);顫螺旋菌屬與CXCL10相關性顯著(<0.05)。
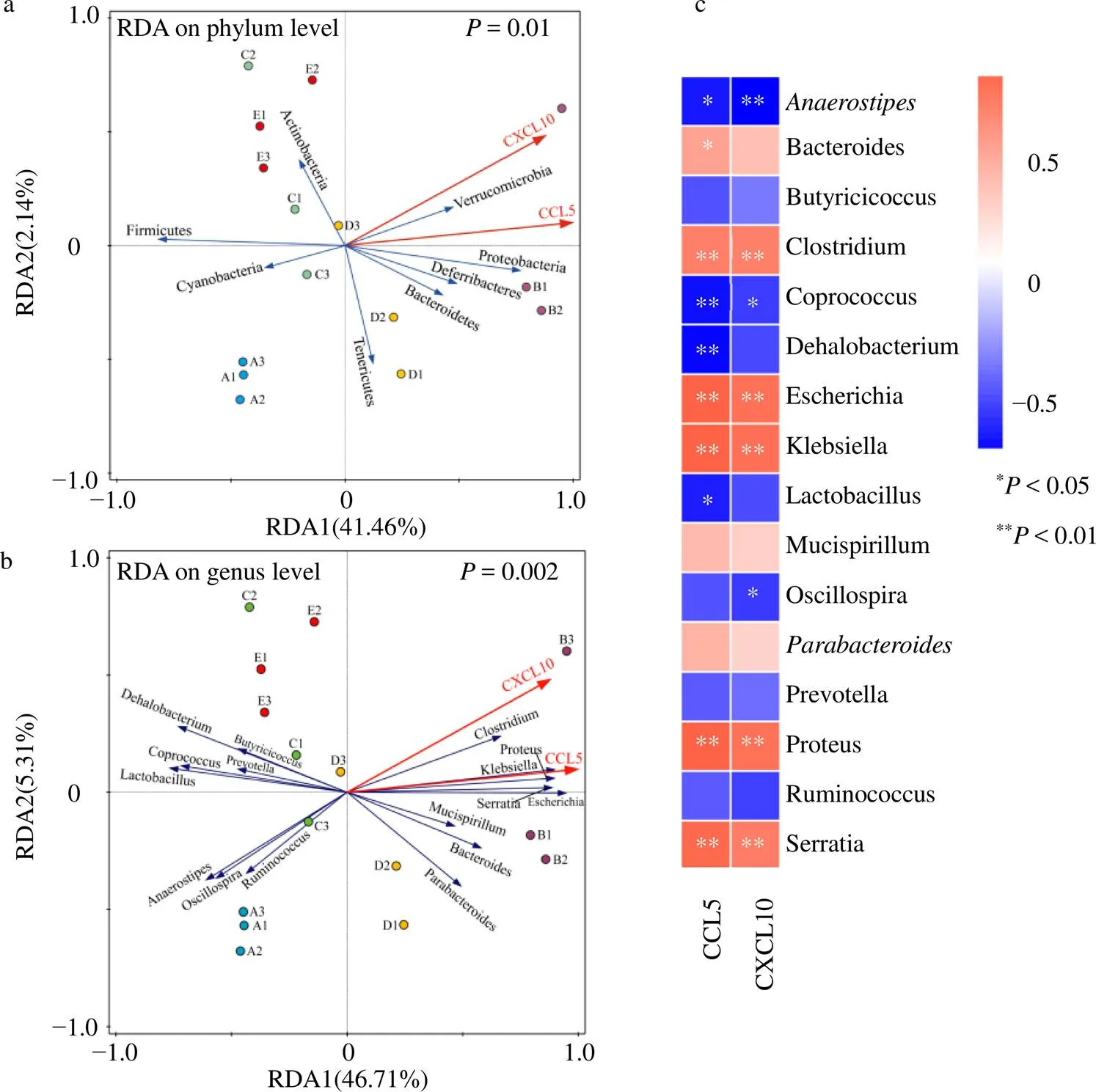
a-RDA分析(門水平) b-RDA分析(屬水平) c-Spearman相關熱圖 A1~A3-對照組 B1~B3-模型組 C1~C3-奧司他韋組 D1~D3-抗病毒顆粒組 E1~E3-MXSGD組
4 討論
MXSGD為漢代張仲景《傷寒論》名方,具有宣肺平喘、祛除寒濕、通腑瀉熱兼燥濕健脾之功效,是治療證屬熱毒襲肺和熱毒壅肺流感的基本方[18]。2019年12月以來爆發的新型冠狀病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染肺炎(corona virus disease 2019,COVID-19)疫情中,MXSGD是國家及各地方衛生管理部門發布的診療方案中被推薦使用頻次最高的中藥方劑之一[19],是國家衛生健康委員會發布的系列《新型冠狀病毒的肺炎診療方案》中推薦在臨床治療期使用的“清肺排毒湯”的重要組成部分[20]。
前期研究發現,趨化因子可能是流感“肺病及腸”的物質基礎之一[11]。流感病毒感染的單核/巨噬細胞可迅速產生CC家族趨化因子(如CCL5),以及CXC家族趨化因子(如CXCL10),這些趨化因子的急劇升高與流感病毒感染引起的炎癥病理損傷密切相關。CCL5也被命名為RANTES(regulated upon activation normal T cell expressed and secreted),由上皮細胞、CD8+T、CD4+T、單核巨噬細胞產生,對單核細胞、嗜堿性粒細胞和T細胞有強烈的趨化作用,能促進白細胞向炎癥部位遷移和浸潤。CXCL-10又被稱作γ干擾素誘導蛋白(interferon-gamma-induced protein,IP-10),是一種屬于CXC趨化因子家族的小分子蛋白質,與流感病毒感染引起的肺部損傷的嚴重程度密切相關,由IFN-γ、腫瘤壞死因子-α(tumor necrosis factor,TNF-α)、病毒RNA等誘導上皮細胞、內皮細胞、單核巨噬細胞、成纖維細胞和淋巴細胞產生,可趨化T淋巴細胞、自然殺傷細胞和單核細胞聚集,促進IFN-γ、IL-6、IL-8等多種促炎細胞因子分泌[21]。因此,抑制CCL5和CXCL10過表達,對于控制流感病毒感染引起的炎癥反應有重要意義。
已有研究發現,腸道菌群及其代謝產物可影響宿主局部或全身免疫功能。短鏈脂肪酸(short chain fatty acids,SCFAs)是腸道有益菌發酵膳食纖維的重要產物,主要包括乙酸、丙酸、丁酸等。已有研究發現,厚壁菌門是丁酸鹽的重要來源,丁酸鹽是細胞的主要能量底物,厚壁菌門和擬桿菌門比值降低可以直接影響腸道菌群對膳食纖維代謝,使SCFAs濃度降低,厚壁菌門減少可誘發或加重局部炎癥反應[22]。變形菌門是腸道的4個主要菌門(厚壁菌門、擬桿菌門、變形菌門、放線菌門)中隨時間變化最不穩定的菌門,變形菌門豐度增加被視為反映腸道菌群紊亂的一個標志及潛在的疾病診斷指標[23]。變形菌門能夠有效利用炎癥反應產生的硝酸鹽作為電子受體,進行厭氧呼吸,因此在炎癥環境中,比依賴發酵生長的厚壁菌門和擬桿菌門更具增殖優勢,其過度生長可進一步加重局部炎癥反應[23]。研究發現,SCFAs可以誘導調節性T細胞(regulatory cells,Tregs)的產生和分化,從而促進抑炎細胞因子IL-10產生,并且可以強烈減少促炎趨化因子CCL3、CCL4、CCL5、CXCL9、CXCL10、CXCL11的釋放,從而抑制白細胞遷徙,具有很強的抗炎作用[24]。普雷沃菌屬、瘤胃球菌屬、糞球菌屬、丁酸梭菌屬、乳酸桿菌屬均可增加腸道內SCFAs含量,誘導小鼠腸道中Treg細胞的產生和分化,促進IL-10的產生,發揮炎癥抑制作用[25-27]。顫螺旋菌屬在炎癥疾病中豐度降低,與健康呈正相關,對人體健康具有潛在的重要性[28]。而過度生長的大腸埃希菌或肺炎克雷伯菌等可以促進CCL5及CXCL10等趨化因子的表達,從而加重炎性損傷程度[7-8]。
研究發現,流感病毒感染后模型組小鼠腸黏膜出現明顯病理變化,黏膜下層和固有層中見大量炎性細胞浸潤,炎性細胞胞漿和胞膜上有大量趨化因子CCL5和CXCL10表達。Alpha多樣性分析結果顯示模型組小鼠腸道菌群豐富度和多樣性明顯降低。Beta多樣性分析結果顯示模型組小鼠腸道菌群組成結構與對照組和各藥物組明顯不同。病毒感染后第4天,與對照組比較,模型組厚壁菌門相對豐度明顯下降,厚壁菌門與擬桿菌門比值(F/B)明顯降低,變形菌門相對豐度顯著增加,埃希菌屬相對豐度增加,糞球菌屬、乳桿菌屬、普雷沃菌屬豐度下降。LEfSe分析結果顯示,克雷伯菌屬也是模型組的優勢菌屬。經藥物治療3 d后,各藥物組腸黏膜炎性細胞浸潤明顯減少,CCL5及CXCL10表達明顯降低;Alpha多樣性分析結果顯示各藥物組腸道菌群多樣性增加,抗病毒顆粒組菌群豐富度增加;Beta多樣性分析結果顯示,在各藥物組中,MXSGD組小鼠腸道菌群組成更接近對照組;與模型組比較,各藥物組變形菌門、埃希菌屬相對豐度均降低,奧司他韋組和MXSGD組厚壁菌門相對豐度及F/B值明顯增加,MXSGD組乳桿菌屬和糞球菌屬相對豐度顯著增加;此外,LEfSe分析的結果提示,MXSGD組的優勢物種還包括瘤胃球菌科、顫螺旋菌屬、毛螺菌科、丁酸梭菌屬等。通過相關性分析進一步發現,埃希菌屬、克雷伯菌屬、變形桿菌屬等與CCL5和CXCL10含量呈顯著正相關,糞球菌屬、厭氧棒狀菌等與CCL5和CXCL10含量呈顯著負相關,乳桿菌屬與CCL5含量呈顯著負相關,顫螺旋菌屬與CXCL10含量呈顯著負相關。CCL5和CXCL10表達下調,也可能會影響抗病毒細胞因子IFN-γ產生,從而影響機體抗病毒感染免疫。但前期研究[29]發現,MXSGD可以促進細胞因子IL-2產生,IL-2可以刺激T細胞快速增殖分化產生IFN-γ。可見,MXSGD可以通過調節復雜的細胞因子網絡,減少炎癥因子表達下調對機體抗感染免疫帶來的負面影響。
綜上所述,流感病毒感染后,小鼠腸道菌群組成結構明顯紊亂,且結腸組織中趨化因子CCL5和CXCL10的表達明顯增強。相關性分析結果顯示,腸道菌群與趨化因子CCL5和CXCL10表達顯著相關。奧司他韋、抗病毒顆粒和MXSGD均能夠不同程度修復流感病毒感染后紊亂的腸道菌群,并降低結腸組織中趨化因子CCL5和CXCL10的表達。與其他藥物組比較,MXSGD組腸道菌群結構更接近對照組水平,MXSGD能更好促進乳桿菌屬和糞球菌屬益生菌生長,且對流感病毒誘導的CCL5和CXCL10過表達均有一定的抑制作用。因此,腸道菌群可以作為MXSGD防治流感的一個潛在靶點,MXSGD可能通過調節菌群結構進而下調趨化因子水平,緩解流感病毒感染所致免疫炎癥損傷,其具體作用機制值得進一步深入研究。
利益沖突 所有作者均聲明不存在利益沖突
[1] Laetitia M, Charrel R N, Pierre-Emmanuel C,. Prevalence of gastrointestinal symptoms in patients with influenza, clinical significance, and pathophysiology of human influenza viruses in faecal samples: what do we know? [J]., 2015, 12: 215-224.
[2] Wang J, Li F, Wei H,. Respiratory influenza virus infection induces intestinal immune injury via microbiota-mediated Th17 cell-dependent inflammation [J]., 2014, 211(12): 2397-2410.
[3] 劉雨琪, 朱俊萍, 何秋水. 流感病毒與腸道菌群的相互作用對感染結局的影響 [J]. 醫學綜述, 2019, 25(14): 2746-2758.
[4] Li H, Liu X, Chen F,. Avian influenza virus subtype H9N2 affects intestinal microbio-ta, barrier structure injury, and inflammatory intestinal disease in the chicken ileum [J]., 2018, 10(5): 270-284.
[5] Tavares L P, Garcia C C, Gon?alves A,. ACKR2 contributes to pulmonary dysfunction by shaping CCL5: CCR5-dependent recruitment of lymphocytes during influenza A infection in mice [J]., 2020, 318(4): L655-L670.
[6] 胡艮娣, 王曉泉, 陳祥, 等. 趨化因子IP-10在介導病毒感染性疾病中的研究進展 [J]. 病毒學報, 2019, 35(4): 672-678.
[7] Karlsson I, Hagman R, Guo Y,. Pathogenicand lipopolysaccharide enhance the expression of IL-8, CXCL5, and CXCL10 in canine endometrial stromal cells [J]., 2015, 84(1): 34-42.
[8] 楊明, 麻雅婷, 何賞, 等. LIF和RANTES在單病原菌性血流感染小鼠模型中的表達及意義 [J]. 臨床檢驗雜志, 2018, 36(1): 53-56.
[9] 李玲, 魏科, 盧芳國, 等. 基于TLR4-MyD88-TRAF6信號通路的麻杏石甘湯抗A型流感病毒感染小鼠所致的病毒性肺損傷研究 [J]. 中草藥, 2017, 48(8): 1591-1596.
[10] 張世鷹, 何谷良, 盧芳國, 等. 基于TLR7/8介導的IFN-α/β蛋白表達水平探討麻黃先煎之麻杏石甘湯抗流感病毒的機制 [J]. 中華中醫藥雜志, 2019, 34(3): 1188-1193.
[11] 鄒莉, 何谷良, 盧芳國, 等. 麻杏石甘湯對流感病毒肺部感染模型肺、結腸組織MCP-1蛋白表達水平的影響 [J]. 中國實驗方劑學雜志, 2018, 24(5): 100-106.
[12] 郭元吉, 程小雯. 流行性感冒病毒及其試驗技術 [M]. 北京: 中國三峽出版社, 1997: 129-130.
[13] 葛資宇, 童驕, 那婧婧, 等. 不同煎煮方法的麻杏石甘湯及其含藥血清對A型流感病毒神經氨酸酶活性的影響 [J]. 中國中西醫結合雜志, 2016, 36(9): 1119-1123.
[14] 饒毅, 張五萍, 魏惠珍, 等. 不同煎煮方法對麻杏石甘湯中成分變化研究 [J]. 中成藥, 2014, 36(2): 337-341.
[15] 李玲, 盧芳國, 伍參榮, 等. 麻杏石甘湯對A型流感病毒感染小鼠免疫保護作用的研究 [J]. 中醫藥學報, 2010, 38(2): 25-28.
[16] 賀石林, 王鍵, 王凈凈. 中醫科研設計與統計學 [M]. 長沙: 湖南科學技術出版社2013: 48-49.
[17] Segata N, Izard J, Waldron L,. Metagenomic biomarker discovery and explanation [J]., 2011, 12(6): R60.
[18] 趙靜, 郭洪濤, 韓經丹, 等. 中醫藥治療流行性感冒文本挖掘結果與診療方案的比較分析 [J]. 中醫雜志, 2014, 55(7): 612-616.
[19] 王哲義, 懌澤, 曲稔棟, 等. 基于網絡藥理學的麻杏石甘湯治療新型冠狀病毒肺炎(COVID-19)作用機制探討 [J]. 中草藥, 2020, 51(8): 1996-2003.
[20] 李修洋, 宋斌, 雷燁, 等.《新型冠狀病毒肺炎診療方案(試行第六版)》中醫診療方案解讀 [J]. 吉林中醫藥, 2020, 40(6): 701-708.
[21] Wang W, Yang P, Zhong Y,. Monoclonal antibody against CXCL-10/IP-10 ameliorates influ enza A (H1N1) virus induced acute lung injury [J]., 2013, 23(4): 577-580.
[22] Kho Z Y, Lal S K. The human gut microbiome-A potential controller of wellness and disease [J]., 2018, doi: 10.3389/fmicb.2018.01835.
[23] Shin N R, Whon T W, Bae J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota [J]., 2015, 33(9): 496-503.
[24] Nastasi C, Candela M, Bonefeld C M,. The effect of short-chain fatty acids on human monocyte-derived dendritic cells [J]., 2015, 5: 16148.
[25] Koh A, De Vadder F, Kovatcheva-Datchary P,. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites [J]., 2016, 165(6): 1332-1345.
[26] Louis P, Hold G L, Flint H J. The gut microbiota, bacterial metabolites and colorectal cancer [J]., 2014, 12(10): 661-672.
[27] 俞昊男, 劉志華. 腸道微生物與黏膜免疫研究的前沿進展 [J]. 中國免疫學雜志, 2019, 35(16): 1921-1930.
[28] Konikoff T, Gophna U. Oscillospira: A central, enigmatic component of the human gut microbiota [J]., 2016, 24(7): 523-524.
[29] 李玲, 吳佳敏, 歐陽建軍, 等. 抗流感病毒性肺炎的有效中藥復方篩選及機制研究 [J]. 中國免疫學雜志, 2018, 34(8): 1168-1173.
Effects of Maxing Shigan Decoction on intestinal flora and chemokines CCL5 and CXCL10 in mice infected with influenza virus
WANG Ping1, 2, ZHAO Cheng1, LU Fang-guo1, WU Tao1, ZHANG Xiang-gang1, CHEN Chun-jing1, XIAO Rong1, NING Yi1, WEI Ke1, LI Ling1, CAI Kun2, TIAN Wei-yi2
1. Hunan University of Chinese Medicine, Changsha 410208, China 2. Guizhou University of Chinese Medicine, Guiyang 550025, China
To investigate the potential mechanism of Maxing Shigan Decoction (MXSGD, 麻杏石甘湯) by affecting the intestinal flora and chemokines in mice in order to prevent and treat the influenza virus infection.The infected mice model of influenza A virus was established by intranasal inoculation. After 3 and 7 d of gavage administration or saline, the state of mice was observed. Colon tissue was detected by HE staining. The expressions and contents of chemokines CCL5 and CXCL10 were detected by immunohistochemistry and enzyme-linked immunosorbent assay, respectively. The bacteria in colonic contents was sequenced, annotated and clustered by using the V3—V4 variable region of 16S rRNA. The Alpha diversity, Beta diversity, and the species difference among groups were analyzed by linear discriminant analysis (LDA) effect size, LEfSe. Redundancy analysis and Spearman’s rank correlation coefficient were used for correlation analysis between intestinal flora and CCL5, CXCL10.Compared with the normal group, the weight of mice in the model control group was decreased (< 0.01), the inflammatory cell infiltration in the lamina propria of intestinal mucosa was obvious and the expression of CCL5 and CXCL10 was upregulated (< 0.01), the levels of CCL5 and CXCL10 in the colon tissue were both increased (< 0.01) after 3 d treatment. Compared with the model control group, the weight of mice was increased in each treatment group. Inflammatory cell infiltration, CCL5 and CXCL10 positive cells, the contents of CCL5 and CXCL10 in intestinal mucosa were all decreased, especially in oseltamivir group and MXSGD group (< 0.01,< 0.05). There were significant differences in the composition of the gut microbiota among groups according to the analysis of flora diversity and the species differences. The composition of intestinal flora in the model control group was significantly different from the normal control group and each drug group. The relative abundances of Proteobacteria andin the model control group were significantly higher than the normal control group (< 0.05), while Firmicutes,andwere significantly lower (< 0.05). Compared with the model control group, the relative abundances of Proteobacteria andin each drug group were significantly lower (< 0.05), the relative abundance of Firmicutes in oseltamivir group and MXSGD group were increased significantly (< 0.01), the relative abundance ofin antiviral granule group was increased (< 0.05), and the relative abundance ofandin MXSGD group was increased significantly (< 0.01,< 0.05). After 7 d, pathological changes of colon tissue, the expression of chemokines and the abundance of Proteobacteria andspecies (< 0.01) in the model control group were all decreased. Compared with the model control group, the relative abundances of Verrucomicrobia in each drug group were significantly lower (< 0.01,< 0.05) and the relative abundance of Bacteroidetes were increased significantly (< 0.05). Correlation analysis showed that CCL5 and CXCL10 contents in the colon of mice were significantly correlated with the abundance of,,and(< 0.01,< 0.05).The infection of influenza A virus can make the intestinal flora structure disorganized and immune function in mice unbalanced. MXSGD may regulate the intestinal flora structure and then affect the production of chemokines, which has a certain protective effect on the intestinal immune damage caused by influenza virus.
influenza A virus (IAV); Maxing Shigan Decoction; intestinal flora; chemokines; CCL5; CXCL10
R285
A
0253 - 2670(2021)01 - 0160 - 16
10.7501/j.issn.0253-2670.2021.01.020
2020-04-20
國家自然科學基金資助項目(81774126);國家自然科學基金資助項目(82074250);湖南省自然科學基金項目(2020JJ4063);湖南省教育廳創新平臺開放基金項目(17K067);湖南中醫藥大學中西醫結合一流學科開放基金(2018ZXYJH11);湖南中醫藥大學研究生創新課題立項項目(2019CX05);湖南中醫藥大學研究生創新課題立項項目(2019CX22);貴州省科技創新人才團隊(黔科合平臺人才 [2020] 5010)
王 平(1977—),女,貴州畢節人,副教授,湖南中醫藥大學在讀博士,研究方向為感染性疾病的中醫藥防治研究。
盧芳國,女,教授,博士研究生導師,研究方向為感染性疾病的中醫藥防治研究。E-mail: lufangguo0731@163.com
[責任編輯 潘明佳]

