Atox1參與調控肺癌細胞的增殖和遷移
劉克強,譚健,張衛強,馬靜波,趙京
1.解放軍總醫院第七醫學中心 胸外科,北京 100700;2.南方醫科大學 第二臨床醫學院,廣東 廣州 510280
肺癌是嚴重威脅人類生命健康的惡性腫瘤,其發病率和死亡率較高,轉移性強往往是肺癌死亡率高的因素之一[1-2]。癌癥轉移由一系列敏感地依賴于細胞遷移能力的過程組成,在局部組織浸潤時,癌細胞通過腫瘤間質和血管遷移,到達并生長在遠處轉移部位。銅是腫瘤細胞增殖和血管生成所必需的,細胞銅代謝受銅轉運蛋白和伴侶蛋白網絡的調節[3],與正常組織比較發現,腫瘤組織中銅的含量更高[4]。
Atox1是細胞內銅轉運的重要伴侶蛋白。人Atox1是一種相對分子質量為7400的可溶性蛋白質,折疊成鐵氧化還原蛋白樣βαββα結構[5]。過去幾年,大部分研究焦點集中在Atox1作為銅伴侶的功能上。Atox1的主要功能是將銅輸送到ATP7A和ATP7B[6],這種生理過程對細胞維持銅穩態至關重要。Atox1的失活或缺失將導致銅結合分泌酶(PAM)的不成熟[7]。目前多數關于Atox1的研究都是基于Atox1-ATP7A/B銅轉移模型,例如 Menkes和 Wilson 病[8]、順鉑耐藥[3]、神經元分化和血管損傷后的新內膜形成[9]等。最近的研究發現,Atox1在乳腺癌、結直腸癌、子宮癌、肝癌等癌癥中上調,與患者生存率和癌癥轉移相關[3-4,9-11]。
本研究主要探討Atox1在轉移性肺癌細胞系及非轉移性肺癌細胞系中的表達特點及其對細胞增殖和遷移的影響,初步闡明Atox1在肺癌中的生物學功能。
1 材料與方法
1.1 材料
轉移性肺癌細胞系(NCI-H292、95-D)、非轉移性肺癌細胞系(A549)、正常肺上皮細胞BEAS-2B購自中國科學院上海生命科學研究院細胞資源中心;pCMV-Atox1購自北京義翹神州生物技術有限公司;pCMV-Atox1突變型表達載體由北京海創科業生物科技有限公司構建;Atox1-shRNA慢病毒的構建和包裝由北京基石生命科技有限公司完成;RNA逆轉錄試劑盒和SYBR Green染料購自TaKaRa公司;Atox1引物購自生工生物工程(上海)股份有限公司;Atox1抗體及辣根過氧化物酶標記的二抗購自Abcam公司;CCK-8試劑盒購自日本同仁化學公司;Transwell小室購自康寧公司;F12K培養基購自Sigma公司;RPMI-1640培養基及胎牛血清購自Gibco公司。
1.2 細胞培養與細胞轉染
按培養基∶血清為9∶1配置完全培養基,轉移性肺癌細胞系NCI-H292、95-D和正常肺上皮細胞BEAS-2B采用RPMI-1640培養基培養,非轉移性肺癌細胞系A549采用F12K培養基培養。5%CO2、37℃恒溫培養箱為細胞培養環境。
細胞轉染采用LipofectAMINE 3000。6孔板中,每孔siRNA濃度為20 nmol/L,質粒用量8 μg/孔,轉染細胞24 h后進行后續實驗。
1.3 UALCAN在線分析Atox1在肺癌組織中的表達量
采用UALCAN(http://ualcan.path.uab.edu/)分析Atox1在肺癌組織及癌旁組織中的差異表達。
1.4 RNA提取及逆轉錄
采用TRIzol提取組織或細胞中的RNA,冰上裂解5~10 min后加入氯仿,混勻,靜置15 min,4℃、12 000 r/min離心沉淀RNA,吸取上清液至新的EP管中并棄去沉淀,加入等體積異丙醇,4℃靜置10 min,12 000 r/min離心10 min,加入75%酒精充分洗滌沉淀,離心去除上清液,將RNA樣品沉淀至于超凈臺干燥5 min,加入DEPC水溶解,Nanodrop測量總RNA濃度,-80℃保存。
將提取的RNA樣品置于冰上,采用逆轉錄試劑盒進行逆轉錄實驗,得到的cDNA樣品于-20℃保存待用。
1.5 qRT-PCR實驗
采用染料法試劑盒進行熒光定量PCR擴增實驗。Atox1正向引物為5′-CTCAGTCATGCCGA AGCA-3′,反向引物為 5′-CTTCAGGGTTGCAAGC AGAG-3′;GAPDH 正向引物為 5′-AGAAGGCTGG GGCTCATTTG-3′,反向引 物 為 5′-AGGGGCCATC CACAGTCTTC-3′。
1.6 蛋白質印跡
冰上裂解細胞并提取細胞中的總蛋白,BCA法檢測總蛋白濃度,向蛋白樣品中加入上樣緩沖液,進行SDS-PAGE。接著進行恒流轉膜,脫脂奶粉封閉,4℃孵一抗過夜,次日進行二抗常溫孵育,二抗孵育完成后加入化學發光液與蛋白條帶反應,凝膠成像儀觀察結果。
1.7 細胞增殖檢測
按1×104/孔接種細胞至96孔培養板,待細胞貼壁生長覆蓋率達50%左右,用LipofectAMINE 3000轉染細胞并持續培養4 d。分別于不同時間點,棄去培養基,加入用無血清培養基配置的10%CCK-8反應液,37℃恒溫培養40 min,酶標儀檢測D450nm值。
1.8 細胞遷移檢測
將轉染后24 h的5×104各組細胞接種至Transwell的上室,下室分別加入800 μL含20%胎牛血清的培養基,繼續培養24 h,取出小室,用PBS清洗3次,甲醇固定15 min,DAPI染色后在熒光顯微鏡下觀察,隨機選取5個以上視野拍照計數。
1.9 Atox1穩定敲低細胞株的建立
接種狀態良好的NCI-H292細胞至6孔板中,密度為60%~80%,待細胞貼壁后,按照病毒定量結果加入病毒上清液,6 h后更換完全培養基,轉染48 h后加入2.0 μg/mL新霉素,繼續篩選培養2周至單克隆細胞群形成。
1.10 統計學方法
采用Graphpad Prism 7.0進行統計學分析,Shapiro-Wilk檢測實驗數據均服從正態分布。多組間均值差異采用單因素方差分析,組內兩兩分析采用LSD-t,雙因素組間均值差異采用雙因素方差分析,檢測水準α<0.05雙側,實驗均重復3次以上,P<0.05表示顯著性差異,具有統計學意義。
2 結果
2.1 Atox1在肺癌組織和細胞中的表達分析
UALCAN在線分析肺癌組織與癌旁組織中Atox1的表達量,結果如圖1A,肺癌組織中Atox1的表達量明顯高于癌旁組織。采用qRT-PCR及蛋白質印跡檢測轉移性肺癌細胞系(NCI-H292、95-D)、非轉移性肺癌細胞系(A549)及正常肺上皮細胞BEAS-2B中Atox1的mRNA和蛋白表達水平,結果如圖1B、C。Shapiro-Wilk檢測實驗數據服從正態分布,S-WNCI-H292=0.995,PNCI-H292=0.859;SW95-D=0.838,P95-D=0.208;S-WA549=0.893,PA549=0.363;S-WHCC827=0.993,PHCC827=0.843。NCI-H292、95-D、A549和HCC827中Atox1的mRNA相對表達量分別為1.000±0.070、0.970±0.101、0.640±0.063、0.530±0.056,F=29.97,P<0.01;轉移性肺癌細胞系(NCI-H292,95-D)的mRNA和蛋白表達量均明顯高于非轉移性肺癌細胞系(A549)和正常肺上皮細胞BEAS-2B,差異具有統計學意義。
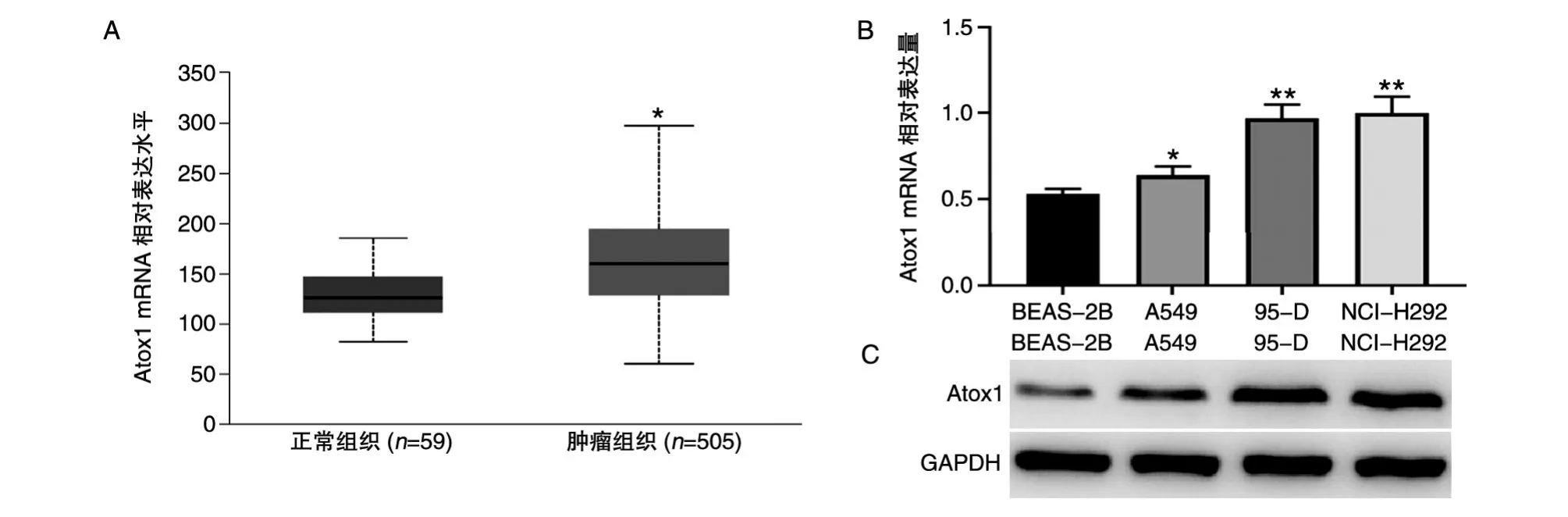
圖1 Atox1在肺癌組織和肺癌細胞系中的表達分析
2.2 敲低Atox1抑制NCI-H292細胞增殖和遷移能力
在NCI-H292細胞中用siRNA敲低Atox1,利用qPCR和蛋白印跡分別檢測Atox1 mRNA和蛋白表達水平,結果如圖2A,相比si-NC組,si-Atox1組蛋白表達量顯著降低。采用CCK-8檢測敲低Atox1對NCI-H292細胞增殖的影響,結果如圖2B,24、48及72 h si-Atox1組細胞增殖能力明顯低于si-NC組。Transwell檢測敲低Atox1對NCI-H292細胞遷移能力的影響,結果如圖2C、D,si-Atox1組細胞遷移能力顯著低于si-NC組。綜上,通過抑制Atox1的表達能夠下調NCI-H292細胞增殖和遷移能力。
2.3 過表達Atox1促進A549細胞增殖和遷移能力
在A549細胞中轉染pCMV-control和pCMVAtox1質粒,蛋白質印跡檢測蛋白表達水平,結果如圖3A,相比對照組,Atox1組蛋白表達量顯著增加。采用CCK-8檢測過表達Atox1對A549細胞增殖的影響,結果如圖3B,Atox1過表達組細胞增殖能力明顯高于對照組。Transwell檢測過表達Atox1對A549細胞遷移能力的影響,Atox1過表達組細胞遷移能力明顯高于對照質粒組(圖3C、D)。綜上,過表達Atox1能夠增加A549細胞增殖和遷移能力。
2.4 Atox1的亞細胞定位影響其功能
Atox1早期作為銅分子伴侶被大量研究,但最近研究發現Atox1還具有轉錄因子活性。Atox1對NCI-H292細胞增殖和遷移的調控是否依賴于其轉錄活性呢?首先,我們利用Atox1-shRNA慢病毒載體建立Atox1穩定敲除的NCI-H292細胞株(圖4A)。Atox1如果發揮轉錄因子活性,必然會依賴于其核定位信號進入細胞核。因此,我們分別構建了野生型和缺失核定位信號(KKTGK)[12]的突變型Atox1過表達載體(圖4B)。野生型Atox1在穩定敲除細胞株中主要定位于細胞核,而突變型Atox1則集中定位于細胞質(圖4C)。野生型Atox1能夠促進細胞增殖和遷移,而突變型Atox1的這種促進效應顯著下調(圖5A、B)。以上結果揭示Atox1對NCI-H292細胞增殖和遷移的調控可能與自身亞細胞定位和轉錄活性密切相關。
3 討論
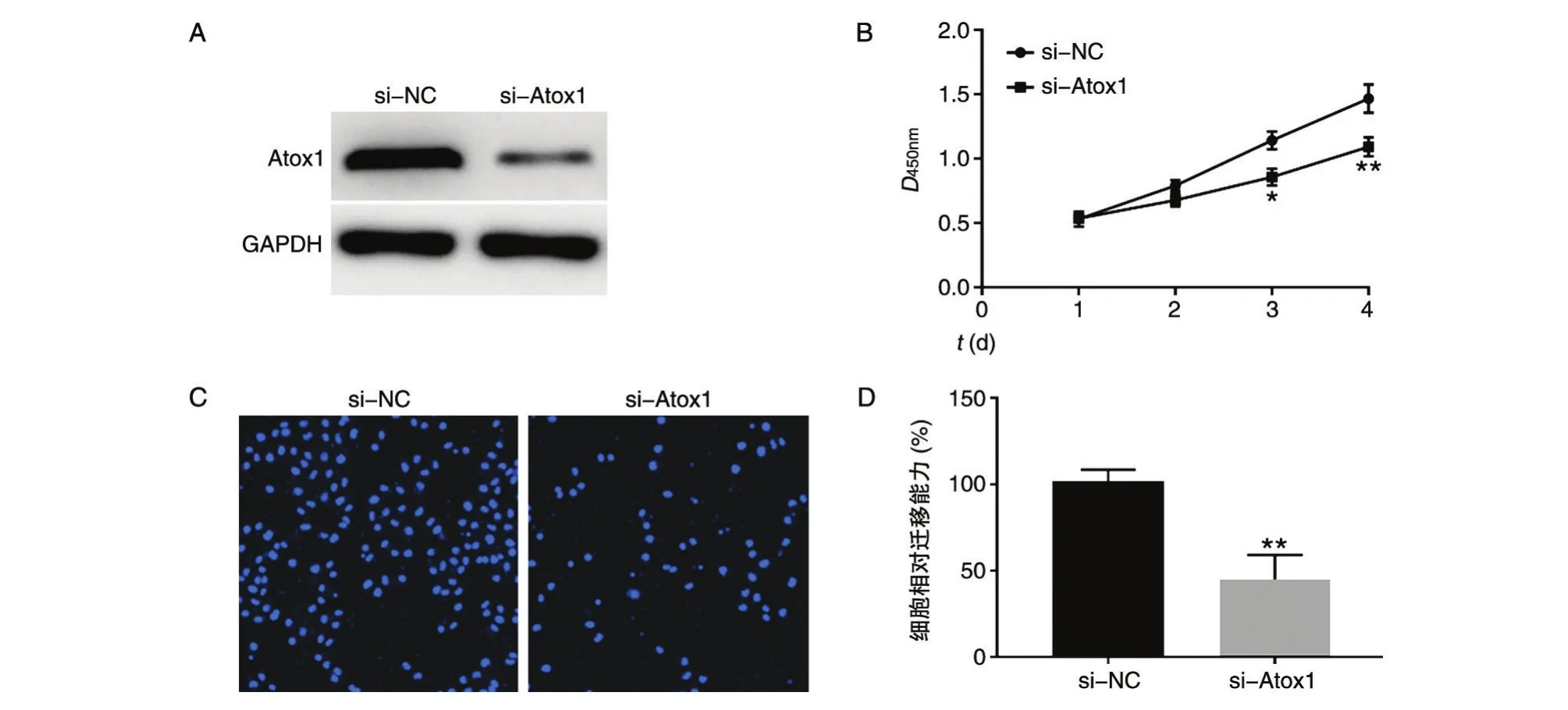
圖2 敲低Atox1對NCI-H292細胞增殖和遷移能力的影響
大多數肺癌患者死于癌癥轉移擴散,迫切需要探索新的治療方法,提高肺癌治療效果。在過去10年,肺腺癌中發現了基因組分子激活突變,并衍生出針對特異性突變的分子療法,使得某些晚期肺癌患者顯著提高了生存率[2,13]。
研究表明,細胞惡性轉化與代謝變化有關,調節腫瘤代謝的信號轉導通路中的許多分子已被作為分子癌癥治療靶點加以研究[3,14]。除了葡萄糖代謝的變化外,細胞惡性轉化還與其他代謝途徑的變化有關,包括蛋白質合成、脂肪酸代謝和金屬代謝,如銅代謝。Atox1是細胞中可以與銅結合的伴侶蛋白,參與促進細胞增殖的關鍵基因周期蛋白D1的表達,從而促進腫瘤的侵襲和轉移過程[10]。最初體內實驗研究發現銅能夠刺激小鼠胚胎成纖維細胞,并顯著促進細胞增殖、周期蛋白D1表達和進入S期,而Atox1-/-組則抵消了這些作用[12]。研究表明,在癌癥和動脈粥樣硬化的增生性病變中,細胞核中的銅含量高于正常組織。Blockhuys等研究發現Atox1聚集在轉移性乳腺癌細胞的板狀偽足邊界,并且Atox1的沉默導致了轉移缺陷,表明Atox1在乳腺癌轉移中的作用[15]。為了揭示Atox1在細胞遷移中的可能作用,他們后續探究了Atox1促進乳腺癌細胞遷移的作用機制,發現Atox1通過ATP7A-LOX軸上的銅協調運輸介導了乳腺癌細胞的遷移,Atox1可能是轉移潛能的預測指標,并可作為銅治療的生物標志物[10]。此外,通過沉默Atox1能夠增加一些抗癌治療藥物比如銅螯合劑的敏感性,激活細胞凋亡通路[16]。
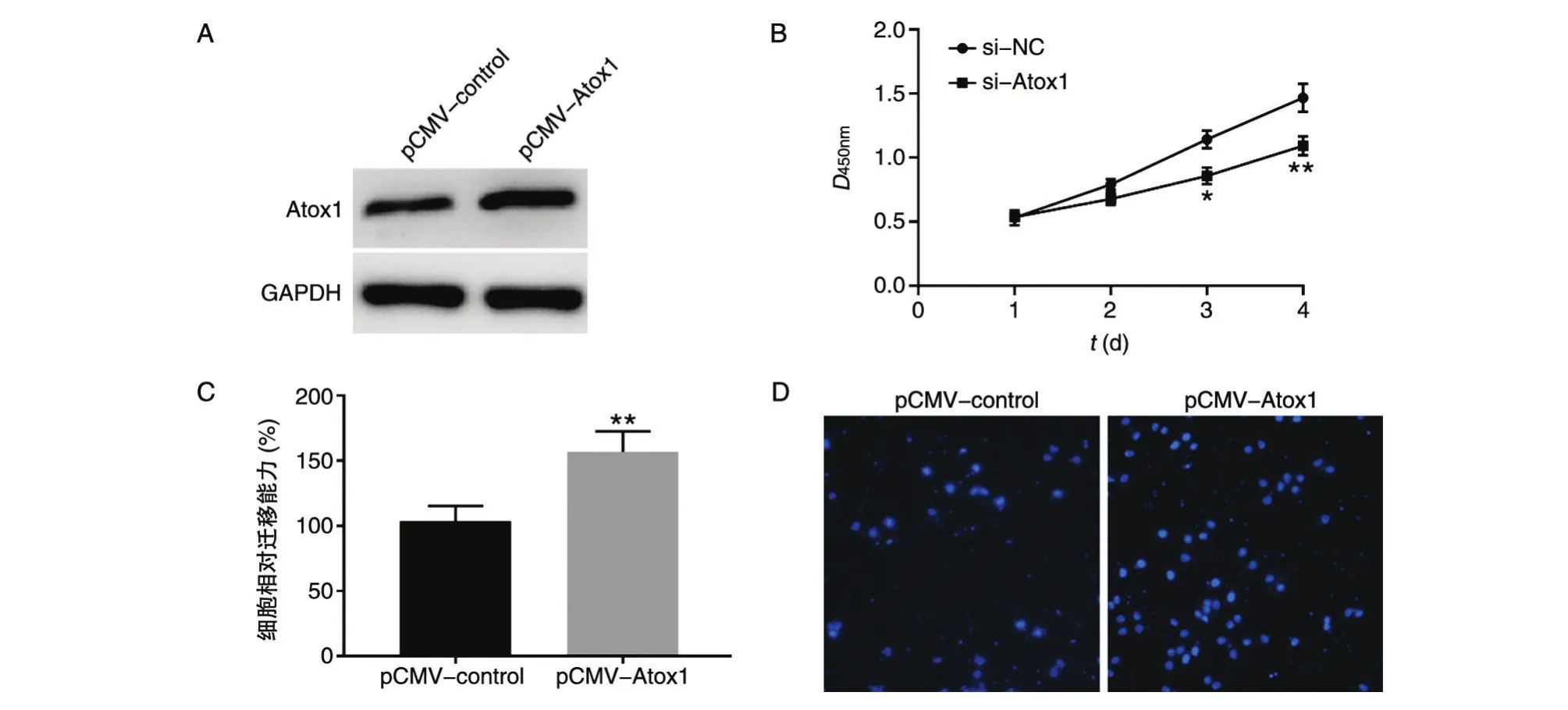
圖3 過表達Atox1對A549細胞增殖和遷移能力影響
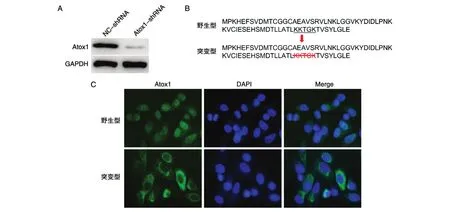
圖4 過表達野生型和缺失核定位信號的突變型Atox1
近年來研究發現,Atox1除作為銅伴侶蛋白外還具有轉錄因子的活性。Atox1能夠依靠C端高度保守的核定位信號序列KKTGK進入細胞核,在銅離子存在的情況下結合到周期蛋白D1的GAAAGA啟動子區域,提高其mRNA和蛋白表達水平,從而影響銅誘導的細胞增殖[12]。Atox1能與位于細胞外基質的超氧化物歧化酶SOD3的啟動子區GAAAGA序列結合,調控SOD3的轉錄和表達,從而影響細胞外超氧陰離子自由基的水平,影響血管氧化應激壓力,進而調控血壓和內皮功能[17]。Jana等比較了轉移性大腸癌細胞系SW620與其相關的非轉移性細胞系SW480中Atox1的細胞定位,發現相比非轉移性細胞系SW480,轉移性大腸癌細胞系SW620的Atox1核定位增加[4]。
本研究主要探究Atox1沉默對轉移性肺癌細胞系及非轉移性肺癌細胞系增殖和遷移的影響。首先,通過在線預測Atox1在肺癌組織和癌旁組織中的表達量差異,發現Atox1在肺癌組織中高表達。接著檢測了轉移性肺癌細胞系及非轉移性肺癌細胞系中Atox1的mRNA和蛋白表達,結果表明轉移性肺癌細胞系中Atox1的mRNA和蛋白表達均高于非轉移性肺癌細胞系。通過si-Atox1敲低NCI-H292細胞Atox1表達,發現明顯降低了NCI-H292細胞增殖和遷移能力;而通過在A549細胞中過表達Atox1,發現明顯促進A549細胞細胞增殖和遷移能力。進一步,我們在穩定敲除Atox1的NCI-H292細胞中回復表達野生型或缺失核定位信號的突變型Atox1,證明Atox1促細胞增殖和遷移能力與其細胞核定位密切相關,提示Atox1調控細胞增殖和遷移能力與它的轉錄活性可能相關聯。
目前報道的Atox1作為轉錄因子主要與GAAAGA啟動子區域相互作用,而GAAAGA序列在不同物種中具有高度保守性[18]。下一步,我們需要借助生物信息學確定Atox1轉錄調控的潛在靶標,進一步深入分析Atox1在肺癌細胞中調控通路。Atox1作為銅伴侶蛋白維持細胞內銅離子平衡,同時可發揮轉錄調控作用,響應細胞中多種功能性調控機制。因此,詳細理解Atox1在細胞中的功能具有重要的生物學意義。
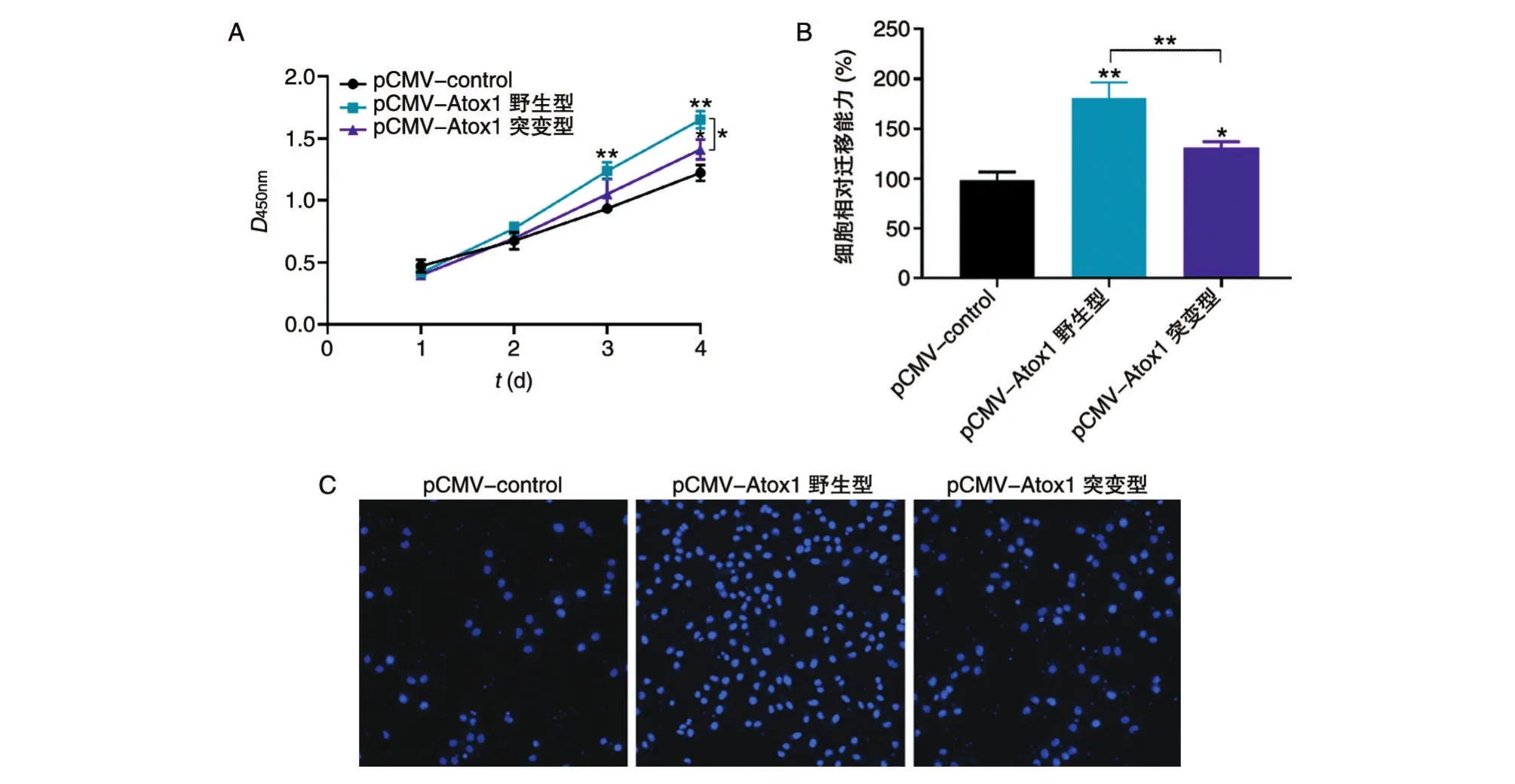
圖5 野生型與突變型Atox1的功能差異

