氧化對羊肉肌原纖維蛋白分子與理化特性的影響
張海璐,黃 翔,楊 燃,安鳳平,陸健康*,黃 群,*
(1.貴州醫科大學食品科學學院,貴州 貴陽 550025;2.福建農林大學食品科學學院,福建 福州 350001;3.塔里木大學生命科學學院,新疆 阿拉爾 843300)
紅肉、家禽和魚類肌肉的主要蛋白質是肌原纖維蛋白,約占總蛋白質的50%~55%[1]。肉制品在加工及貯藏過程中不可避免地受到環境影響,使肌原纖維蛋白和基質蛋白都受到氧化的影響,引起肌原纖維蛋白分子結構的改變,導致肉制品的理化特性如持水性、氨基酸的改變[1-2]。與脂肪氧化反應類似,蛋白氧化也是由自由基鏈式反應所引起,主要由起始、傳遞、終止3 個階段組成[3-4]。加工中各類不規范操作引入的金屬離子、與帶輻射物質接觸或加入氧化酶等因素都可能促進蛋白氧化的發生[5-7]。目前已有大量關于蛋白氧化的研究報道,將羊肉進行羥自由基氧化后研究其糜流變與凝膠特性,羊肉出現持水性下降、凝膠特性降低等現象,說明蛋白氧化使蛋白結構發生變化[8]。Xiong Youling L.等[9]研究了3 個不相同的氧化體系對豬肉肌原纖維蛋白分子結構和化學鍵的影響。Sante-Lhoutellier等[10]報道了氨基酸氧化、蛋白質聚集以及蛋白質氧化與蛋白水解之間的相互關系,發現蛋白質的氧化會誘導各種氨基酸的修飾并將其轉化為羰基衍生物。本研究主要針對羊肉中肌原纖維蛋白,采用體外模擬不同程度的氧化,探究不同氧化時間對羊肉肌原纖維蛋白分子與理化特性的影響,以期為羊肉及其制品的加工和貯藏提供理論依據。
1 材料與方法
1.1 材料與試劑
新鮮羊后腿肉(8 月齡白山羊)購自福州市山野農貿市場。
溴酚藍、三羥甲基氨基甲烷(Tris)、三氯化鐵、抗壞血酸、過氧化氫 國藥集團化學試劑有限公司;5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH) 北京索萊寶科技有限公司;N,N,N’,N’-四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED) 上海生工生物工程股份有限公司。
1.2 儀器與設備
UV-1780紫外分光光度計、傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)儀島津儀器(蘇州)有限公司;F-4600熒光分光光度計、LA8080氨基酸自動分析儀 日本日立公司;Omni多角度粒度與高靈敏度Zeta電位分析儀 美國布魯克海文儀器公司;3000粒度儀 英國馬爾文儀器有限公司;JY600E電泳儀 北京君意東方電泳設備有限公司。
1.3 方法
1.3.1 原料預處理
新鮮羊后腿肉于0~4 ℃預冷1 h,剔除多余脂肪和結締組織,將羊肉分割成大小、厚薄均等的肉塊(1 cm×1 cm×1 cm),用流水進行清洗,紙巾吸干表面水分后置于4 ℃冰箱中臨時保存。將處理后羊肉打漿6 次(每次30 s)后,打漿后肉糜密封并于4 ℃冷藏備用。
1.3.2 肌原纖維蛋白提取
肌原纖維蛋白的提取參照孫金輝等[11]的方法并稍作修改。稱取適量羊肉糜,按肉糜質量加入4 倍體積的0.05 mol/L磷酸鹽緩沖液(pH 7.0),高速勻漿1 min后,冷凍離心(3 000×g、15 min,后同),取殘渣再重復提取兩次。將殘渣與4 倍體積的0.1 mol/L NaCl溶液混合,高速勻漿30 s后冷凍離心;所得殘渣重復前述處理兩次,將所獲殘渣與4 倍體積的0.1 mol/L NaCl溶液混合,用蒸煮過的4 層紗布過濾;調節pH值至6.2,冷凍離心所得肌原纖維蛋白于4 ℃冷藏,一周內用完。
1.3.3 肌原纖維蛋白氧化處理
肌原纖維蛋白氧化處理參考Li Shugang等[12]的方法并適當修改。將提取的肌原纖維蛋白均分成6 份,置于Fenton氧化體系(1.0 mmol/L FeCl3、0.1 mmol/L抗壞血酸和10 mmol/L H2O2)中,使其最終質量濃度為10 mg/mL,密封避光于4 ℃恒溫水浴中分別氧化1、2、3、4、5 h,獲得不同氧化時間的氧化蛋白質,以未經氧化的肌原纖維蛋白為對照。將肌原纖維蛋白樣品一部分置于-80 ℃后凍干處理,用于十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和氨基酸含量的測定;另一部分置于4 ℃冷藏,用于測定其他指標。
1.3.4 羰基、總巰基、二聚酪氨酸含量及表面疏水性測定
羰基含量參照李德海等[13]的2,4-二硝基苯肼反應方法測定。
總巰基含量測定參照Wang Yu等[14]的方法,計算時摩爾消光系數為13 600 L/(mol·cm)。
二聚酪氨酸含量測定參照李玲等[15]的方法并稍作修改。肌原纖維蛋白用磷酸鹽緩沖液(含0.6 mol/L KCl,pH 6.0)稀釋至1 mg/mL,5 000×g冷凍離心3 min,利用熒光分光光度計測定上清液的熒光強度(激發波長325 nm、發射波長420 nm),并以熒光強度表征二聚絡氨酸含量。
表面疏水性測定參照Chelh等[16]的方法,肌原纖維蛋白用磷酸鹽緩沖液(含0.6 mol/L NaCl,pH 6.25)稀釋至5 mg/mL,取1 mg/mL溴酚藍溶液0.2 mL添加到1 mL 5 mg/mL蛋白溶液中,混勻后,離心15 min(4 ℃、5 000×g),取上清液稀釋10 倍,利用紫外-可見分光光度計測定595 nm波長處的吸光度,對照組為無蛋白溶液添加的磷酸鹽緩沖液。表面疏水性使用溴酚藍結合量表示,具體按下式計算。
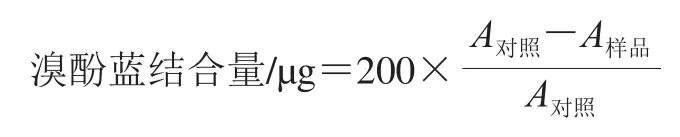
1.3.5 紫外吸收光譜測定
將樣品用磷酸鹽緩沖液(pH 7.0)稀釋至1 mg/mL后,置于UV-1780紫外分光光度計中測定紫外吸收光譜,設置掃描波長范圍為240~340 nm,掃描速率為2 nm/min。
1.3.6 內源熒光光譜測定
內源熒光光譜的測定參照Cao Yungang等[17]的方法并略作修改。用磷酸鹽緩沖液(含0.6 mol/L NaCl,pH 6.7)將肌原纖維蛋白稀釋至0.1 mg/mL后,置于F-4600熒光分光光度計中測定溶液的內源熒光光譜,設置激發波長280 nm,發射波長300~400 nm,電壓為600 V。
1.3.7 FTIR光譜測定
取適量凍干樣品與溴化鉀按質量比1∶100充分混均,用瑪瑙研缽碾磨,制成溴化鉀壓片。置于FTIR儀中,設置波數范圍為400~4 000 cm-1,分辨率為4.0 cm-1,掃描次數為32,并使用PeakFit 4.12軟件對圖譜酰胺I帶1 600~1 700 cm-1范圍內進行曲線擬合,計算各二級結構的相對含量。
1.3.8 Zeta電位測定
Zeta電位測定參照Cai Luyun等[18]的方法并略作修改。肌原纖維蛋白溶于20 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl,pH 6.7)中得到質量濃度為0.2 g/100 mL的溶液,用0.22 μm的醋酸膜(水系)進行過濾,采用Omni多角度粒度與高靈敏度Zeta電位分析儀測定樣品的Zeta電位,使用35 mW固態激光器(λ=660 nm)在25 ℃下測定,并將蒸餾水作為溶劑,每組樣品平行測定5 次。
1.3.9 粒徑測定
粒徑測定參照Feng Meiqin等[19]的方法利用粒度儀進行測定。使用蒸餾水作為分散劑,所有測定設5 次平行,折射率為1.46,吸收系數為0.01,并且顆粒為非球形。D(v, 0.1)、D(v, 0.5)、D(v, 0.9)分別為10%、50%、90%的顆粒小于該尺寸的顆粒尺寸。
1.3.10 蛋白組成測定
采用SDS-PAGE進行蛋白組成分析,分離膠質量分數為12%,濃縮膠質量分數為4%,分別取肌原纖維蛋白10 μg,放入4×上樣緩沖液,沸水浴5 min;先80 V恒壓使溴酚藍移動至濃縮膠與分離膠分界處,再換電壓至120 V,恒壓至溴酚藍移動至膠底。電泳結束后進行考馬斯亮藍G-250染色、掃描,掃描模式為256灰階透視掃描,分辨率為200 dpi。
1.3.11 氨基酸含量測定
取0.5 g樣品于水解管中,加入20 mL體積分數50% HCl溶液,置于電熱鼓風干燥箱110 ℃水解22~24 h。取出冷卻,轉移至25 mL比色管中定容。從比色管中取1 mL溶液,85 ℃水浴吹干,加蒸餾水1 mL,氮氣吹干。加入10 mL 0.02 mol/L HCl溶液,搖勻,取500 μL加入250 μL 0.1 mol/L異硫氰酸苯酯乙腈、250 μL 1 mol/L三乙胺乙腈,衍生1 h后,加入2 mL正己烷,振蕩、靜置分層。取下層液過0.45 μm有機膜后用氨基酸自動分析儀測定氨基酸含量。
1.4 數據統計與分析
所有實驗數據均為3 次重復實驗結果的平均值。通過DPS 7.55軟件對數據進行單因素方差分析,Duncan新復極差法進行差異顯著性分析,P<0.05表示差異顯著。采用Origin Pro 8.5軟件作圖。
2 結果與分析
2.1 氧化時間對羊肉肌原纖維蛋白羰基含量的影響

圖1 氧化時間對肌原纖維蛋白羰基含量的影響Fig.1 Effect of oxidation time on carbonyl group content
羰基含量是廣為使用的衡量蛋白質氧化程度的指標,蛋白質骨架側鏈帶有的部分氨基酸在氧化時易被轉化成羰基基團[20]。由圖1可知,隨著氧化時間的延長,羰基含量顯著增加(P<0.05),氧化5 h的肌原纖維蛋白羰基含量比對照組增加了10.03 倍。這與李學鵬等[21]研究的經羥自由基不同氧化時間處理的六線魚肌原纖維蛋白羰基含量的結果一致。
2.2 氧化時間對羊肉肌原纖維蛋白總巰基含量的影響
巰基在蛋白質中有兩種存在形式:一種存在于蛋白質表面;另一種是包埋在蛋白質內部,總巰基包括以上兩種形式[22]。由圖2可知,隨著氧化時間的延長,總巰基含量顯著降低(P<0.05),并在5 h時達到5.09 μmol/g,說明羊肉的肌原纖維蛋白的氧化程度隨著氧化時間的延長而呈上升趨勢。有報道認為總巰基含量的減少代表二硫鍵的生成[23]。
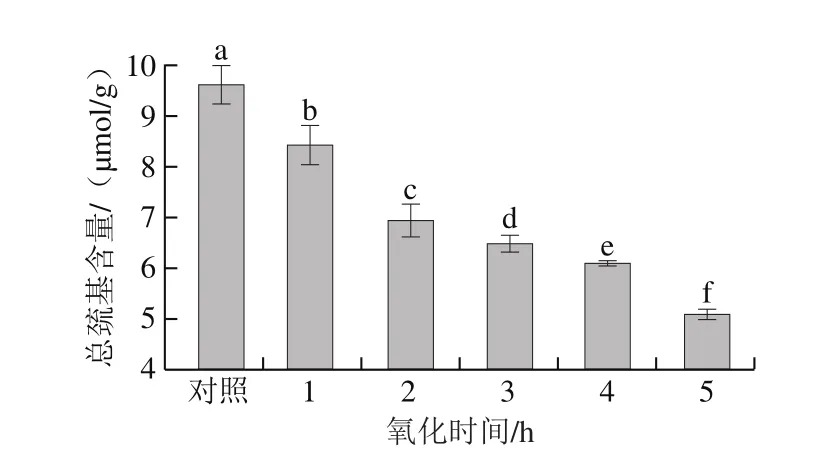
圖2 氧化時間對肌原纖維蛋白總巰基含量的影響Fig.2 Effect of oxidation time on total sulfhydryl group content
2.3 氧化時間對羊肉肌原纖維蛋白二聚酪氨酸含量的影響
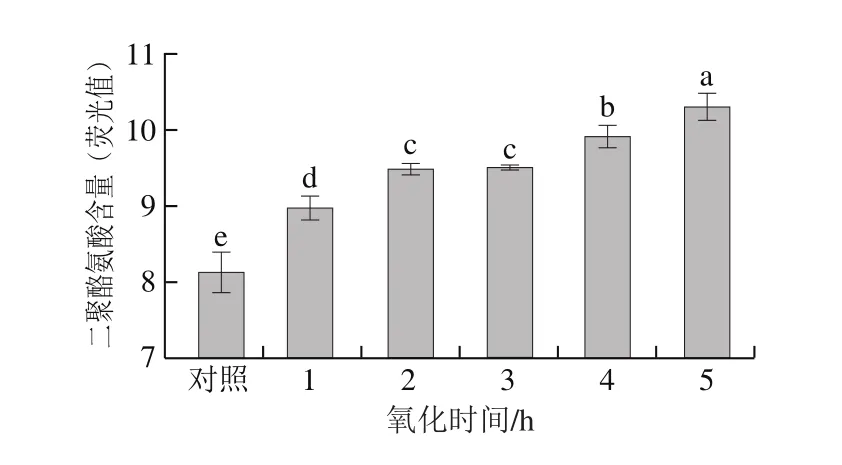
圖3 氧化時間對肌原纖維蛋白二聚酪氨酸含量的影響Fig.3 Effect of oxidation time on tyrosine dimer content
二聚酪氨酸含量也是衡量蛋白質是否發生氧化的指標,主要在于氧化的發生使酪氨酸殘基發生不同程度的聚合,從而形成二聚酪氨酸[15]。由圖3可知,隨著氧化時間的延長,二聚酪氨酸含量呈上升趨勢;與對照組相比,氧化樣品的二聚酪氨酸含量顯著增加(P<0.05),而2、3 h處理組之間聚酪氨酸含量差異不顯著(P>0.05);4 h后繼續上升。蛋白氧化后二聚酪氨酸含量的增加也可能蛋白氧化后通過部分共價鍵和非共價鍵的作用發生了聚集[24]。
2.4 氧化時間對羊肉肌原纖維蛋白表面疏水性的影響
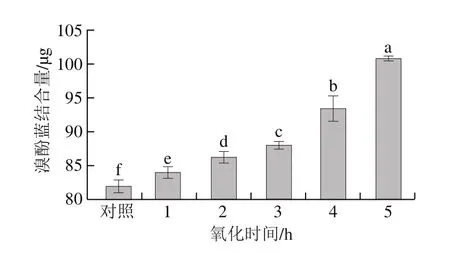
圖4 氧化時間對肌原纖維蛋白表面疏水性的影響Fig.4 Effect of oxidation time on protein surface hydrophobicity
蛋白質表面的疏水性結構對其功能性質存在較大作用,一般通過蛋白與溴酚藍的結合量判斷其在氧化過程中的變性程度[21,25]。由圖4可知,對照組溴酚藍的結合量為82.00 μg,氧化時間為1、2、3、4 h和5 h時,結合量分別為84.08、86.38、88.14、93.58 μg和101.22 μg;隨著氧化時間的延長,溴酚藍的結合量呈顯著增加趨勢(P<0.05),說明氧化使肌原纖維蛋白的表面疏水性顯著增強。這可能是由于氧化改變部分疏水性氨基酸結構,使更多疏水性基團暴露于蛋白質表面,從而促進蛋白質與溴酚藍的結合,使得表面疏水性呈增加趨勢[25-26]。
2.5 氧化對羊肉肌原纖維蛋白紫外吸收光譜的影響
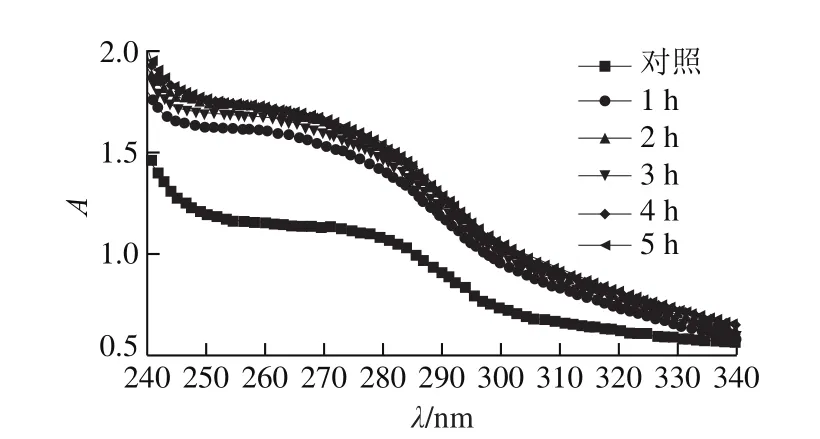
圖5 氧化時間對肌原纖維蛋白紫外吸收光譜的影響Fig.5 Effect of oxidation time on ultraviolet and visible absorption spectra of myofibrillar protein
蛋白質中含有芳香環結構的氨基酸,如酪氨酸和色氨酸,能夠引起紫外光的吸收,因此紫外吸收光譜常用于反映蛋白質在氧化過程中的結構[27]。由圖5可知,經不同時間氧化后的肌原纖維蛋白的紫外吸收光譜相似,均在280 nm波長左右出現峰的拐點,說明氧化不會改變肌原纖維蛋白整體圖譜趨勢。但隨著氧化時間的延長,峰位出現輕微藍移,可以表明在氧化體系下,不同氧化時間使肌原纖維蛋白質中的部分氨基酸基團結構發生不同程度改變,并且從而使吸收的紫外光譜產生差異,并對蛋白質的功能性質產生影響。
2.6 氧化時間對羊肉肌原纖維蛋白內源熒光光譜的影響
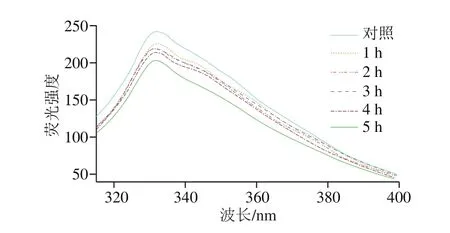
圖6 氧化時間對肌原纖維蛋白內源熒光強度的影響Fig.6 Effect of oxidation time on endogenous fluorescence intensity of myofibrillar protein
內源熒光光譜常用來反映蛋白質構象。如圖6所示,隨著氧化時間的延長,蛋白質的熒光強度呈現降低趨勢,且發生輕微藍移;氧化5 h時熒光強度最低,氧化2、3 h時的熒光強度差異較小。這可能是氧化導致蛋白質分子內部發生能量的轉移,部分結構逐漸發生改變;隨著氧化時間的延長,部分氨基酸熒光被猝滅,從而導致肌原纖維蛋白的熒光強度呈下降趨勢,這與Cao Yungang等[28]發現氧化處理后肌原纖維蛋白熒光強度下降的結論一致。
2.7 氧化時間對羊肉肌原纖維蛋白粒徑的影響

表1 氧化時間對羊肉肌原纖維蛋白粒徑的影響Table 1 Hffect of oxidation time on protein particle size of myofibrillar protein
粒徑反映可溶性蛋白的粒度分布和氧化肌原纖維蛋白的聚集情況[29]。由表1可知,D(v, 0.1)、D(v, 0.5)隨著氧化的前4 h呈上升趨勢,但5 h時下降;隨著氧化時間的延長,D(v, 0.9)呈顯著增加趨勢(P<0.05)。這可能是較高氧化程度可以促進不可溶性組分形成,導致蛋白分子聚集,使蛋白質粒徑增大,而蛋白粒徑增大會導致蛋白質持水性降低、蒸煮損失增加等功能特性劣變[30]。Bao Yulong等[31]在豬肉肌原纖維蛋氧化的研究中也發現蛋白聚集。
2.8 氧化時間對羊肉肌原纖維蛋白Zeta電位的影響
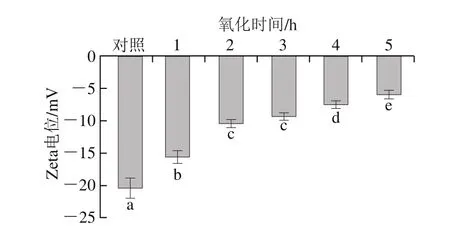
圖7 氧化時間對肌原纖維蛋白Zeta電位的影響Fig.7 Effect of oxidation time on protein Zeta potential of myofibrillar protein
Zeta電位指膠態分散體中的電動勢,絕對值高意味著肌原纖維蛋白具有更好的穩定性[32]。由圖7可知,Zeta電位絕對值隨著氧化時間的延長而呈顯著降低趨勢(P<0.05),表明靜電相互作用隨著氧化程度的增加而減弱;對照組Zeta電位絕對值為20.53,是氧化5 h樣品的3.4 倍。隨著氧化時間的延長,Zeta電位絕對值降低,蛋白溶液趨向凝聚狀態,相互之間的吸引力大于排斥力,肌原纖維蛋白之間的分散狀態被破壞而產生聚集,導致肌原纖維蛋白的穩定性降低[18]。
2.9 氧化時間對羊肉肌原纖維蛋白二級結構的影響
一般認為研究蛋白質的FTIR圖是分析蛋白氧化過程中二級結構的變化規律的有效手段,羊肉肌原纖維蛋白在紅外區有明顯的特征光譜吸收帶,在1 600~1 700 cm-1范圍的酰胺I帶主要以α-螺旋、β-折疊等空間結構相互作用為主,在不同外界因素影響下,蛋白質酰胺I帶對肽鏈結構變化的反映十分準確、靈敏[33-34]。
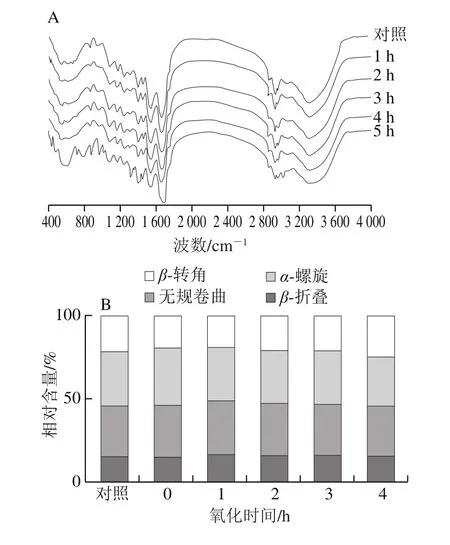
圖8 氧化對肌原纖維蛋白FTIR圖譜(A)和二級結構(B)的影響Fig.8 Effect of oxidation time on protein FTIR (A) and secondary structure (B) of myofibrillar protein
由圖8A可知,隨著氧化時間的延長,羊肉肌原纖維蛋白FTIR圖譜趨勢相似。由圖8B可知,隨著氧化時間的延長,與對照組相比,蛋白α-螺旋相對含量呈先增加后降低的趨勢,無規卷曲相對含量變化不大,β-折疊相對含量呈降低趨勢,β-轉角相對含量則先降低后增加。結果表明氧化過程中蛋白質的二級結構會發生不同程度的轉變,氧化使得羊肉肌原纖維蛋白的螺旋、折疊結構之間相互轉化,且是有序向無序的轉變。Sun Weizheng等[30]采用FTIR研究氧化后豬肉肌原纖維蛋白的二級結構變化,發現隨著氧化的發生,肌原纖維蛋白結構發生改變,與本實驗結果一致。
2.10 肌原纖維蛋白SDS-PAGE分析
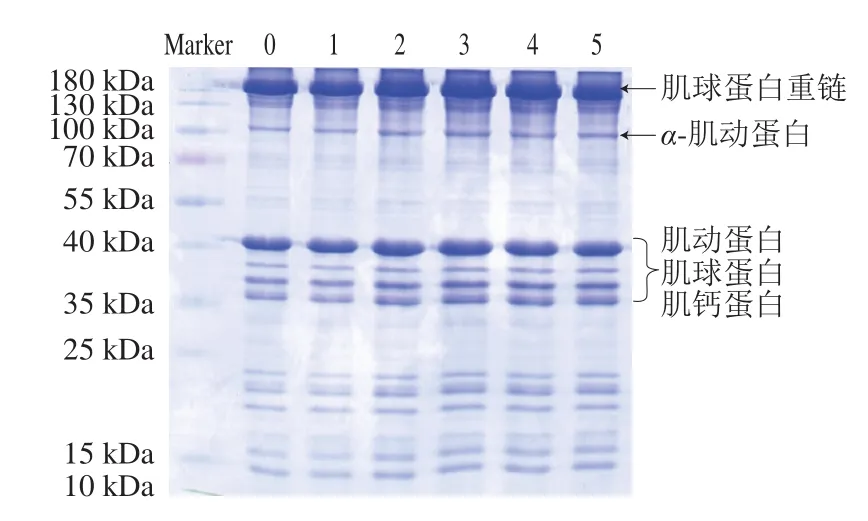
圖9 不同氧化時間的肌原纖維蛋白SDS-PAGE圖Fig.9 SDS-PAGE of myofibrillar protein at different oxidation times
由圖9可知,肌原纖維蛋白氧化后結構上的聚集變化,通過氧化后的羊肉肌原纖維蛋白SDS-PAGE分析可知,肌原纖維蛋白的SDS-PAGE圖中依次出現分子質量由大到小的肌球蛋白重鏈、α-肌動蛋白和肌動蛋白、肌球蛋白、肌鈣蛋白。蛋白質分子發生降解主要表現為分子質量較高處的條帶出現模糊、弱化和擴展,較低分子質量區域則呈現出新的條帶或條帶顏色加深[35-36]。
隨著氧化時間的延長,肌球蛋白重聯處條帶有輕微擴散,這表明氧化可能形成蛋白聚集體,由此可假設,氧化使羊肉中肌原纖維蛋白結構改變,可能是蛋白分子的共價交聯,如通過二硫鍵、二酪氨酸等形成交聯,或分子間通過碳-碳共價交聯等,導致氧化后肌原纖維蛋白產生了分子質量較大的聚集體。另外,在100 kDa處條帶逐漸加深,35~40 kDa處條帶呈現擴展現象,說明氧化對肌原纖維蛋白的不同部分有相同作用。Xia Minquan等[37]對不同氧化程度的豬肉纖維蛋白的SDS-PAGE分析表明,豬肌原纖維蛋白經不同處理后,低水平的氧化出現肌原纖維蛋白聚集體[37],這與本實驗結果相類似。
2.11 氧化時間對羊肉肌原纖維蛋白氨基酸含量的影響
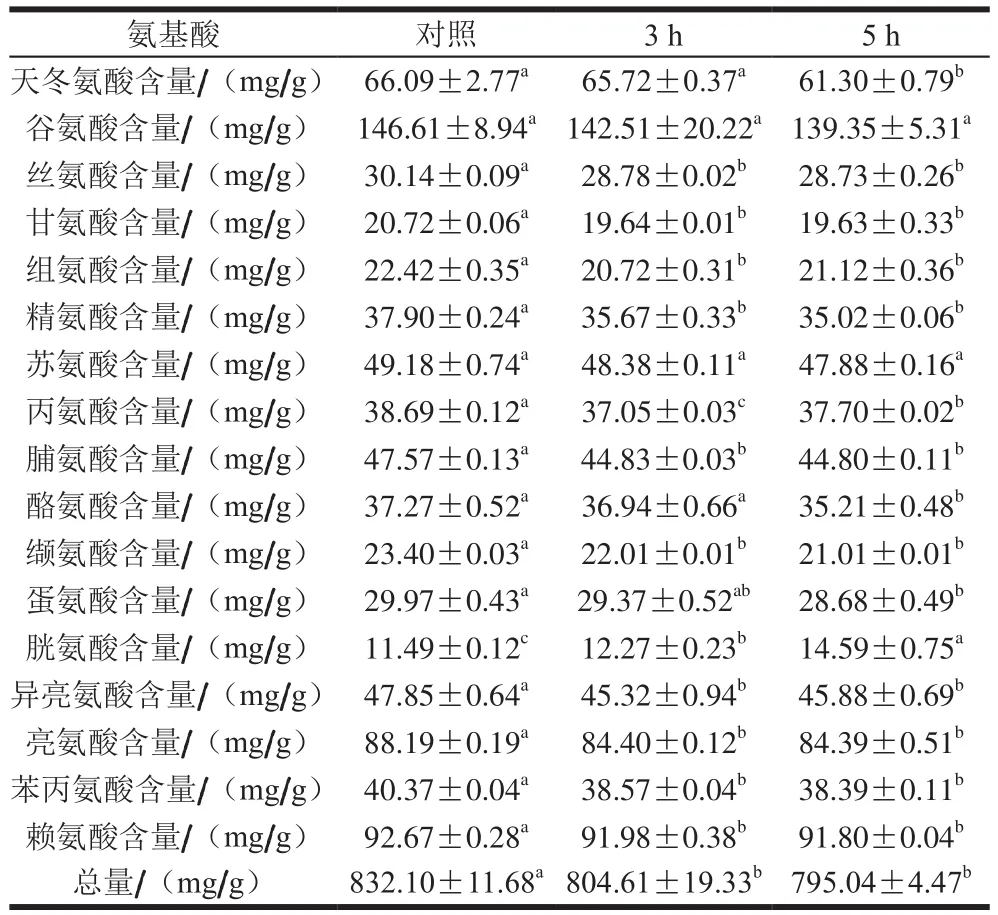
表2 氧化時間對肌原纖維蛋白氨基酸含量的影響Table 2 Effect of oxidation time on amino acids contents of myofibrillar protein
蛋白氧化造成側鏈氨基酸發生不同程度氧化,從而使氨基酸的種類、比例改變。如表2所示,隨著氧化時間的延長,胱氨酸含量顯著增加(P<0.05),其他氨基酸含量呈下降趨勢,氨基酸總量也逐漸下降,不同氨基酸對氧化時間的響應也不盡相同,這與李銀等[38]的研究結果吻合。氨基酸總量減少是由于隨著氧化時間的延長,蛋白質側鏈的脂肪族氨基酸被氧化形成氫過氧化物、羰基衍生物,芳香族氨基酸殘基的芳香環易被氧化,如酪氨酸易被氧化成二酪氨酸;含硫氨基酸如半胱氨酸和蛋氨酸被氧化為二硫化合物、蛋氨酸亞砜化合物。
與對照組相比,氧化5 h時天冬氨酸(Asp)、酪氨酸(Tyr)和蛋氨酸(Met)含量顯著降低(P<0.05),谷氨酸(Glu)、蘇氨酸(Thr)含量無顯著差異(P>0.05),除胱氨酸外的其他氨基酸含量在氧化3 h后顯著降低(P<0.05)。胱氨酸含量的增加可能是由于兩分子半胱氨酸經氧化后生成胱氨酸。酪氨酸易被氧化成二聚酪氨酸而使酪氨酸含量下降、二聚酪氨酸含量上升,這與二聚酪氨酸含量結果相一致。
3 結 論
隨著氧化時間的延長,羊肉肌原纖維蛋白的羰基含量顯著增加、總巰基含量顯著降低,表明蛋白質氧化程度逐漸增加。隨著氧化時間的延長,羊肉肌原纖維蛋白的二聚酪氨酸含量、表面疏水性呈顯著上升趨勢,內源熒光強度降低并出現輕微藍移。在氧化過程中,肌原纖維蛋白的粒徑分布向粒徑大的方向偏移,Zeta電位的絕對值呈現降低趨勢。紅外光譜顯示蛋白質二級結構發生改變,α-螺旋相對含量先增加后降低,β-轉角相對含量先降低后增加,β-折疊相對含量呈現降低趨勢,無規卷曲相對含量無明顯變化。SDS-PAGE結果表明,氧化引起蛋白質分子間的交聯現象。總氨基酸含量呈下降趨勢,胱氨酸含量隨著氧化時間的延長而顯著上升,其余氨基酸含量呈降低趨勢,但不同氨基酸對氧化時間的響應不同。因此,氧化能誘導羊肉肌原纖維蛋白的分子與理化特性發生改變,進而對羊肉及其制品品質產生不良影響,研究結果可為調控羊肉品質提供理論基礎。

