炎性因子與心房顫動患者射頻消融術后早期復發的相關性
孟慶紅,杜雪蓮,宋坤青,強媛媛,劉德敏
心房顫動簡稱房顫,是臨床常見的心律失常類型之一,主要表現為心房不規則收縮、心悸等,不僅會增加心臟前后負荷及心肌缺血,加重心功能惡化,此外還增加了腦卒中風險,致殘率與病死率均較高[1-2]。一直以來,諸多學者致力于探尋房顫的治療方法,射頻消融術逐漸應用于臨床,盡管射頻消融術治療房顫已經取得一定進展,但患者術后再次發生心房撲動、房顫等心律失常現象仍較多。鑒于此,探尋影響房顫行射頻消融術治療后復發的影響因素,并積極防治危險因素,對提高臨床治療效果、促進預后具有重要意義[3-4]。近年來,臨床基礎研究顯示,炎性因子不僅參與了房顫的發生與發展,而且還參與了房顫的結構重構與電學重構過程,導致心房肌細胞發生變性壞死、纖維化,心肌細胞的電生理發生改變,造成心房肌穩定性下降,心室傳導速度下降,進而誘發房顫[5-6]。目前對于房顫患者射頻消融術后早期復發的預測因素研究尚無定論,本研究通過觀察房顫射頻消融手術前后血清炎性因子的水平,旨在為降低房顫患者術后早期復發率提供科學依據。具體研究內容如下。
1 資料與方法
1.1一般資料 回顧性分析2018年1月—2019年8月在滄州市中心醫院心血管內科治療的120例房顫患者的臨床資料,其中男75例,女45例;年齡35~65(51.52±7.35)歲。
1.2納入與排除標準 ①納入標準:滿足《2010版歐洲心房顫動診療指南解讀》[7]中相關的診斷標準;經24 h動態心電圖檢查提示有房顫心律;患者均行射頻消融術治療;年齡18~75歲;左心房內無血栓,左心房內徑<45 mm;臨床資料完整。②排除標準:①入組前3個月內發生過不穩定性心絞痛或急性心肌梗死者;隨訪前1個月內服用非甾體類藥物者;伴心臟病手術史,如心臟搭橋等;近期合并嚴重感染性疾病者;心功能分級Ⅲ~Ⅳ級者;肝腎功能嚴重不全者。
1.3方法
1.3.1搜集一般資料:采用一般資料調查表記錄受試者的一般臨床信息,包括姓名、性別、年齡、房顫類型、是否伴有高血壓、糖尿病、高脂血癥、代謝綜合征等合并癥,用超聲心動圖測量房顫患者左心房直徑(left atrial diameter, LAD)、左心室射血分數(left ventricular ejection fraction, LVEF)等。
1.3.2手術方法:房顫患者射頻消融術前48 h內行食道超聲檢查,明確房顫患者左心房內有無血栓形成,有血栓者不能行射頻消融術。持續性房顫在射頻消融術后房顫未能終止者,應用體外直流電復律治療。
1.3.3炎性因子檢測:復查前1 d告知受試者注意事項,于次日清晨空腹狀態下,抽取肘靜脈血3 ml,2500 r/min轉速下離心10 min,有效提取上清液,保存在-20℃環境中待檢,實驗室相關炎癥指標包括免疫比濁法測定超敏C反應蛋白(hypersensitive C-reactive protein, hs-CRP)、放射免疫平衡法測定白介素-6(interleukin-6, IL-6)、非飽和法測定腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)。
1.3.4隨訪:射頻消融術后3個月行體表心電圖或24 h心電圖監測,以明確房顫有無復發、屬于早期復發或晚期復發。射頻消融術后1年隨訪期間,患者若有心慌、心悸等不適,建議行體表心電圖或動態心電圖監測明確有無房顫復發。
1.3.5早期復發判定標準:術后3個月內,用動態心電圖或12導聯心電圖捕捉到房顫、心房撲動等表現,且持續時間≥30 s,臨床可有癥狀或無癥狀。
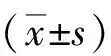
2 結果
2.1復發情況 經資料整理發現,120例房顫行射頻消融術患者中,早期復發者20例,占比16.67%,將其納入早期復發組;其余未發生復發的100例患者納入未復發組,占比83.33%。
2.2一般資料比較 2組性別、年齡、房顫類型、病程、合并癥、LAD、LVEF等一般資料比較差異均無統計學意義(P>0.05)。見表1。

表1 2組房顫患者的一般資料比較
2.3hs-CRP、IL-6、TNF-α水平比較 早期復發組的hs-CRP、IL-6、TNF-α水平均較未復發組明顯升高,差異有統計學意義(P<0.01)。見表2。
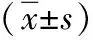
表2 2組房顫患者的hs-CRP、IL-6、TNF-α比較
2.4hs-CRP、IL-6、TNF-α水平預測房顫患者射頻消融術后早期復發的價值 將房顫患者射頻消融術后早期復發作為狀態變量,繪制ROC曲線,結果顯示,hs-CRP預測房顫患者射頻消融術后早期復發情況的界值為7.15 mg/L,曲線下面積為0.820(95%CI:0.702,0.938)。IL-6預測房顫患者射頻消融術后早期復發情況的界值為9.48 pg/ml,曲線下面積為0.899(95%CI:0.802,0.996)。TNF-α預測房顫患者射頻消融術后早期復發情況的界值為18.05 pg/ml,曲線下面積為0.848(95%CI:0.750,0.946)。見圖1。

圖1 hs-CRP、IL-6、TNF-α水平預測房顫患者射頻消融術后早期復發的ROC曲線
3 討論
房顫的形成機制較為復雜,主要包括房顫觸發因素與維持機制,炎癥反應參與了房顫觸發及心房重構、電重構過程,炎癥可通過多種途徑導致細胞變性壞死,造成心肌細胞發生病理性改變,誘發房顫[8-10]。因此,積極探尋炎性因子與房顫之間的相關性,對降低房顫射頻消融術后早期復發率具有重要意義[11]。
hs-CRP屬于炎性因子典型標志物之一,屬于炎癥急性期產物,正常情況下,在機體內呈低表達情況,當其水平升高時,表明機體處于炎性應激、組織損傷、感染、壞死等時期,且其水平越高,機體炎癥越嚴重,組織損傷程度越重,因此hs-CRP可作為反映炎癥指標的敏感性指標之一[12]。IL-6可誘導急性期纖維蛋白原、CRP等產生,參與細胞生長、活化,提高免疫細胞功能,IL-6持續的高表達,導致細胞因子網絡破壞,誘發心肌損傷,心肌結構發生改變,而發生病理性改變的心肌細胞又對機體形成負性反饋,加重心肌病理改變;此外,特定情況下,IL-6會導致細胞膜完整性及功能受損,導致心房電重構,加重病情[13-14]。TNF-α屬于促炎因子,主要參與機體炎癥及免疫反應,微觀狀態下,心房傳導損傷是房顫的始動因素與維持因素,病理機制為細胞間沉積的膠原纖維連接蛋白與結締組織導致心肌細胞彼此分離,造成心房組織間發生病理性改變,最終形成纖維化[15-16]。心房肌細胞局部傳導阻滯與離散度增加也與房顫的發生密切相關,而此過程主要是通過TNF-α與炎癥應激反應密切相關,通過下調其水平影響心房傳導[17-18]。本研究結果顯示,早期復發組hs-CRP、IL-6、TNF-α水平均呈高表達,證實hs-CRP、IL-6、TNF-α水平對預測房顫患者行射頻消融術后早期復發具有一定的價值。本研究雖在探析炎性因子與房顫射頻消融術后早期復發之間的關系上取得一定成果,但仍有諸多不足,如炎性因子指標較多,本研究只選取了3個炎癥指標,且并未探析各指標之間的相關性。此外,回顧性研究在收集患者資料時,可控性較低,且本次研究納入的樣本數量較少。鑒于此,希望在未來能夠開展多中心、大樣本的前瞻性研究來佐證本次研究結果。
綜上所述,hs-CRP、IL-6、TNF-α水平對預測房顫患者行射頻消融術后早期復發具有一定的價值。

