固有淋巴細胞在早期腸源性膿毒癥免疫抑制中的作用機制研究
楊登元,沈曉菲,陸曉峰,趙 陽,夏雪峰,管文賢,杜峻峰
腸源性膿毒癥是普外科常見的重癥疾病,發病率高,預后較差,其在早期存在的免疫抑制是導致預后不佳的主要因素[1-2]。中性粒細胞在腸源性膿毒癥中的生存時間顯著延長,然而自身功能卻出現明顯改變,在膿毒癥模型中,中性粒細胞能夠上調程序性死亡配體1(programmed death ligand 1, PD-L1)的表達,抑制淋巴細胞的功能[3];而在臨床研究中,重癥膿毒癥患者的外周血中性粒細胞PD-L1表達水平與疾病嚴重程度呈正相關[4]。因此,中性粒細胞表達PD-L1是誘導其他免疫細胞功能抑制,推動膿毒癥免疫抑制狀態的重要環節。然而,中性粒細胞在膿毒癥患者中上調PD-L1表達的具體機制尚不清楚。固有淋巴細胞(innate lymphoid cells, ILCs)是最近發現的一類免疫細胞群體,在受到外源致病菌或炎癥刺激后,可通過表面的相應受體啟動快速免疫應答,因此對于早期免疫應答起到了至關重要的調控作用[5]。雖然ILCs是組織定居細胞,但是研究人員發現,在人類外周血中穩定存在各亞型ILCs,提示其也能參與系統性免疫應答[6]。腸源性膿毒癥患者在早期就存在復雜的細胞因子網絡,不同亞型的ILCs可以被不同細胞因子激活,與此同時,激活的ILCs也能通過分泌細胞因子與蛋白促進疾病的發展。因此,ILCs可能是膿毒癥早期疾病進程中的關鍵細胞群體。本研究利用健康志愿者及腸源性膿毒癥患者外周血,提取免疫細胞后分析ILCs的變化及其對于中性粒細胞和腸源性膿毒癥免疫抑制的潛在調控作用。
1 資料與方法
1.1一般資料 選取2019年1月—9月南京大學醫學院附屬鼓樓醫院胃腸外科收治的7例因結腸穿孔所致腸源性膿毒癥患者,膿毒癥的診斷依據最新Sepsis-3的診斷標準:序貫器官衰竭評估評分≥2分;所有患者在入院24 h內即進行評分,年齡46~68歲,男3例,女4例。選取7例同期的健康志愿者,其中男4例,女3例,年齡38~72歲,既往無嚴重心、肝、腎、內分泌及免疫系統疾病,無放化療及免疫調節藥物或激素服用史。健康志愿者與腸源性膿毒癥患者一般資料比較差異無統計學意義(P>0.05),具有可比性。無論是患者還是志愿者都簽署知情同意書。
1.2外周血處理 獲取健康志愿者及腸源性膿毒癥患者外周血10 ml,加入Ficoll分離液,按照外周血∶PBS∶Ficoll分離液4∶4 ∶6的比例進行離心,室溫,30 min,上升速度最大,下降速度最低;離心后獲取薄霧狀中間層細胞,進行洗滌。
1.3流式細胞術及體外刺激共培養 人類外周血ILC2(2型固有淋巴細胞):CD45+Lineage-IL-7Rα+CRTH2+;分選后的細胞利用20%細胞培養基在體外使用人白介素-12(interleukin-12, IL-12)及IL-33刺激,濃度均為50 ng/ml,刺激3 d后分別獲取細胞和上清液以備檢測,細胞利用BD公司FACS CantoⅡ檢測,上清液應用R&D公司生產的γ干擾素(interferon-γ, IFN-γ)試劑盒進行檢測;在部分實驗中,加入流式細胞術分選的中性粒細胞,再培養12 h后檢測中性粒細胞表面PD-L1的表達。
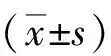
2 結果
2.1腸源性膿毒癥患者外周血ILCs亞群的變化 無論是健康志愿者還是腸源性膿毒癥患者,外周血內均存在3型ILCs:ILC1、ILC2和ILC3。見圖1A。與健康志愿者比較,腸源性膿毒癥患者外周血ILC1比例顯著上升,而ILC2的比例則顯著下調(P<0.05),ILC3的比例則變化不顯著(P>0.05)。見圖1B和表1。提示在腸源性膿毒癥早期,ILCs的亞群就存在顯著變化,可能對疾病的發生發展起到推動作用。


表1 健康志愿者及腸源性膿毒癥患者外周血ILCs亞群比較
2.2腸源性膿毒癥患者外周血中性粒細胞PD-L1表達情況 分析健康志愿者與腸源性膿毒癥患者外周血中性粒細胞發現,健康志愿者外周血中性粒細胞幾乎不表達PD-L1,然而在腸源性膿毒癥患者體內,中性粒細胞PD-L1表達顯著上調。見圖2A。在過去研究中,巨噬細胞和樹突狀細胞是表達PD-L1的主要固有免疫細胞群體,然而在腸源性膿毒癥早期,中性粒細胞是表達PD-L1最顯著的細胞群體(P<0.05)。見圖2B。提示PD-L1對后續免疫抑制的發生起到重要推動作用。

圖2 健康志愿者及腸源性膿毒癥患者外周血中性粒細胞PD-L1表達情況
2.3腸源性膿毒癥患者中性粒細胞PD-L1表達水平與ILC1比例的相關性 為了探索ILC2與ILC1比例的變化,尤其是ILC1比例的顯著上調是否對腸源性膿毒癥免疫抑制產生影響,本研究對中性粒細胞PD-L1表達水平與ILC1比例進行相關性分析,發現中性粒細胞PD-L1表達水平與ILC1比例呈正相關(R2=0.5959)。見圖3。提示ILCs可能參與中性粒細胞在腸源性膿毒癥早期上調PD-L1的表達。
2.4體外IL-33和(或)IL-12刺激ILC2可以轉變為ILC1 為了探索ILC1比例增加的原因,及其是否能直接作用于中性粒細胞,促進PD-L1的表達并導致膿毒癥免疫抑制,本研究首先運用體外實驗,探索ILC2是否能被誘導轉變為ILC1,將獲取的外周血ILC2在體外分別運用IL-33、IL-12及IL-12+IL-33刺激,發現在體外IL-12或IL-12+IL-33刺激下,ILC2確實能夠轉變為ILC1,ILC1特征性轉錄因子T-bet高表達(P<0.05),上清液亦可檢測到高水平的IFN-γ(P<0.05)。當將中性粒細胞與由ILC2轉變而來的ILC1共培養后,中性粒細胞PD-L1的表達顯著上調(P<0.05)。見圖4。提示腸源性膿毒癥早期,ILC2能轉變為ILC1,促進中性粒細胞表達PD-L1,推動腸源性膿毒癥免疫抑制的產生。
3 討論
深入闡明腸源性膿毒癥的病理生理過程是治療疾病,改善預后的前提。目前學者們一致認為,腸源性膿毒癥是病原菌與機體免疫系統相互較量的過程;機體在抗菌的同時啟動促炎反應,作為一種代償機制,機體內同時或相繼出現抗炎反應:效應性T細胞出現凋亡、中性粒細胞功能失調、內毒素重新整合、MHC-2類分子在抗原提呈細胞表面表達下調、調節性T細胞以及髓系抑制性細胞比例上調等。因此部分學者認為增強機體免疫功能、逆轉腸源性膿毒癥早期即存在的免疫抑制才是新的治療方向[2]。ILCs作為最近新發現的免疫細胞群體,數量雖少,但是因其在炎癥與感染早期能夠被快速激活,成為現今免疫細胞群體的關注焦點;然而其在腸源性膿毒癥中扮演的角色尚未闡明。本研究初步證實,在腸源性膿毒癥早期,ILCs各亞群就存在變化,ILC1的比例顯著上調,而ILC2的比例則顯著下調,進一步的體外實驗表明,ILC1比例的上調可能與ILC2/ILC1轉化有關;本研究還發現,腸源性膿毒癥患者外周血中性粒細胞在早期就顯著上調PD-L1的表達,并且其表達水平與ILC1的比例呈現顯著的正相關;進一步的體外共培養實驗證實,ILC2轉變為ILC1后,確實能顯著上調腸源性膿毒癥患者外周血中性粒細胞PD-L1表達。因此上述結果提示,ILCs在腸源性膿毒癥早期就存在ILC2/ILC1轉化,促進中性粒細胞表達PD-L1,從而推動免疫抑制的產生。

圖3 腸源性膿毒癥患者中性粒細胞PD-L1表達水平與ILC1比例的相關性

圖4 體外IL-33和(或)IL-12刺激ILC2后T-bet、IFN-γ以及中性粒細胞PD-L1表達情況
中性粒細胞作為體內數量最多的免疫細胞群體,在膿毒癥中的作用一直是研究的熱點。由于中性粒細胞的生存期限與其他免疫細胞尤其是記憶性細胞相比,相對短暫,因此過去認為中性粒細胞主要是終末效應性細胞,對于其他細胞的調控作用甚微。然而最近的研究表明,在炎癥狀態下,中性粒細胞在外周循環及感染灶都能與獲得性免疫細胞(例如T淋巴細胞)相互聯系,并且對T淋巴細胞的功能進行調控。中性粒細胞能通過分泌活性氧和精氨酸-1對淋巴細胞的功能起到負調控作用[7]。PD-L1作為下調淋巴細胞免疫功能的重要抑制性分子,是表達于T淋巴細胞表面PD-1的配體,一旦與PD-1結合能啟動T淋巴細胞凋亡與功能抑制。隨著研究的深入,研究人員發現哮喘患者痰液中性粒細胞及HIV感染患者外周血中性粒細胞能高表達PD-L1,并對淋巴細胞功能起到抑制作用[8-9];而在膿毒癥中,無論是動物模型還是人類試驗結果均證實,中性粒細胞在早期就能通過表達PD-L1誘導T細胞的凋亡,促進免疫抑制的產生,然而調控腸源性膿毒癥早期中性粒細胞上調PD-L1的細胞學機制尚未揭示。本研究結果則初步證實,ILCs是腸源性膿毒癥早期誘導中性粒細胞上調PD-L1表達的主要細胞群體。
ILCs對于中性粒細胞的調控主要集中在ILC3,其通過分泌粒細胞集落刺激因子和IL-17A,對中性粒細胞在體內的穩態發揮調節作用[10];而在重癥哮喘這一炎癥疾病狀態下,ILC2可以轉變為分泌IL-17A的炎性ILC3,促進中性粒細胞在重癥哮喘狀態下肺部的浸潤,促進哮喘的急性發作[11]。ILCs是否能通過其他調控機制介導與中性粒細胞間的相互作用尚不明確,基于ILCs和中性粒細胞均是機體抵御外界病原菌侵入的首道防線,探索二者在炎癥狀態下,例如膿毒癥模型中的相互作用,或許是新的思路。另外,不同亞型ILCs在依靠分泌多種細胞因子和蛋白發揮作用的同時,也能相互轉化[12]。這種轉化被認為是機體免疫系統為了適應外界刺激而產生積極有效的免疫應答,例如在腸道損傷與感染中,腸道ILC3也可以轉變為ILC1,促進免疫應答的發展[5];然而這種ILCs間的轉化如無法得到逆轉,也會出現有害的一面,例如在慢性阻塞性肺疾病中,ILC2可以轉變為分泌IFN-γ的ILC1,加重呼吸道損傷[13]。在克羅恩病患者的腸道組織中,發現存在分泌IL-13及IFN-γ的ILCs,并且其數量及比例與疾病的嚴重程度呈正相關[14]。本研究則發現,在腸源性膿毒癥早期,ILC2可以轉變為分泌IFN-γ的ILC1,推動腸源性膿毒癥免疫抑制的產生。這一結果,為ILCs在疾病狀態下的相互轉化理論做出了有效擴充,下一步深入探索調控ILCs間相互轉化的內在分子機制,將為早期阻斷腸源性膿毒癥免疫抑制的產生,改善患者的預后提供新的方向。

