16種殺菌劑對桃褐腐病菌菌絲生長和孢子萌發的抑制作用比較
宋化穩,徐娜娜,高德良,胡尊紀,莊治國,劉 鈺,吳希寶,莊占興
(山東省農藥科學研究院,山東省化學農藥重點實驗室,濟南 250033)
桃褐腐病又名菌核病、果腐病、實腐病,是由鏈核盤菌(Monilinia spp.)引起的一種重要病害,世界產桃區均可發生[1]。花期危害造成花腐、僵果和枝條潰瘍,果實成熟期危害導致采摘前后和儲存期爛果[2],嚴重威脅桃產業的健康發展。造成桃褐腐病的病原菌有3種,分別為M. fructicola、M. fructigena和M.laxa。無性態為叢梗孢屬真菌Monilia spp.,我國大部分地區以M. fructicola為主要病原菌[1]。鏈核盤菌(Monilinia spp.)不僅危害桃,還危害蘋果、梨、李、梅、櫻桃、山楂等仁果和核果果樹,同時對薔薇科作物也可造成危害[3]。
化學防治仍然是防治桃褐腐病的主要方法。作為世界第一產桃大國[4],目前我國登記在桃褐腐病上的農藥僅有腈苯唑和小檗堿鹽酸鹽2個品種。因此,篩選對桃褐腐病菌高效低毒的殺菌劑品種,在生產中進行混配和輪換用藥,對桃褐腐病的科學防控具有重要意義。
前人已多次測定過殺菌劑對桃褐腐病菌的室內毒力[5-18],但所涉及的殺菌劑品種都不夠系統全面,測定方法除房雅麗等[6]采用菌絲生長速率法和孢子萌發法外,其余均采用菌絲生長速率法,未見用孢子萌發法進行系統測定的報道,更沒有對2種方法測定數據進行比較的研究,缺乏對各類殺菌劑作用特點的全面系統評價。本研究分別采用菌絲生長速率法和孢子萌發法測定了8類16種殺菌劑對山東省肥城地區桃褐腐病菌的室內毒力,以期為桃褐腐病的化學防治進一步提供理論依據。
1 材料與方法
1.1 材料
供試菌株:桃褐腐病菌,于2019年8月1日采自山東省肥城地區桃園鎮北臺村桃園。該地種植肥城桃歷史悠久,桃褐腐病歷年發生嚴重,桃園使用苯并咪唑類和保護性殺菌劑頻率較高。將桃褐腐病病果帶回實驗室進行單孢分離,用PDA培養基純化培養,形態學鑒定為美澳型核果鏈核盤菌(Monilinia fructicola)。
供試藥劑概況見表1。
表1 供試藥劑概況
1.2 方法
1.2.1 含藥PDA培養基制備
根據預備試驗結果,用無菌水將16種試驗藥劑分別稀釋成5~8個梯度濃度,分別取3 mL稀釋液加入裝有約25 mL,50℃左右的滅菌PDA培養基的三角瓶中,定容至30 mL,搖勻后倒入直徑9 cm的培養皿內,凝固后即制成含藥平板培養基。空白對照為無菌水。
1.2.2 含藥WA培養基制備
根據預備試驗結果,將16種試驗藥劑分別稀釋成5~8個梯度濃度,分別取3 mL稀釋液加入裝有約25 mL滅菌WA培養基的三角瓶中,定容至30 mL,搖勻后倒入直徑9 cm的培養皿內,凝固后即制成含藥平板培養基。空白對照為無菌水。
1.2.3 菌絲生長速率法
在無菌條件下,用直徑5 mm打孔器在分離培養5 d的桃褐腐病菌的菌落邊緣挑取菌餅,將菌餅置于含藥平板培養基中央,每處理重復4次,以不加藥劑的PDA平板作為空白對照。置于25℃,12 h光暗交替條件下培養5 d,用十字交叉法測量菌落直徑,計算各處理菌落增長直徑及菌絲生長抑菌率。菌絲生長抑制率按式(1)計算。

1.2.4 孢子萌發法
將桃褐腐病菌在PDA平板上,于25℃,12 h光暗交替條件下培養7 d,用無菌去離子水洗分生孢子,用滅菌紗布過濾,充分震蕩搖勻制得孢子懸浮液。然后用血球計數板計數觀察,將孢子懸浮液濃度調至105~106孢子/mL。
量取100 μL孢子懸浮液均勻涂布于含藥WA培養基平板上,于25℃,10 h光暗交替條件下培養20 h。然后鏡檢觀察孢子萌發情況,調換顯微鏡視野,每重復檢查孢子總數不少于200個,記錄檢查孢子總數及孢子萌發數,以芽管長度達到孢子短直徑的1/2視為萌發。每處理重復4次,以不含藥劑處理為空白對照。孢子萌發率和萌發抑制率分別按式(2)、(3)計算。

1.2.5 數據處理
數據采用DPS軟件進行統計分析。以設定的質量濃度的對數為橫坐標(x),抑制率的機率值為縱坐標(y),求出各藥劑對供試菌株的毒力回歸方程y=a+bx及有效抑制中濃度(EC50值)。
為了更直觀地比較各個藥劑的EC50值,將每種方法測定的16種藥劑中最大EC50值的藥劑的相對毒力倍數設定為1.00,計算出各個藥劑的相對毒力倍數。相對毒力倍數按式(4)計算。

2 結果與分析
2.1 16種殺菌劑對菌絲生長的抑制作用
16種殺菌劑對桃褐腐病菌菌絲生長的抑制作用測定結果見表2。

表2 16 種殺菌劑對桃褐腐病菌菌絲生長的抑制作用測定結果
由表2可見,16種殺菌劑抑制菌絲生長的EC50值介于0.018 4~61.530 5 mg/L,其中咪鮮胺、四霉素、腈苯唑和咯菌腈4種殺菌劑對菌絲生長的抑制活性較強,其EC50值分別為0.018 4、0.045 6、0.053 1和0.081 4 mg/L,均顯著小于0.1 mg/L,而代森錳鋅、百菌清、嘧菌酯和吡唑醚菌酯4種殺菌劑對菌絲生長的抑制活性較低,其EC50值分別為61.530 5、29.732 1、25.532 6和17.501 0 mg/L,均顯著大于10 mg/L。
2.2 16種殺菌劑對孢子萌發的抑制作用
16種殺菌劑對桃褐腐病菌孢子萌發的抑制作用測定結果見表3。由表3可見,16種殺菌劑抑制孢子萌發的EC50值介于0.008 4~189.393 8 mg/L,其中四霉素和百菌清2種殺菌劑對孢子萌發的抑制活性較強,其EC50值分別為0.008 4和0.037 8 mg/L,均顯著小于0.1 mg/L,而戊唑醇、苯醚甲環唑、腈苯唑、咪鮮胺、多菌靈、異菌脲和腐霉利等7種殺菌劑對孢子萌發的抑制活性較低,其EC50值分別為189.393 8、143.422 1、96.639 3、90.332 0、77.296 7、44.750 8 和31.774 3 mg/L,均顯著大于10 mg/L。
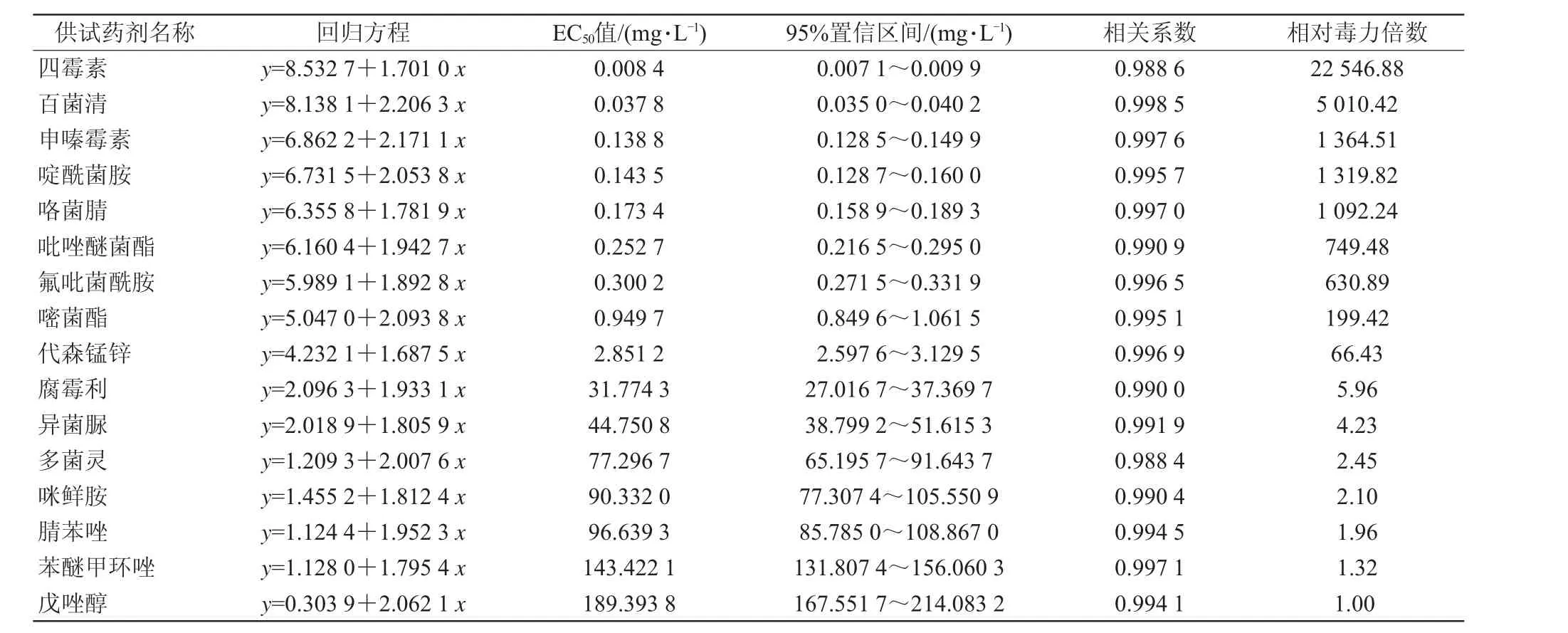
表3 16 種殺菌劑對桃褐腐病菌孢子萌發的抑制作用測定結果
2.3 8類殺菌劑的抑制作用特點比較
8類殺菌劑對桃褐腐病菌菌絲生長和孢子萌發的抑制作用比較見表4。結果表明,苯并咪唑類、麥角甾醇抑制劑和二甲酰亞胺類對菌絲生長的抑制活性較強,但對孢子萌發的抑制活性較弱;保護性殺菌劑、甲氧基丙烯酸酯類和琥珀酸脫氫酶抑制劑對孢子萌發的抑制活性較強,但對菌絲生長的抑制活性較弱;農用抗生素類(四霉素和申嗪霉素)以及吡咯類(咯菌腈)對菌絲生長和孢子萌發均具有較好的抑制活性。
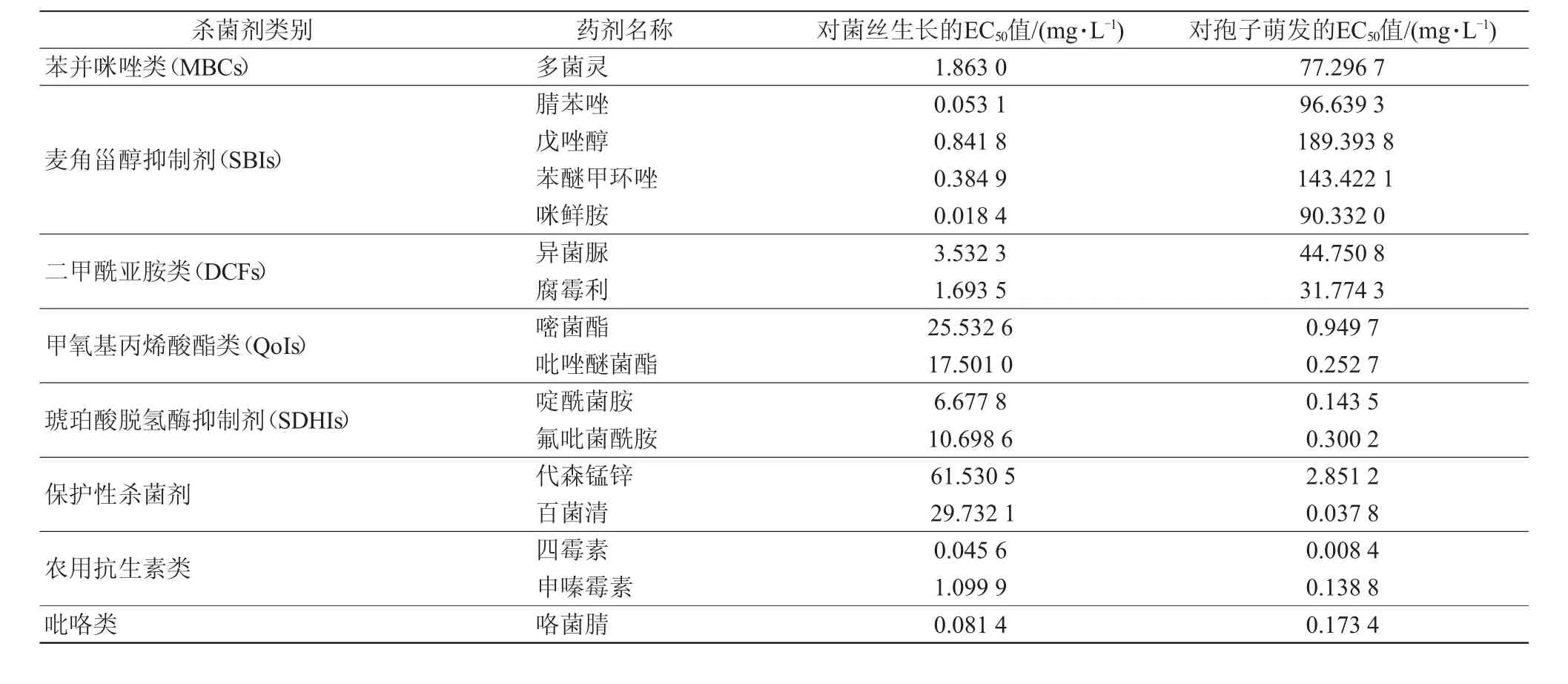
表4 8 類殺菌劑對桃褐腐病菌菌絲生長和孢子萌發的抑制作用比較
3 結論與討論
從殺菌劑的作用機制分析,苯并咪唑類(MBCs)主要是抑制細胞的有絲分裂;麥角甾醇抑制劑(SBIs)主要是抑制生物膜的合成;二甲酰亞胺類(DCFs)為信號傳導抑制劑,使細胞內滲透壓加大而最終死亡。此3類殺菌劑對桃褐腐病菌菌絲生長的抑制活性較強,但對孢子萌發的抑制活性較弱,表明桃褐腐病菌在菌絲生長階段的有絲分裂、生物膜合成及信號傳導活動比孢子萌發階段更加活躍,受到抑制后效果也更加明顯。甲氧基丙烯酸酯類(QoIs)和琥珀酸脫氫酶抑制劑(SDHIs)均為呼吸抑制劑,保護性殺菌劑則作用于多個位點,此3類殺菌劑對桃褐腐病菌孢子萌發的抑制活性較強,但對菌絲生長的抑制活性較弱,表明桃褐腐病菌在孢子萌發階段的呼吸作用比菌絲生長階段更活躍,對保護性殺菌劑的敏感性更高,耐受力更差,受到抑制后效果也更加明顯。農用抗生素類的四霉素(又稱梧寧霉素)和申嗪霉素為多位點殺菌劑,其對桃褐腐病菌菌絲生長和孢子萌發的抑制活性均明顯高于保護性殺菌劑代森錳鋅和百菌清,說明桃褐腐病菌對此2種抗生素更加敏感。吡咯類殺菌劑咯菌腈與二甲酰亞胺類作用機理相似,亦為信號傳導抑制劑,但其對桃褐腐病菌菌絲生長和孢子萌發的抑制活性均明顯高于異菌脲和腐霉利,說明桃褐腐病菌對咯菌腈更加敏感。
本研究結果表明,苯并咪唑類、麥角甾醇抑制劑和二甲酰亞胺類對菌絲生長的抑制活性較強,但對孢子萌發的抑制活性較弱。因此,此類殺菌劑適宜推遲到發病初期菌絲生長階段進行治療應用;保護性殺菌劑、甲氧基丙烯酸酯類殺菌劑和琥珀酸脫氫酶抑制劑對孢子萌發的抑制活性較強,但對菌絲生長的抑制活性較弱。因此,此類殺菌劑適宜在發病前期孢子萌發階段進行預防應用;農用抗生素類四霉素和申嗪霉素以及吡咯類咯菌腈對菌絲生長和孢子萌發均具有很好的抑制活性。因此,此類殺菌劑適宜于在桃褐腐病菌各生育期用藥。但是,同類殺菌劑不同品種間殺菌譜和殺菌特點可能存在較大差異,本試驗測定的殺菌劑品種不能代表該類殺菌劑的全部品種,各類殺菌劑的其他品種對桃褐腐病菌的抑制特性有待進一步測定。
甲氧基丙烯酸酯類(QoIs)殺菌劑屬于線粒體呼吸抑制劑,主要通過抑制細胞色素b與c1間的電子傳遞,從而阻斷ATP產生而使細胞死亡。房雅麗等[6]發現,當正常的電子傳遞途徑被抑制后,植物病原真菌可從旁路氧化途徑獲取能量。在田間,寄主植物會分泌(類)黃酮類物質抑制病原菌旁路氧化途徑,而在培養基培養條件下,旁路氧化途徑則不能被抑制。因此,室內測定時通常需在培養基中加入100 mg/L的水楊肟酸(SHAM)來阻止旁路氧化途徑,但其前提是在此用量下水楊肟酸本身對該病原菌沒有明顯抑制活性,并且對旁路氧化途徑能夠有效抑制。該研究還發現,含量40~100 mg/L的水楊肟酸對大部分桃褐腐病菌菌絲生長具有明顯的抑制作用,不適合用于桃褐腐病菌菌絲生長測定[6];另外,60 mg/L的水楊肟酸雖不影響孢子萌發的最高濃度,但該濃度對旁路氧化途徑的抑制程度尚無定論。因此本試驗PDA培養基和WA培養基中均沒有加入水楊肟酸,水楊肟酸對肥城地區桃褐腐病菌室內毒力測定中旁路氧化途徑的影響數據有待進一步研究。
由于用藥方式和用藥環境不同,室內毒力測定結果與田間試驗結果往往存在差異,本試驗只測定了16種殺菌劑對桃褐腐病菌的室內毒力,其田間防效需進一步試驗驗證。褐腐病有2個發病高峰期:一個是花期,一個是果實成熟期。幼果期一般不發病,落花后被侵染的幼果只在表面出現肉眼可見的小斑點,待到果實成熟期才迅速表現發病癥狀,這種現象被稱為“休止侵染或潛伏侵染”[2],其休止侵染原因尚未見報道。休止侵染對田間藥效試驗也造成了困難,花期用藥會影響授粉并且容易造成藥害,謝花后用藥又不能有效控制病菌花期侵染,只能提前到花露紅時期用藥。實踐顯示,北方桃褐腐病花期試驗不容易調查試驗結果。果實成熟前開展試驗,只能控制病原菌再侵染,對果實內休眠后恢復活力的病原菌則很難發揮作用,并且容易造成采收桃農藥殘留超標。如何制定切實可行的桃褐腐病田間藥效試驗準則需進一步研究。
本試驗測定的菌種為Monilinia fructicola,但引起桃褐腐病的病原菌至少有3種[1],肥城地區是否存在其他2種病原菌以及殺菌劑對其他2種病原菌的毒力是否與本結果一致還有待進一步研究。
本試驗只測定了藥劑對菌絲生長和孢子萌發的抑制活性,對產孢量的影響也有待進一步研究。另外,本毒力測定均采用成品制劑,較之于原藥測定更有利于指導田間應用,但制劑加工中的填料和助劑對測定結果可能存在影響,不同制劑加工技術對桃褐腐病菌的影響因子有待進一步測定。

