二氫楊梅素減輕氧糖剝奪/再灌注所致的神經元氧化應激損傷及機制
李 娜,曹 翔
腦卒中具有高發病率、高致殘率和高死亡率等特點,嚴重危害人類健康。缺血性腦卒中約占全部卒中的80%左右,目前臨床上唯一公認有效的血管內再通治療因時間窗和并發癥的限制,只有不到4%的患者從中獲益[1]。因此,研究新的治療靶點和方法尤為重要。
氧化應激已被證實是影響缺血性腦卒中預后的重要因素之一[2]。降低氧化應激水平可以顯著減輕腦損傷[3,4]。缺血性腦卒中發生后,活性氧(reactive oxygen species,ROS)和脂質過氧化產物(malonaldehyde,MDA)過度產生,內源性抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)等活性下降,導致抗氧化防御系統的清除能力無法發揮作用,這些對神經元等細胞造成巨大損害[5,6]。因此,尋找可以抑制氧化應激的藥物,將成為有效治療缺血性卒中的策略。二氫楊梅素(ampelopsin,Amp)是從藤茶中提取的一種黃酮類化合物,具有抗腫瘤、抗炎癥等多種作用[7,8]。近期有研究發現二氫楊梅素具有改善阿爾茨海默病大鼠的記憶損傷,可能是通過抑制神經炎癥和氧化應激反應,但具體的機制和作用的靶點不明[9]。對于二氫楊梅素是否可以減輕缺血再灌注造成的神經元氧化應激損傷,尚未見文獻報道。
本實驗通過建立體外神經元細胞氧糖剝奪/再灌注(oxygen-glucose deprivation/reoxygenation,OGD/R)模型來模擬體內缺血再灌注損傷,研究二氫楊梅素對神經元氧化應激損傷的影響。
1 材料和方法
1.1 試劑 二氫楊梅素(CAS號27200-12-0,純度98%)購自美國Sigma公司,CCK-8試劑盒、活性氧檢測試劑盒、SOD活性檢測試劑盒、MDA檢測試劑盒購自碧云天公司。Nrf2、HO-1、Lamin B、GAPDH抗體以及對應種屬的二抗均購自美國Cell Signaling公司。Neurobasal、無糖DMEM細胞培養基、B27血清類似物購自美國Gibco公司。
1.2 大腦皮質神經元原代培養 實驗方法參考之前研究[10],簡述如下:取15~17 d齡的C57BL/6胎鼠腦組織,盡可能的去掉所有的血管和血管膜,分離大腦皮質并剪碎,胰蛋白酶消化10 min后接種于經多聚賴氨酸包被的含B27的Neurobasal培養基的細胞培養皿中,置于37 ℃、CO2體積分數為5%的培養箱中常規培養。每2~3 d半換液。利用特異性抗體MAP-2檢測,陽性率大于95%后可用于后續實驗。
1.3 OGD/R模型建立及給藥方式 取生長至10 d的成熟原代皮質神經元,將培養基替換成不含葡萄糖的DMEM培養基后再將細胞培養皿放入缺氧小室中。小室內充入95%N2和5%CO2的混合氣10 min,將閥門密封后將小室在37 ℃下孵育20 min(氧糖剝奪階段)。最后將細胞培養皿取出,更換正常神經元培養基,常規培養24 h(再灌注階段)用于后續實驗。對照細胞一直在正常培養基和環境中培養。二氫楊梅素溶于二甲基亞砜(Dimethyl sulfoxide,DMSO),于再灌注階段開始時以適當濃度稀釋于培養基中,作用神經元。
1.4 CCK-8法檢測細胞活性 將96孔板中成熟的原代神經元細胞OGD處理,再灌注時與不同濃度二氫楊梅素共孵育24 h,然后每孔加入10 μl CCK-8工作液,37 ℃孵育2 h后置于450 nm波長下檢測吸光度值。實驗重復3次,每組實驗設3個復孔,取平均值進行統計分析。
1.5 細胞ROS水平檢測 將OGD/R和藥物處理完畢的神經元細胞用PBS洗3次,加入終濃度為10 μmol/L的 DCFH-DA在37 ℃避光孵育30 min。待孵育結束后,再用PBS洗3次,于倒置熒光顯微鏡下觀察各實驗組ROS的表達水平。實驗重復3次,每組實驗設3個復孔,取平均值進行統計分析。
1.6 SOD活性和MDA含量測定 細胞處理結束,利用經典的氮藍四唑顯色法測定SOD活性,硫代巴比妥酸顯色反應來定量檢測MDA的含量。
1.7 細胞核質分離與免疫印跡 將OGD/R和藥物處理完畢的細胞用預冷的PBS洗3遍,棄去PBS后加入細胞質裂解液(含蛋白酶抑制劑)冰上裂解30 min,接著用細胞刮板將細胞完全刮下,4 ℃ 12500 rpm/min離心30 min,上清為細胞質蛋白。沉淀部分再與細胞核裂解液冰上孵育20 min,同樣離心方式得到的上清為核蛋白。BCA法定量每組樣品后取等量蛋白上樣,進行SDS-聚丙烯酰胺凝膠電泳。電泳后恒壓轉膜,接著用5%脫脂奶粉封閉1 h,4 ℃一抗孵育過夜。次日用相應種屬來源的二抗室溫孵育1 h,化學發光法顯影,用Image J軟件分析實驗結果。
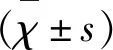
2 結 果
2.1 二氫楊梅素對神經元細胞活性及OGD/R后細胞存活率的影響 研究發現,二氫楊梅素在150 μg/ml(大約是468 μmol/L)的濃度下對小鼠單核巨噬細胞系RAW264.7活力沒有影響[11]。為了進一步檢測二氫楊梅素對原代神經元細胞的毒性情況,我們運用CCK8法檢測細胞活力,結果(見圖1),與對照組相比,1~30 μmol/L的二氫楊梅素對原代神經元細胞活性影響無統計學差異(P>0.05),但是50 μmol/L的二氫楊梅素顯著降低了神經元細胞活性(P<0.01)。接下來,我們繼續觀察是否二氫楊梅素可以降低OGD/R造成的神經元細胞死亡率。在OGD/R的一開始,我們加入0~30 μmol/L濃度的二氫楊梅素作用于原代神經元細胞24 h后,結果發現,20 μmol/L 和30 μmol/L的二氫楊梅素均顯著提高了OGD/R造成的細胞死亡率(OGD/R+20 μmol/L Amp vs OGD,P<0.05;OGD/R+30 μmol/L Amp vs OGD,P<0.01)(見圖1)。這些結果證明二氫楊梅素在其無藥物毒性濃度的情況下表現出神經保護作用,并在30 μmol/L濃度下保護效果最佳,故我們以30 μmol/L的二氫楊梅素作為后續研究的藥物濃度。

圖1 二氫楊梅素對神經元細胞活性及OGD/R后細胞存活率的影響。與對照組比較**P<0.01;與OGD/R組比較#P<0.05, ##P<0.01
2.2 二氫楊梅素減少OGR/R引起的細胞內ROS表達 30 μmol/L的二氫楊梅素處理OGD/R的原代神經元細胞24 h,熒光顯微鏡檢測細胞氧化應激產物ROS的表達后發現,對照組細胞的ROS表達量很低,而OGD/R刺激組,ROS含量顯著增加(P<0.01),運用二氫楊梅素處理的神經元細胞ROS的表達水平明顯降低(P<0.01),差異具有統計學意義(見圖2)。

圖2 二氫楊梅素減少OGD/R引起的神經元細胞內ROS表達。與對照組比較**P<0.01;與OGD/R組比較##P<0.01。標尺100 μm
2.3 二氫楊梅素對OGD/R神經元SOD活性和MDA含量的影響 在觀察到二氫楊梅素可以減少ROS的產生后,我們進一步檢測抗氧化酶SOD以及脂質過氧化產物MDA的表達水平。結果發現,與對照組相比,OGD/R組神經元SOD活性明顯降低,而MDA水平顯著增高。在二氫楊梅素處理組中,其顯著提高了神經元細胞SOD的活性并降低MDA的含量(見圖3)。

圖3 二氫楊梅素對OGD/R所致神經元SOD活性和MDA含量的影響。與對照組比較*P<0.05,**P<0.01;與OGD/R組比較#P<0.05
2.4 二氫楊梅素對OGD/R神經元Nrf2/HO-1信號通路的影響 核因子E2相關因子(nuclear factor erythroid 2-related factor 2,Nrf2)/血紅素氧合酶1(heme oxygenase 1,HO-1)通路在細胞氧化應激反應中起著關鍵的作用,其中HO-1是公認的具有抗氧化功能的分子,在許多疾病中起著重要的保護作用,而HO-1的表達是由Nrf2所誘導[12]。我們在這部分研究中觀察二氫楊梅素是否能影響Nrf2/HO-1信號通路從而減輕OGD/R造成的氧化應激損傷。實驗結果發現,二氫楊梅素的處理上調了HO-1的表達,同時增加Nrf2在細胞核中的表達,使得更多的Nrf2在核內發揮轉錄功能(見圖4)。

圖4 二氫楊梅素對OGD/R神經元Nrf2/HO-1信號通路的影響。與對照組比較*P<0.05,**P<0.01;與OGD/R組比較#P<0.05, ##P<0.01
3 討 論
氧化應激在腦缺血再灌注造成的腦損傷過程中起著非常重要的作用[12]。氧化應激損傷發生后,腦細胞中的抗氧化物質被大量消耗,造成細胞內促氧化和抗氧化系統失衡,進而引起神經元細胞死亡。因此,增加細胞內的抗氧化物質、減少促氧化的產物生成是降低細胞氧化應激損傷的重要手段之一。
在我國南方,藤茶是一種功能性飲料,它具有多種生物學功能,而二氫楊梅素是藤茶的主要成分[13]。我們課題組前期的研究發現二氫楊梅素可以通過抑制小膠質細胞NF-κB與JAK2/STAT3信號通路發揮抗炎作用[8]。一項關于黃酮類化合物神經保護的研究中,已經證實二氫楊梅素能夠通過血腦屏障發揮作用[14]。有研究表明,在阿爾茨海默癥動物模型中,利用二氫楊梅素治療不僅可以改善行為學缺損,還可改善γ氨基丁酸的轉運,同時能夠抑制神經炎癥和氧化應激反應的發生[9,15]。然而,關于二氫楊梅素對缺血再灌注造成的神經元氧化應激損傷的作用知之甚少。本實驗結果顯示:二氫楊梅素可以顯著提高體外OGD/R后的神經元細胞存活率,降低ROS水平,提高抗氧化酶SOD活性,并減少脂質過氧化物MDA的表達。這些提示我們,二氫楊梅素可以保護神經元對抗體外OGD/R造成的細胞死亡,這與其降低了氧化應激損傷有關。
Nrf2抗氧化通路在響應氧化應激的神經保護中發揮重要作用[12,16]。正常生理狀態下,Nrf2位于細胞質中,不能進入細胞核發揮轉錄活性。當細胞受到外界刺激后,Nrf2會轉移到細胞核中,與Maf蛋白形成異二聚體,并和抗氧化反應原件ARE結合從而激活包括HO-1在內的許多抗氧化酶的轉錄,共同抵御外來的有害刺激[17]。Nrf2的基因敲除小鼠與正常小鼠相比,抗氧化應激的效應明顯減弱。HO-1作為Nrf2下游蛋白之一,實驗證實其在短暫性全腦缺血模型、短暫和永久性大腦中動脈栓塞模型、以及光栓模型中的表達均是下調的[18,19]。HO-1基因敲除小鼠,腦梗死體積顯著增大。提高HO-1的表達,則能夠減輕缺血再灌注造成的腦損傷[20]。因此,在本研究中我們推測二氫楊梅素有效的降低ROS、MDA水平,促進SOD活性增強可能與Nrf2/HO-1抗氧化通路有關。于是,在接下來的實驗中,我們利用免疫印跡技術檢測了HO-1蛋白的表達,發現二氫楊梅素處理后可以增加OGD/R神經元細胞的HO-1表達。同時,實驗結果還發現調控HO-1表達的Nrf2蛋白核質轉移也受到影響,二氫楊梅素的處理導致了更多的Nrf2進入核內,具有轉錄更多抗氧化物質的潛力。
綜上所述,二氫楊梅素抑制OGD/R所致的原代神經元細胞氧化應激損傷,可能是通過激活Nrf2/HO-1抗氧化通路來實現的。本研究進一步豐富了二氫楊梅素在缺血再灌注損傷的運用價值,并為缺血性腦卒中的治療提供新的干預手段和實驗基礎。

