甘氨酸仿生合成SnO2及其光催化性能的研究*
劉程成,王玉鋒,郭 攀,卞振濤,王 聰,王紅艷
(1 宿州學院,安徽 宿州 234000;2 安徽創佳安全環境科技有限公司,安徽 宿州 234000)
目前,工業發展對人類賴以生存和發展的水資源產生了巨大的威脅,有機染料污水是工業污水的重要方面。因此,治理有機染料水體污染是人類綠色發展必須克服的問題[1]。在過去的幾十年里,一系列傳統金屬氧化物,如TiO2、ZnO和SnO2,已經成為光催化降解有機污染物的重要催化劑[2]。SnO2納米材料是一種寬帶隙N型半導體金屬氧化物,n型寬帶隙半導體材料(Eg=3.6 eV,at 300 ℃),SnO2是一種重要的功能材料在許多領域,如鋰離子電池、染料敏感太陽能電池、場效應晶體管、氣體傳感器,尤其是光催化[3]。現如今有許多制備SnO2納米材料的方法,汽液固方法,空氣中的燃燒化學氣相沉積,脈沖激光沉積法,水熱和溶劑熱合成法,超聲化學法,緩慢強制水解法,共沉淀法,固態合成法等[4]。仿生合成是指人為模仿生物有機質調控無機物礦化過程合成方法[5]。氨基酸通過與金屬離子之間形成配位作用和靜電作用,對納米材料結晶的早期階段有多種影響[6]。Lin等[7]報道,采用水熱法,以甘氨酸為模板,可控合成了WO3納米線。本文以甘氨酸為有機模板,以五水四氯化錫晶體為主要原料,采用水熱法探討了甘氨酸對二氧化錫納米材料形成的影響。
1 實 驗
1.1 主要試劑與儀器
本實驗所用試劑除亞甲基藍為指示劑級外,其他試劑均為分析純。實驗所用主要儀器設備為U-3310型紫外可見分光光度計、DX-2600X射線衍射儀(XRD)、ZS90納米粒度及Zeta電位分析儀。
1.2 二氧化錫納米材料的制備
本實驗是以甘氨酸為模板,以五水合四氯化錫(SnCl4·5H2O)為原料,采用兩步法制備二氧化錫納米材料。具體步驟如下:
1.2.1 二氧化錫前驅體的制備
分別用15 mL去離子水溶解1.05 g SnCl4·5H2O和0.72 g NaOH,然后將氯化錫溶液逐滴加入氫氧化鈉溶液中,形成混合溶液。然后將10 mL 200 g/L甘氨酸加入以上混合溶液中。最后將混合溶液在50 mL反應釜中,于電熱恒溫干燥箱中,在160 ℃的溫度反應12 h。將反應得到樣品用水和乙醇交替洗滌后,在真空干燥,得到二氧化錫前驅體。控制其他條件不變,僅改變試劑投放種類,做了以下的實驗,第1組是氫氧化鈉與四氯化錫的反應;第2組是氫氧化鈉與甘氨酸的反應;第3組是甘氨酸與四氯化錫的反應。其他條件不變,將氫氧化鈉與五水合四氯化錫的質量同時為原來的一倍、兩倍和四倍合成二氧化錫前驅體。
1.2.2 二氧化錫納米材料的制備
將第一步制備的SnO2前驅體用研缽研碎,取適量放入箱式爐中,以5 ℃/min的升溫速率從室溫上升到350 ℃,并在350 ℃的條件下煅燒2 h,煅燒完成后自然冷卻,最后得到SnO2納米材料。
1.3 光催化實驗
根據文獻報道方法,進行光催化實驗,具體步驟如下:首先,稱取50 mg的SnO2納米材料,取50 mL濃度為0.05 g/L亞甲基藍溶液放入100 mL燒杯中,將稱好的SnO2納米材料倒入亞甲基藍溶液中,并放入一個磁子,暗反應30 min達到吸附-脫附平衡。然后在光照下進行光催化反應,每隔30 min取一定量的亞甲基藍溶液,離心分離出上清液,測量上清液的紫外可見吸收光譜,記下最大峰吸收強度并計算亞甲基藍的降解率[8]。
2 結果與分析
2.1.1 XRD分析
圖1中A為NaOH與SnCl4·5H2O反應產物的XRD, B為甘氨酸與SnCl4·5H2O產物的XRD,C為 NaOH、SnCl4·5H2O與甘氨酸反應制備的二氧化錫前驅體的XRD,D為煅燒后的SnO2納米材料的XRD。從XRD圖譜可以看出,我們用不同的條件所制備出的物質在2θ為26.611°、33.893°、37.949°、51.780°、54.757°、61.870°、64.717°、65.937°都有峰,對比SnO2PDF標準卡(PDF#41-1445)分別為110、101、200、211、220、310、112、301的SnO2晶面衍射峰,與純二氧化錫的衍射峰基本一致,所以可確認在不同條件下制備的產物為二氧化錫。

圖1 SnO2前驅體及納米材料 XRD圖譜
2.1.2 粒度分析
圖2是不同投放原料反應制備的二氧化錫粒度分析圖,由圖2可知,由NaOH與SnCl4·5H2O反應制備的二氧化錫的粒徑是在100~1000 nm之間,粒徑分布較大,粒徑為171.0 nm到307.6 nm的粒子占79.3%,最小粒徑為127.5 nm,最大粒徑達到640.7 nm,粒子大小不均勻。由甘氨酸與SnCl4·5H2O反應制備的二氧化錫的粒徑在100~1000 nm之間,粒徑為229.3 nm到356.2 nm的粒子占90.5%,粒子最小粒徑為198.0 nm,粒子的最大粒徑達到477.7 nm,粒子尺寸較大。NaOH、SnCl4·5H2O與甘氨酸反應制備的二氧化錫前驅體的粒徑尺寸分布在10 nm左右,粒徑為9.083 nm到14.11 nm的粒子占84.1%最小粒徑為7.843 nm,最大粒徑可達到29.39 nm。經過煅燒所得的二氧化錫的粒徑在265.6 nm到412.5 nm的粒子占88.3%,粒子最小粒徑為229.3 nm,粒子的最大粒徑為553.2 nm,我們可以看出煅燒后粒子變大。綜上所述,甘氨酸在二氧化錫前驅體制備過程發揮了調節控制的作用,使得二氧化錫的尺寸更小,粒子更均勻。
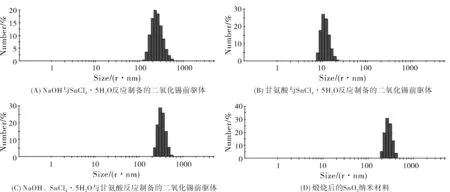
圖2 粒度分析
綜合納米粒度以及XRD分析,我們可以看出,盡管NaOH與SnCl4·5H2O反應以及甘氨酸與SnCl4·5H2O反應都可以得到二氧化錫前驅體,但是粒經不夠均勻,尺寸較大,NaOH與SnCl4·5H2O反應后再加入甘氨酸,得到的粒子尺寸小,并且對比純二氧化錫的PDF標準卡出峰位置也比較一致。由此可見,甘氨酸對二氧化錫納米材料的尺寸生長有調控作用。所以我們選擇甘氨酸仿生方法制備二氧化錫納米材料。
2.2 不同投放質量實驗
2.2.1 XRD分析
圖3不同質量原料制備樣品的XRD圖譜,圖3E為NaOH與SnCl4·5H2O為原來質量的一倍, 圖3F為NaOH與SnCl4·5H2O為原來質量的兩倍,圖3G為NaOH與SnCl4·5H2O為原來質量的四倍,圖3H為NaOH與SnCl4·5H2O為原來質量的一倍煅燒制備的產物。從圖3XRD圖譜中可以看出,通過改變NaOH與SnCl4·5H2O的質量原料制備的產物,均為SnO2,結晶度沒有明顯的變化。NaOH與SnCl4·5H2O為原來質量的一倍制備的樣品通過煅燒后結晶度有了明顯提高。
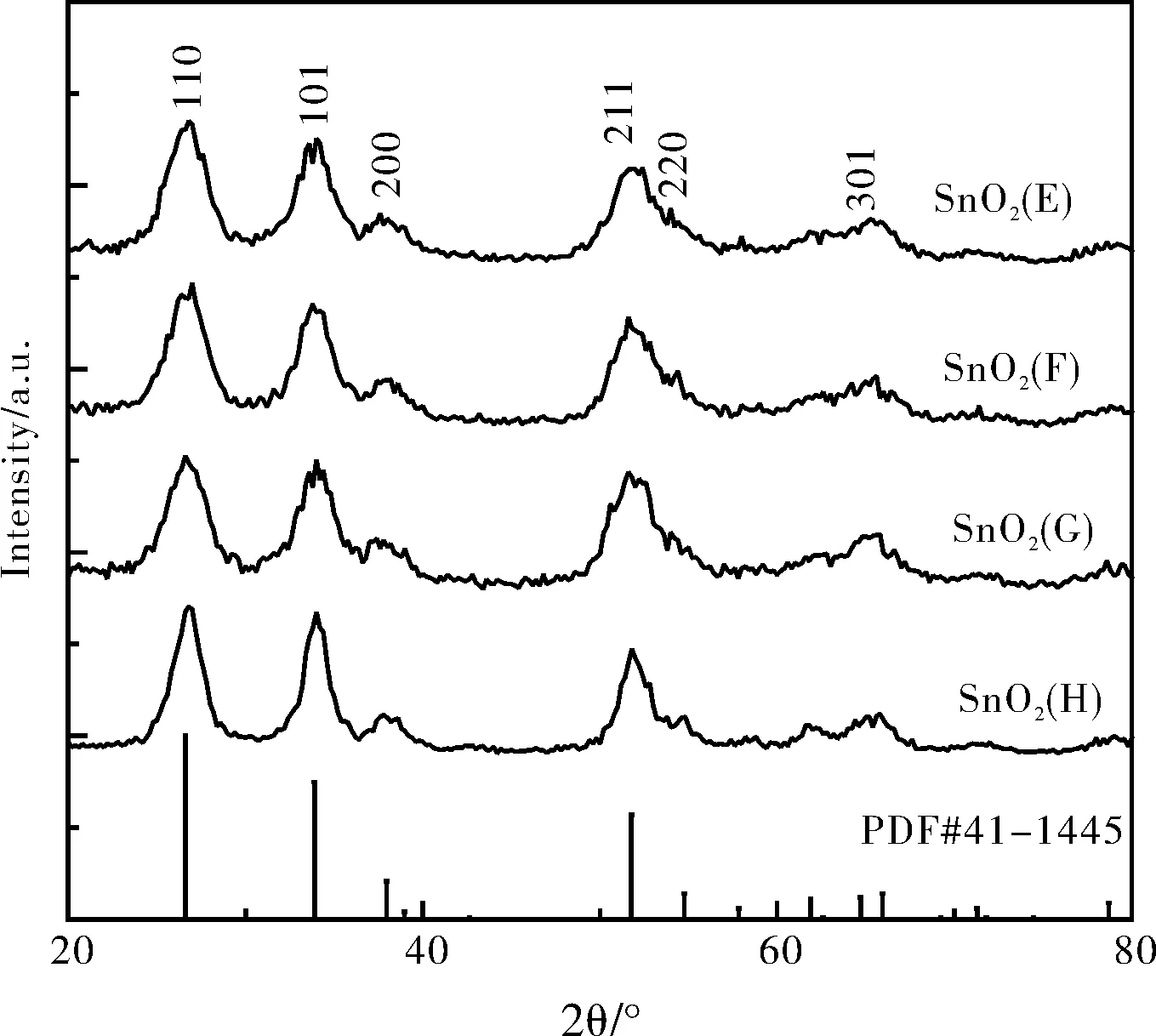
圖3 不同投放質量制備SnO2 XRD圖譜
2.2.2 粒度分析
圖4F為NaOH與SnCl4·5H2O為原來質量的兩倍制備樣品的粒徑分析圖譜,從粒徑分析圖譜可以看出SnO2粒子的粒徑在100 nm左右,粒徑為70.89 nm到127.5 nm的粒子占67.6%,粒子尺寸較大。圖4G圖為NaOH與SnCl4·5H2O為原來質量的四倍制備樣品的粒徑分析圖譜,圖中粒子的尺寸分布在10~100 nm之間,粒徑為21.91 nm到34.03 nm的粒子占85.7%,粒子尺寸偏小但是不均勻。總之,一倍質量的氫氧化鈉與五水四氯化錫與甘氨酸反應制備的二氧化錫納米材料尺寸均勻,粒徑較小。通過粒徑分析結果看出,原料的投入量對二氧化錫納米材料尺寸有一定的影響。
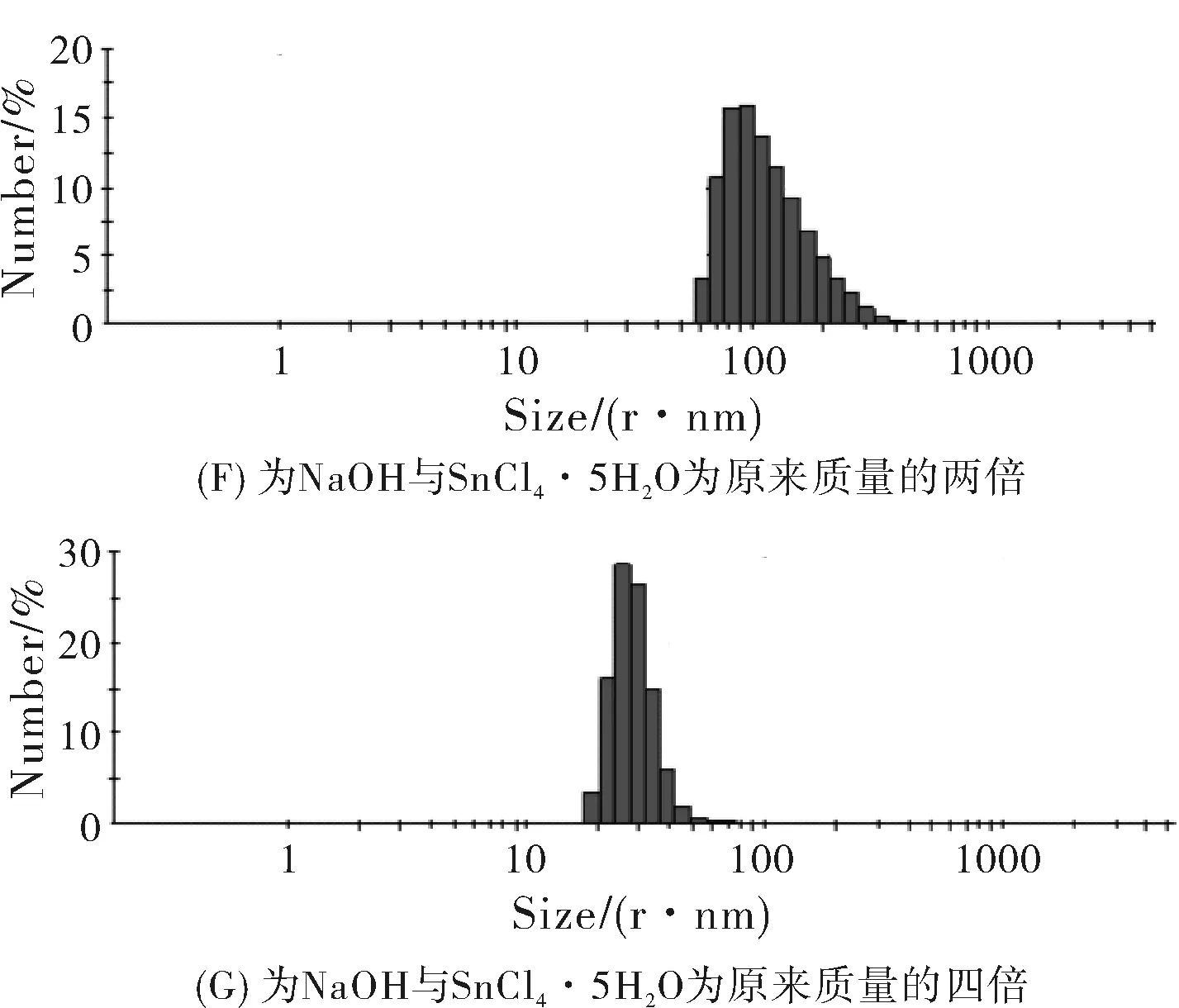
圖4 不同質量原料制備樣品的粒徑分析圖譜
2.3 Zate電位分析
從圖5可以看出,二氧化錫納米材料的Zate電位為-31.5 mV。亞甲基藍是水溶性陽離子染料,SnO2納米材料表面帶負電荷,因此,亞甲基藍比較容易會被吸附到SnO2納米材料表面,有利于下一步光催化實驗的進行。

圖5 煅燒后二氧化錫納米材料Zate電位分析圖
2.4 光催化性能的研究
圖6a是SnO2納米材料降解亞甲基藍溶液的紫外吸收光譜圖,隨著時間的延長,亞甲基藍溶液最大吸光度是不斷降低的。由吸收峰的強弱是與亞甲基藍溶液濃度成正比的,所以我們可以判斷,隨著時間的推移,亞甲基藍溶液濃度逐漸降低。圖6b是SnO2納米材料光催化降解亞甲基藍降解率圖,由圖6b可以得知當光照180 min后,SnO2納米材料對亞甲基藍的降解率達到75.46%。
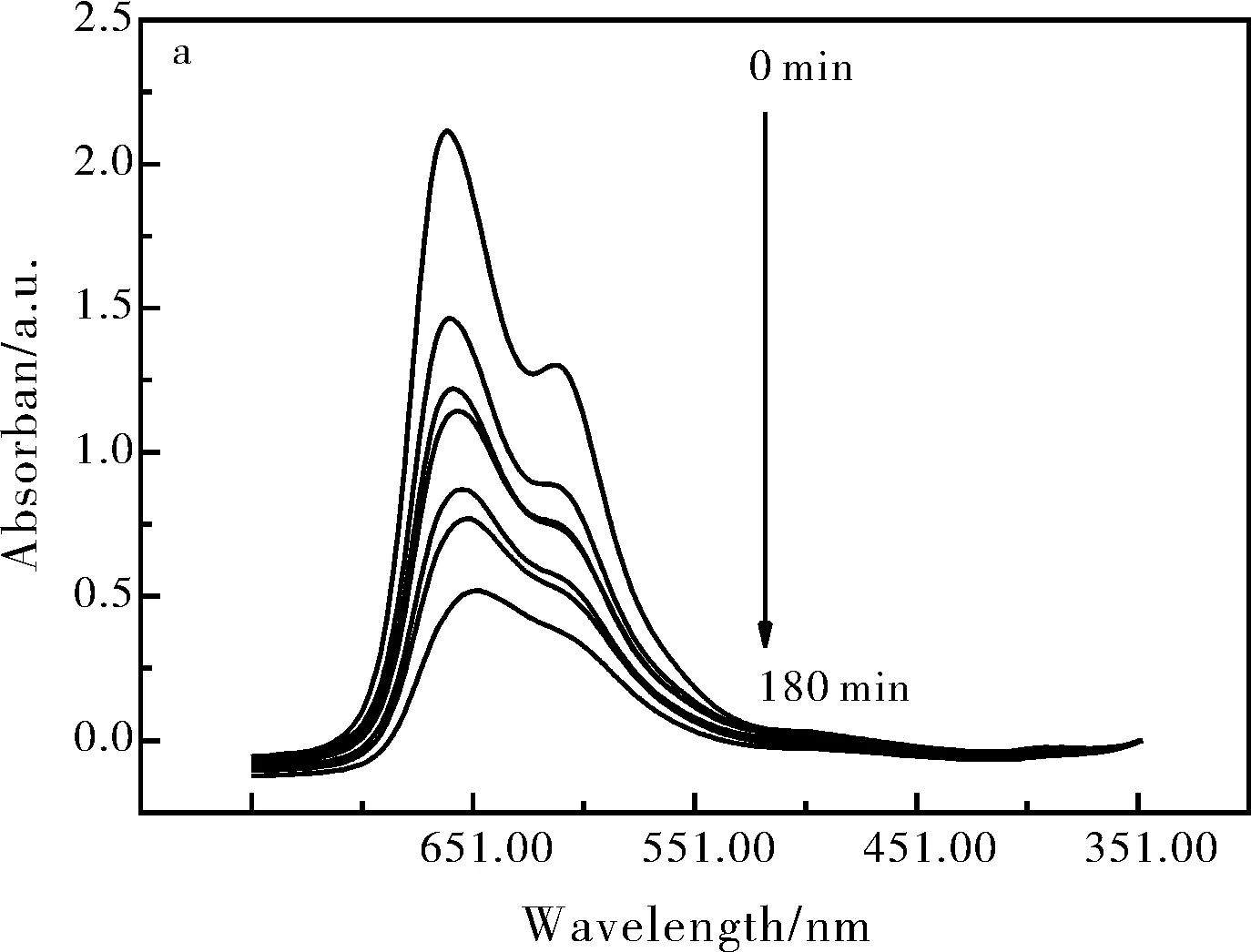

圖6 SnO2納米材料催化降解亞甲基藍的紫外吸收光譜圖(a);SnO2納米材料對亞甲基藍的降解率圖(b)
3 結 論
本文以甘氨酸為模板,以五水四氯化錫晶體為主要原料,采用水熱法仿生合成二氧化錫前驅體,通過箱式爐煅燒得到SnO2納米材料。通過比較不同投放原料的種類和質量對制備二氧化錫前驅體尺寸的研究,發現甘氨酸在二氧化錫前驅體尺寸有調控作用。在日光下,研究SnO2納米材料的光催化性能。實驗結果表明,50 mg SnO2納米材料對0.05 g/L的亞甲基藍溶液進行光催化降解,在180 min時降解率可達到75.46%。

