國外患者傾聽機制在醫(yī)藥產(chǎn)品生命周期中的應用及對我國的啟示
謝燭光,周 茜
(中國藥科大學國際醫(yī)藥商學院,江蘇 南京 211198)
隨著人均壽命及經(jīng)濟水平的提高,為滿足人們?nèi)找嬖鲩L的生活質(zhì)量需求,傾聽患者聲音在醫(yī)藥產(chǎn)品全生命周期中受到了越來越多的重視。以往醫(yī)藥產(chǎn)品發(fā)展往往存在患者訴求盲點,某些疾病患者長期生活質(zhì)量不高。目前,美國和歐盟監(jiān)管機構(gòu)或制藥企業(yè)均已在全產(chǎn)品生命周期傾聽患者聲音,致力于在提升患者生活質(zhì)量的同時,提升藥品研發(fā)效率。中國人口基數(shù)大,創(chuàng)新醫(yī)藥產(chǎn)品勢頭強,信息產(chǎn)業(yè)發(fā)展蓬勃,開展患者聲音傾聽活動并將其運用至醫(yī)藥產(chǎn)品開發(fā)與審評工作中,是可行且必要的。2020年4月,國家藥監(jiān)局在新版《藥品注冊管理辦法》中,強調(diào)我國藥品審評審批應與國際接軌,體現(xiàn)“以人為本,以患者為中心”的人文價值觀。目前,我國某些疾病患者組織及制藥企業(yè)已開始收集患者聲音,我國醫(yī)藥產(chǎn)品監(jiān)管機構(gòu)也在強調(diào)提升患者就醫(yī)體驗的以患者為中心的醫(yī)療服務提供。但目前患者體驗提升僅在就醫(yī)層面,包括減少患者候診時間、為患者提供開放信息查詢平臺等。本文通過梳理美國、歐盟醫(yī)療監(jiān)管機構(gòu)傾聽客戶聲音體系建設,針對性地為我國傾聽患者聲音活動提出相應建議。
1 患者聲音的全產(chǎn)品生命周期貢獻
信息時代,患者對于疾病特征以及治療方案相較于以往有了更多的認識,也逐步從源頭參與醫(yī)藥產(chǎn)品開發(fā)。患者聲音可包括患者對疾病或治療方案在生理與心理的體驗、對治療方案或醫(yī)療產(chǎn)品的想法、需求、偏好等。在醫(yī)藥產(chǎn)品開發(fā)的最初時點便聆聽患者聲音,可結(jié)合定性與定量方法,洞察患者未被滿足的需求,發(fā)現(xiàn)患者潛在需求。
患者聲音的運用可貫穿于醫(yī)藥產(chǎn)品全生命周期。從臨床試驗前的發(fā)現(xiàn)與開發(fā)階段,到臨床試驗階段,再到上市后監(jiān)管階段,患者聲音信息向不同主體提供了分階段差異信息。
臨床試驗前作用及影響主要包括4個方面:①識別疾病負擔、現(xiàn)有治療方案及用藥方式體驗、患者的未滿足需求;②了解疾病診斷過程、疾病可治療性等信息;③識別特定疾病的主要影響因素;④了解進行臨床試驗的潛在障礙。臨床試驗中的作用及影響主要包括8個方面:①開發(fā)目標產(chǎn)品檔案(Target Product Profile,TPP),包括產(chǎn)品的預期用途、目標人群、安全性和有效性等信息;②幫助臨床試驗設計方案、受試者選擇依據(jù)、保留策略的制定;③影響臨床結(jié)果評估指標的選擇、設計,以及評估的實施過程;④有利于識別治療方案的亮點;⑤識別患者對治療方案的偏好和滿意度;⑥預測與測算患者對醫(yī)藥產(chǎn)品依從性;⑦患者舒適度;⑧影響監(jiān)管機構(gòu)與投資者協(xié)商。上市批準后的作用及影響主要有3個方面:①標準護理評估;②臨床實踐中患者報告的結(jié)果(PRO);③患者支持調(diào)查等。
在醫(yī)藥產(chǎn)品開發(fā)階段,通過傾聽患者聲音,從患者自主訴說的訴求體驗信息,分析患者疾病承受過程中未實現(xiàn)的需求,該需求包括治療方案開發(fā)、優(yōu)化等,可為新醫(yī)藥產(chǎn)品研發(fā)方向提供建議。在醫(yī)藥產(chǎn)品臨床試驗階段,患者聲音可幫助開發(fā)TPP、識別新治療方式的亮點、選擇與設計臨床試驗結(jié)果評價指標等,以提升臨床終點指標與患者偏好的匹配度。在醫(yī)藥產(chǎn)品上市評估階段,醫(yī)藥產(chǎn)品監(jiān)管機構(gòu)也會在考慮醫(yī)藥產(chǎn)品安全、有效的基礎上,關(guān)心患者中心指標,以期提升患者舒適度及其生活質(zhì)量。在醫(yī)藥產(chǎn)品上市后階段,傾聽患者聲音可發(fā)現(xiàn)醫(yī)藥產(chǎn)品使用中出現(xiàn)的問題,追蹤患者需求變化,進一步提升醫(yī)藥產(chǎn)品質(zhì)量。
2 美國和歐盟患者聲音收集
美國與歐盟正積極、廣泛地開展患者聲音收集活動,患者聲音的收集主體包括監(jiān)管機構(gòu)、微觀企業(yè)以及公私聯(lián)盟組織(Public/Private Partnerships)。
2.1 美國患者聲音收集
美國食品藥品監(jiān)督管理局(FDA)于2012年建立了以患者為中心的藥品開發(fā)計劃(PFDD),致力于更系統(tǒng)地了解患者對特定疾病與其現(xiàn)有治療方案的看法[1,2]。自2012年以來,F(xiàn)DA通過舉行PFDD會議的方式收集患者聲音,目前共收集并公布了26種特定疾病的患者聲音[3]。同時,F(xiàn)DA認為,僅通過召開PFDD會議并不能很好地收集患者聲音,于是FDA正致力于構(gòu)建患者聲音傾聽的方法學體系,該方法學指南已于2018年推出第一版草案[4]。
FDA不僅單獨收集患者聲音,也會和美國私人組織合作。如關(guān)鍵路徑研究所(C-Path)和臨床試驗轉(zhuǎn)化計劃(CTTI),兩者分別致力于藥物開發(fā)過程的改善與臨床試驗質(zhì)量和效率的提升。
2.2 歐盟患者聲音收集
歐洲藥品管理局(EMA)主要通過將患者納入科學咨詢工作組(SAWP)以傾聽患者聲音,2011-2016年,加入EMA的患者人數(shù)增加了82%[5]。EMA對藥品的全流程監(jiān)管中也將患者納入監(jiān)管機構(gòu)中[6],包括孤兒藥委員會(COMP)、先進療法委員會(CAT)、人類用藥委員會(CHMP)、科學咨詢工作組(SAWP)、兒科委員會(PDCO)、科學咨詢小組(SAG)、藥物警戒風險評估委員會(PRAC)等。EMA中患者參與監(jiān)管的分布見圖1。
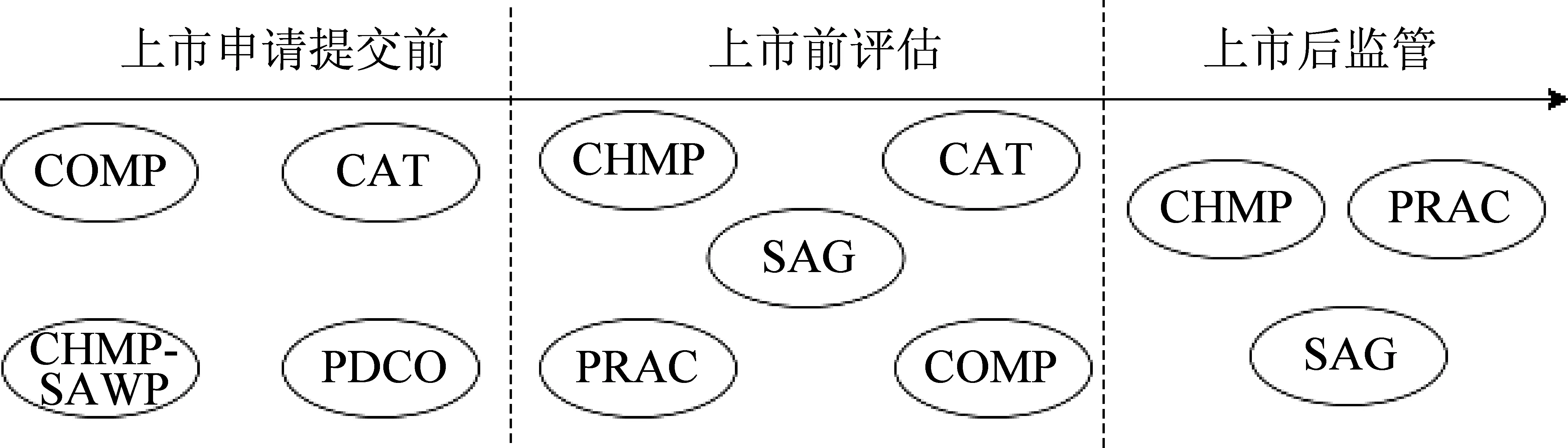
圖1 EMA的患者參與監(jiān)管分布圖
由圖1可知,EMA將患者聲音信息更多地運用于孤兒藥、兒科藥、先進治療醫(yī)藥產(chǎn)品,且患者聲音的運用貫穿于整個醫(yī)藥產(chǎn)品生命周期。
同時,EMA也與私人組織合作,如旨在優(yōu)化藥物開發(fā)研究的創(chuàng)新藥物計劃(Innovative Medicines Initiative,IMI)。另外,EMA正致力于開發(fā)新途徑收集患者聲音,定位患者偏好,如聯(lián)合MACBETH軟件[7],對患者進行偏好調(diào)研等。
2.3 美國和歐盟患者聲音共享機制
為了全面傾聽患者聲音,獲取患者信息,F(xiàn)DA與EMA共同成立了患者聲音的共享平臺——患者參與工作組(Patient Engagement Cluster),以共享在生物類似藥、癌癥藥、孤兒藥、兒童藥、藥物警戒等主題的監(jiān)管視閾患者聲音[8]。該工作組主要關(guān)注如何讓患者更好地表達訴求,如何將患者聲音信息更好地運用到監(jiān)管工作中,如何對患者進行培訓使其能更高效地參與到醫(yī)藥產(chǎn)品監(jiān)管中等。通過國際信息共享,識別更多患者聲音,共同完善患者聲音傾聽機制。
3 監(jiān)管機構(gòu)對患者聲音的傾聽
3.1 美國FDA
上世紀80年代,由于艾滋病(HIV/AIDS)缺乏治療方案,且存在研發(fā)資金不足、研發(fā)時間長等問題,艾滋病患者便自發(fā)向FDA發(fā)起了抗議活動。1988年,F(xiàn)DA成立了艾滋病患者小組,此后,患者聲音逐步被納入醫(yī)藥產(chǎn)品監(jiān)管過程[9]。FDA的患者聲音納入如圖2所示。
其中,患者與護理人員交流計劃(P&CC)旨在為器械與放射衛(wèi)生中心(CDRH)的工作人員提供獲取患者與護理人員意見的正式流程;PEC指患者參與協(xié)作(Patient Engagement Collaborative)。
由圖2可見,F(xiàn)DA自1991年便將患者聲音考慮至監(jiān)管過程,并結(jié)合私人組織與EMA共同收集與傾聽患者聲音,以便獲取更多信息。
3.2 歐盟EMA
自1995年EMA成立以來,患者聲音一直被EMA傾聽[9]。EMA的患者聲音納入如圖3所示。
同時,EMA的藥品審評審批過程也充分傾聽了患者聲音,在EMA的7個藥品評價委員會中,有4個委員會(包括孤兒藥、兒科用藥、先進療法、藥物警戒)中納入了患者作為委員會正式成員[9]。EMA藥品審評審批框架如圖4所示。
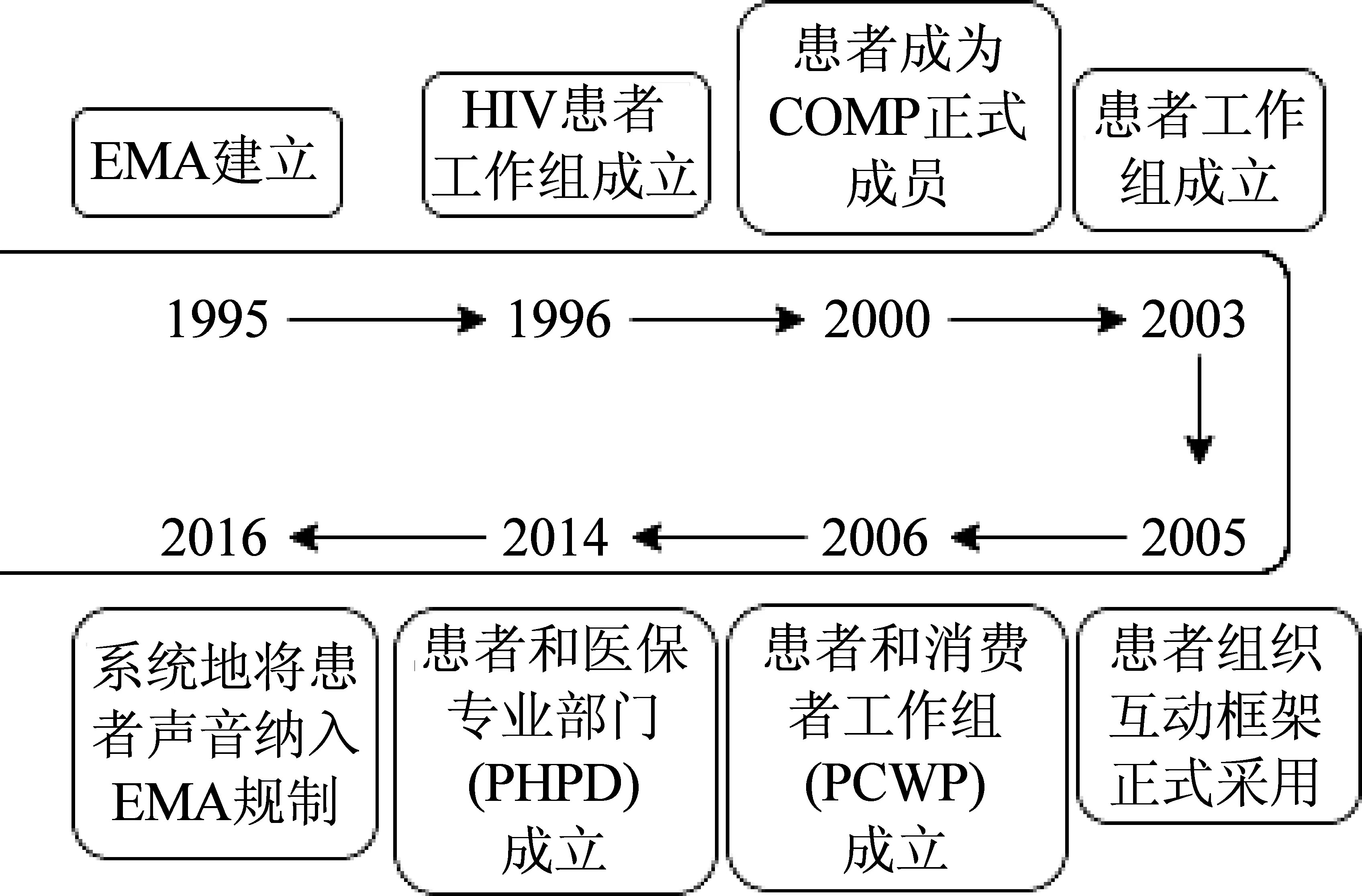
圖3 EMA患者聲音傾聽
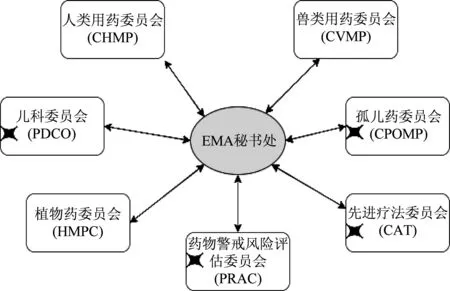
圖4 EMA藥品審評審批框架
3.3 美國、歐盟、日本和我國患者聲音監(jiān)管機構(gòu)使用情況
目前歐美的患者聲音傾聽活動開展得較成熟,主要基于監(jiān)管機構(gòu)與微觀企業(yè)與組織均積極開展與鼓勵傾聽患者聲音,如美國《21世紀治愈法》中提到,自2017年6月起,新藥審批申請需包含患者體驗(Patients Experience)信息報告[10]。除美國與歐盟外,日本厚生勞動省在2017年公布的《促進癌癥控制基本計劃》中也提到了傾聽患者聲音的必要性,并指出如果政府與醫(yī)藥企業(yè)共同傾聽患者聲音,信息收集將更有效。可目前日本還沒有發(fā)布與以患者為中心相關(guān)的活動指南,也沒有把患者納入藥品管理機構(gòu)中,但已逐漸開始傾聽患者聲音[11],見表1。

表1 美國、歐盟、日本和我國患者聲音使用情況
4 總結(jié)與啟示
4.1 美國和歐盟患者傾聽活動經(jīng)驗
通過梳理歐美日地區(qū)患者傾聽活動,發(fā)現(xiàn)有如下特征:
第一,患者聲音的收集活動呈現(xiàn)逐步脫離醫(yī)療機構(gòu)中介,而由微觀企業(yè)與監(jiān)管機構(gòu)直接收集患者聲音的趨勢。在信息化時代,信息壁壘已被逐步打破,患者聲音的收集活動不再需通過醫(yī)療機構(gòu)為中介向藥品生產(chǎn)端與監(jiān)管端傳遞,現(xiàn)有患者聲音傾聽活動大多直接對接患者,擴充了患者聲音的廣度,確保了患者聲音的真實、可靠。
第二,患者聲音收集周期長、程度深。患者聲音的傾聽不僅在醫(yī)藥產(chǎn)品上市后階段進行收集,且貫穿于醫(yī)藥產(chǎn)品全流程,從藥品開發(fā)階段至臨床試驗階段、至上市階段、至上市后階段均密切關(guān)注患者聲音。同時,患者聲音傾聽的維度廣,收集的信息豐富,信息挖掘程度深。
第三,患者聲音運用高效。患者聲音收集后,將對其進行深度分析,并從多方面、多角度探討其運用方式,包括縱向從醫(yī)藥產(chǎn)品全生命周期運用患者聲音,也包括橫向進行跨國間患者聲音共享合作,以更好地洞察患者側(cè)全方位醫(yī)藥信息。
4.2 我國患者傾聽工作現(xiàn)狀及啟示
針對以上美國和歐盟患者傾聽活動經(jīng)驗,分析我國現(xiàn)狀并得到如下啟示:
第一,我國應系統(tǒng)收集患者聲音。我國微觀醫(yī)藥企業(yè)已在逐步開展患者傾聽活動,但醫(yī)藥產(chǎn)品監(jiān)管過程尚未將患者聲音納入醫(yī)藥產(chǎn)品的審評審批中,監(jiān)管機構(gòu)尚未開展患者聲音傾聽與信息轉(zhuǎn)換利用活動,醫(yī)藥產(chǎn)品監(jiān)管結(jié)構(gòu)還未落實患者聲音傾聽活動。我國應逐步收集特定疾病的患者聲音,以便于臨床試驗受試者招募與新藥開發(fā)工作。如監(jiān)管機構(gòu)聯(lián)合制藥企業(yè)、患者組織共同召開患者訪談會、進行患者滿意度或需求調(diào)查等,實現(xiàn)信息共享。同時,鑒于我國地廣、人多、方言多,患者聲音收集過程可能存在自然壁壘,可通過引入現(xiàn)代技術(shù)手段,如人工智能語義分析、移動設備云端存儲等方式收集并整理患者聲音。其次,我國應建立一套完善的患者聲音收集體系。在收集患者表面聲音的同時,引導患者表達以深挖患者內(nèi)在需求,這與聲音收集形式、詢問患者方式、特定疾病負擔均有關(guān)系。因此,我國應構(gòu)建一套完整的患者聲音傾聽方法學體系。
第二,我國應深度傾聽患者聲音。目前我國患者聲音主要聚焦于就醫(yī)體驗方面,難以獲得患者對于治療方案、用藥方式改善等方面的需求信息。“以患者為中心”的醫(yī)療服務提供理念逐步受到重視,主要為引進信息技術(shù),促進患者就醫(yī)信息交流以減少患者候診時間等。對此,本文提出以下建議:首先,高效轉(zhuǎn)化現(xiàn)有信息。通過有效傾聽患者聲音以將其轉(zhuǎn)化為對新藥研發(fā)、臨床試驗、藥品監(jiān)管等方面有用的信息,從需求側(cè)為藥品研發(fā)方向、臨床試驗終點指標選取、藥品上市審評審批評價要素等方面提供思路。其次,全面深挖潛在信息。對患者聲音的再傾聽可定位患者潛在需求,識別患者對疾病治療方案的看法與偏好,使醫(yī)藥產(chǎn)品的風險——收益評估更合理,且更具現(xiàn)實意義。同時,患者聲音并不總是來源于患者本身,由于疾病或生理干預,某些患者可能難以表述需求,因此患者聲音還可能來源于患者家屬、照料者等“患者代言人”。因此,多主體深度傾聽方法的制定與實施也有助于發(fā)現(xiàn)潛在信息。
第三,我國應合理運用患者聲音。鑒于我國目前還未有全面的患者聲音數(shù)據(jù)庫,其聲音應用也相對薄弱、單一,除特定疾病(如血友病等罕見病)患者組織外,我國并未將傾聽患者聲音全面運用至臨床試驗方案制定、新藥研究開發(fā)、治療方案開發(fā)與完善等活動。具體建議如下:藥品監(jiān)管機構(gòu)可定位患者需求并通過宏觀調(diào)控滿足最緊迫需求;對患者進行監(jiān)管培訓,并將其納入特定疾病的審評審批中;參與全球患者聲音傾聽活動,共享患者需求信息。醫(yī)療機構(gòu)可探索與患者的有效交流方式;識別特定疾病異質(zhì)人口學特征;收集疾病演變進展趨勢等信息。制藥企業(yè)可確定未來研發(fā)投入方向;通過滿足患者需求實現(xiàn)更大市場份額;優(yōu)化臨床試驗受試者與終點指標的選取效果。目前,我國某些制藥企業(yè)已關(guān)注患者聲音,并將其運用至藥品開發(fā)與臨床試驗階段,但醫(yī)藥產(chǎn)品監(jiān)管機構(gòu)尚未將患者聲音運用于新藥開發(fā)鼓勵、醫(yī)藥產(chǎn)品監(jiān)管審評審批過程,對于現(xiàn)有醫(yī)藥產(chǎn)品或治療方案的后續(xù)追蹤活動的開展也較少。因此,我國監(jiān)管機構(gòu)應逐步考慮患者聲音以提升我國醫(yī)療水平與患者全方位體驗。

