干燥方法對印度塊菌(Tuber indicum)品質的影響
馬 寧,仲 磊,,趙立艷,鄭惠華,3,胡秋輝
(1.南京財經大學食品科學與工程學院,農業農村部食用菌加工重點實驗室,江蘇南京 210023;2.南京農業大學食品科學技術學院,江蘇南京 210095;3.江蘇安惠生物科技有限公司,江蘇南通 226009)
印度塊菌(TuberindicumCooke & Massee,T.indicum)是與樹木共生的藥食兩用真菌,主要分布在我國的四川和云南兩省,是我國分布最廣、產量最大的塊菌品種[1]。20世紀90年代以來,塊菌作為我國野生食用菌最主要的貿易品種出口到歐洲市場[2]。由于印度塊菌的營養豐富、香氣獨特,具有抗病毒、抗菌保肝、抗突變和抗炎等多種生物活性,受到了越來越多的美食和科學研究的關注[3-6]。但是印度塊菌屬于典型的地下外生菌根真菌,其特殊的生長環境造就了成熟塊菌子囊果含有復雜而大量的微生物,未經處理的新鮮印度塊菌平均保質期為10~15 d,儲運過程極易失去其營養價值和商品價值[7]。所以解決好印度塊菌的采后深加工問題,延長其運輸和貯藏期,是我國塊菌產業化發展的必由之路。
脫水干燥是一種有效延長食用菌貨架期的處理手段,已經廣泛應用于香菇[8]、草菇[9]、牛肝菌[10]、杏鮑菇[11]等食用菌脫水加工中。但在干燥過程中,不可避免發生營養物質的損失和食品結構的變形。因此,選擇合適干燥方法對提高食用菌干制品質量至關重要。目前,自然曬干、熱風干燥和真空冷凍干燥是印度塊菌最常用的干燥方法[12-13]。由于不同干燥方法的干燥特性不同,對食品的質構、營養成分等指標的影響存在顯著差異。自然晾干加工時間長,且產品質量差。熱風干燥可以顯著降低干制品品質下降風險,并促進特殊風味的生成,是延長采后食用菌貨架期最常用的加工方法之一[14]。但熱風干燥會引起產品營養和風味的損失,復水性能下降等問題,影響產品品質[15]。真空冷凍干燥是近年來食用菌干燥方法之一,由于干燥溫度低且沒有液態水,而生物活性化合物對熱降解高度敏感,因此可以較好保持干燥產品生物活性[16-17]。李亞歡等[13]比較熱風干燥、真空干燥和真空冷凍干燥對銀耳質構品質和相關理化指標的影響,證明真空冷凍干燥的銀耳質構和營養成分最佳,其次是真空干燥,熱風干燥的銀耳品質最差。Wu等[18]發現干燥方法對白玉蕈非揮發性風味物質有影響。但是目前針對印度塊菌干燥加工方法研究極少,針對不同干燥方法對印度塊菌營養成分、復水能力、質地、微觀結構影響進行系統研究及方法優劣的比較也未見報道。
本研究對比熱風干燥和真空冷凍干燥對印度塊菌營養保留、色澤、質構、復水比和復水速率的影響,并比較兩種干燥過程對印度塊菌內部水分的遷移及微觀結構影響,以確定適宜印度塊菌加工的干燥方法,為提高印度塊菌干制品加工品質提供參考。
1 材料與方法
1.1 材料與儀器
新鮮印度塊菌 昆明當地市場,在4 ℃冰箱冷藏;鹽酸、硫酸銅、亞甲藍、酒石酸鉀鈉、氫氧化鈉、乙酸鋅、冰乙酸、亞鐵氰化鉀、硫酸鉀、硼酸、乙醇、氯化鋁、乙酸、乙酸鈉 均為分析純,蘆丁北京索萊寶科技有限公司.
12 L真空冷凍干燥機 美國Labconco公司;101-3A電熱鼓風干燥機 上海蘇進儀器設備有限公司;GYX515便攜式色差儀 上海嘉標測試儀器有限公司;TA XT2i質構儀 英國SMS公司;Hitachi TM3000微觀掃描電鏡 日本日立公司;NMI20-analyst型核磁共振分析儀 蘇州(上海)紐邁電子科技有限公司。
1.2 實驗方法
1.2.1 干燥方法 挑選形狀規則無損傷的新鮮樣品,在流水中清洗印度塊菌表面的泥土,切成5 mm厚薄片,然后單層平鋪裝盤采用不同的方法干燥至水分達到5%(干重)以下,采用烘箱干燥法進行樣品水分含量測定。裝入密封袋后放入干燥器皿中保存備用。熱風干燥:新鮮印度塊菌片均勻單層放在電動鼓風干燥箱,60 ℃。真空冷凍干燥:新鮮印度塊菌片在-24±2 ℃凍結24 h后,凍干,加熱板溫度40 ℃,真空壓力100 Pa,冷阱溫度-83±1 ℃。
1.2.2 色澤的測定 通過GYX515(便攜式色差儀)對干燥樣品色澤進行測定。印度塊菌表面帶有白色的大理石花紋,所以在測定時,不選擇樣品白色花紋部分,選擇顏色統一的深色部分表面5個點分別進行記錄,每組實驗重復5次,結果通過L*(亮度/暗度)、a*(紅度/綠度)、b*(藍度/黃度)表示。
1.2.3 質構的測定 使用TA XT2i質構儀,采用Laguna等[19]方法對印度塊菌干片的質構特性進行測定,其中測試參數為:觸發力5 g,前速度和測試速度為1 mm/s,后速度為10 mm/s。在測試過程中,其中硬度(g)為樣品破碎時上支架所需的最大的力,脆性(mm)為樣品達到破碎點時上支架所移動的距離,距離越小表示樣品脆性越大。每組試驗重復測定8次。
1.2.4 復水特性的測定 復水比(RR)采用Doymaz等[20]的方法進行測定,稱取干燥后的印度塊菌樣品,在70 ℃的恒溫條件下復水,分別在2、5、10 min后,抽真空30 s,稱重。每組試驗重復3次。復水比的計算公式如下:
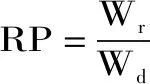
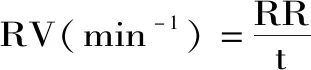
式中:Wr:樣品復水后的質量(g);Wd:為樣品復水前質量(g);t:復水時間(min)。

表1 不同干燥方法對印度塊菌色澤和質構的影響
1.2.5 總蛋白、維生素C、還原糖及總黃酮的測定 總蛋白含量用凱氏定氮法進行測定;維生素C使用南京建成生物工程研究所生產的維生素C試劑盒測定;還原糖的測定依照菲林試劑法(GB/T 5009.7-2016)進行測量;總黃酮含量用三氯化鋁比色法進行測定。所有營養成分測定結果用mg/g表示。每組試驗重復3次。
1.2.6 礦物質含量的測定
1.2.7 低場核磁共振測定 低場核磁共振可用于研究干燥對樣品中水分子運動性和分布的影響[21]。采用低場核磁共振儀測量干燥過程中印度塊菌水分狀態的變化。將大約1 g的印度塊菌放置于15 mm的核磁共振檢測管中,采用Carr-Purcell-Meiboom-Gill(CPMG)方法計算質子橫向弛豫時間,檢測參數:測量溫度32 ℃,主頻(SF)19 MHz,譜寬(SW)200 kHz,等待時間(TW)4000 ms,掃描次數(NS)4,90°(P1)13 μs,180°(P2)24 μs,延時時間(RFD)0.500 ms,模擬增幅(RG1)20 db,數字增幅(DRG1)3。
1.2.8 超微結構的測定 采用掃描電鏡(Hitachi TM3000)觀察樣品超微結構。首先制備鮮樣干片:新鮮的印度塊菌切片置于含3%戊二醛,4 ℃,12 h。用0.1 mol/L磷酸鹽緩沖液(pH7.2)洗三次,再用四氧化鋨(1 g/100 g水)的磷酸鹽緩沖液固定,然后用30%、50%、70%、90%和100%的乙醇梯度洗脫,每次15 min,真空冷凍干燥,待用。再將鮮樣干片及兩種干燥處理的印度塊菌片用刀片將其切成約5 mm×5 mm×1 mm印度塊菌片,取其正面和橫截面分別進行離子濺射噴金,對印度塊菌片表面和橫截面于放大500倍和1000倍觀察。
1.3 數據處理與分析
實驗數據用ANOVA程序進行方差分析,當P<0.05時平均值間有顯著性差異,最小顯著差異法(LSD)用于數據多重比較分析。試驗結果用平均值±標準差的形式表示。
2 結果與分析
2.1 不同干燥方法對印度塊菌色澤和質構的影響
色澤是衡量干燥產品品質的重要參數,2種干燥處理的印度塊菌色澤和質構如表1所示。從表1可以看出,熱風干燥與冷凍干燥印度塊菌片的色澤存在顯著差異(P<0.05)。熱風干燥樣品,a*、b*顯著高于冷凍干燥樣品(P<0.05),L*顯著低于冷凍干燥樣品(P<0.05),說明熱風干燥樣品更紅、更黃且更暗。與冷凍干燥比,熱風干燥過程溫度高,且氧氣充足,更容易發生美拉德褐變反應,產品呈現更暗、更黃且更紅的趨勢,這與Gulsah等[22]得出了相似的結論。冷凍干燥過程氧氣含量低且溫度低,抑制了美拉德反應,可以更好的維持產品色澤。
質構也是評價干燥加工產品的重要的質量標準[23]。冷凍干燥產品硬度顯著低于熱風干燥產品(P<0.05),脆性顯著高于熱風干燥產品。這與Huang等[24]冷凍干燥的草莓干硬度小、脆性高的結論是一致的。這是因為在整個冷凍干燥過程中保持了多孔結構,細胞結構變化小,收縮程度低。熱風干燥樣品硬度高,可能與熱風干燥過程中樣品內部出現嚴重收縮和結構塌陷有關。
2.2 不同干燥方法對印度塊菌復水特性影響
圖1是不同干燥方法對印度塊菌干制品的復水比和復水速率的影響。復水能力是評價干制品的重要指標,由圖1可以看出,復水2、5、10 min后,冷凍干燥產品的復水比及復水速率顯著高于熱風干燥(P<0.05);并且隨著復水時間的延長,復水速率降低[25]。干燥10 min后,冷凍干燥復水比為3.00,顯著高于熱風干燥的2.26(P<0.05),冷凍干燥復水速率0.30 min-1顯著高于熱風干燥0.22 min-1(P<0.05)。干燥處理使印度塊菌內部發生皺縮,干燥后產品孔隙大小差異影響復水比及復水速率。冷凍干燥過程冰晶形成時對鮮印度塊菌內部結構造成一定程度的破壞,所以空隙比新鮮樣品大,升華干燥階段,冰晶直接升華擴散排出,保持了多孔結構,所以冷凍干燥復水比及復水速率更高。熱風干燥時,物料會失水發生收縮,并黏在一起,失水越多,造成產品表面皺縮越嚴重,且內部結構發生塌陷,所以降低干制品的復水能力。

圖1 不同干燥方法對印度塊菌復水比和復水速率的影響
2.3 不同干燥方法對印度塊菌營養成分的影響
表2是新鮮印度塊菌與不同干燥方法的印度塊菌片營養成分分析結果。與新鮮樣品比,熱風干燥和冷凍干燥處理后印度塊菌的總蛋白含量無顯著差異(P>0.05),維生素C、還原糖和總黃酮含量顯著降低(P<0.05)。鮮印度塊菌的還原糖含量為9.01±1.09 mg/g DW,經干燥處理后,還原糖含量顯著降低(P<0.05)。熱風干燥樣品及冷凍干燥樣品的還原糖保留率分別為19.76%和33.85%,熱風干燥樣品的還原糖損失比冷凍干燥樣品更多。熱風干燥溫度高,干燥過程發生美拉德反應及局部焦糖化等反應程度比冷凍干燥更嚴重,導致還原糖損失高于冷凍干燥。維生素C含量是優化脫水產品加工條件的重要指標。未處理鮮印度塊菌維生素C含量為4.22±0.16 mg/g DW,冷凍干燥樣品維生素C保留率比熱風干燥高17.30%。可能是由于冷凍干燥過程中溫度低及真空環境,而熱干燥過程中,印度塊菌發生了多次理化變化,導致維生素C含量顯著下降(P<0.05)。鮮印度塊菌的總黃酮含量為19.21±0.38 mg/g DW,經過干燥處理后,總黃酮含量顯著降低(P<0.05)。熱風干燥樣品的總黃酮的損失率為43.94%,冷凍干燥后總黃酮損失率為20.09%,熱風干燥總黃酮含量顯著低于真空冷凍干燥樣品(P<0.05),其原因可能是干燥過程中黃酮類化合物的流失受干燥溫度和時間的影響。冷凍干燥對印度塊菌營養成分保留優于熱風干燥,這與Raga等[26]的研究結論一致。

表2 不同干燥方法對印度塊菌片總蛋白、維生素C、還原糖及總黃酮含量(mg/g干重)的影響
2.4 不同干燥方法對印度塊菌水分流動和分布的影響
水分子的遷移和分配與干燥產品質量密切相關[27]。通過低場核磁中橫向弛豫時間(T2)可以反映干燥過程中樣品水分遷移以及水分分布的變化[28]。圖2是熱風干燥與真空冷凍干燥過程中樣品T2弛豫時間的變化。根據橫向弛豫時間的大小,可以將橫向弛豫時間分為T21、T22、T23,分別代表結合水、半結合水和自由水[29-30]。其中,新鮮樣品中T22與T23的水分占了總含量97%~98%,所以干燥過程中水分狀態變化主要發生在結合水和半結合水。可以從圖2中看出,干燥處理會導致印度塊菌弛豫時間縮短,這是因為隨著干燥進行,水分減少,從而造成弛豫時間變短。同時T23中水分的信號強度隨著干燥過程的進行而減少,這可能與干燥過程中自由水水分流失以及與干燥過程樣品脫水收縮有關。
與熱風干燥組相比,冷凍干燥處理對印度塊菌的弛豫時間和水分狀態影響的差異明顯。從圖2可以看出,冷凍干燥組T23水分信號強度衰減速率高于熱風干燥組,說明印度塊菌的冷凍干燥效率高于熱風干燥。
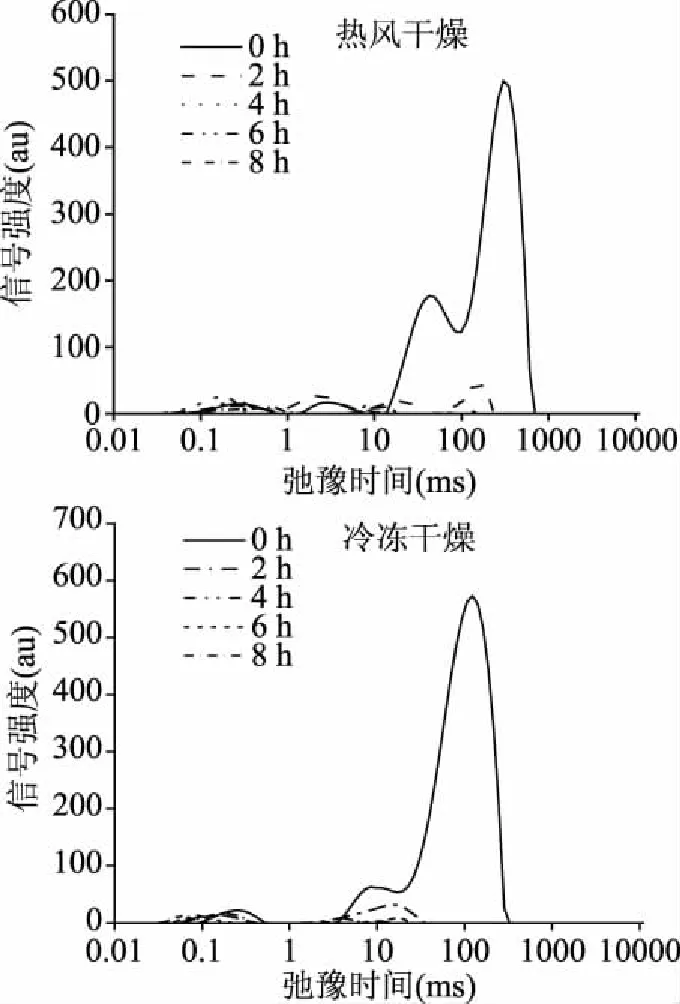
圖2 不同干燥方法處理印度塊菌低場核磁圖譜
2.5 不同干燥方法對印度塊菌微觀結構的影響
為了研究不同干燥方法對印度塊菌微觀結構帶來的變化,對新鮮印度塊菌、熱風干燥和冷凍干燥處理后的樣品內部結構進行了掃描電鏡觀察,如圖3所示。比較3個樣品的微觀結構,發現其內部構造的差異顯著。新鮮印度塊菌(圖3a、d)內部組織結構飽滿,冷凍干燥樣品(圖3c、f)相較于新鮮印度塊菌呈多孔、蜂窩狀外觀,說明冷凍干燥可以更好保持多孔細胞結構。而熱風干燥樣品(圖3b、c)比冷凍干燥有更多的細胞組織收縮和塌陷且結構很致密。冷凍干燥過程,內部組織保持較好并出現較大的空隙,這也是冷凍干燥產品具有硬度小、脆性高,并具有最高復水比及復水速率的主要原因。而熱風干燥過程水分蒸發較快,且外表面溫度高,造成表面硬化,這與熱風干燥樣品硬度高,脆性小且復水比小的結論相一致[25]。
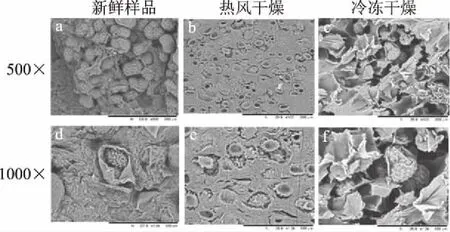
圖3 新鮮印度塊菌及不同干燥方法 處理印度塊菌片微觀結構掃描圖
3 結論
研究發現,兩種方法干燥印度塊菌片在色澤、復水比、質構和微觀結構均有明顯差異。與冷凍干燥比,熱風干燥組產品顏色更暗,復水比和復水速率低,硬度高且脆度低,微觀組織結構破壞嚴重,皺縮坍塌,質構特性較差。熱風干燥產品維生素C、還原糖、總黃酮保留量顯著低于冷凍干燥產品(P<0.05)。綜合分析,冷凍干燥可加工出外觀好、營養保留量高的印度塊菌干品,是適合印度塊菌脫水加工的干燥方式。

