大豆不溶性膳食纖維對高脂飲食誘導小鼠肥胖的預防作用
王賽男,于寒松,谷春梅,賀 陽,張 田,徐錫奇
(吉林農業大學食品科學與工程學院,吉林長春 130118)
隨著人們生活節奏加快和膳食結構改變,長期高脂飲食(HFD)會引發肥胖癥等一系列慢性疾病[1-2]。目前,肥胖癥發病率和死亡率在全球范圍內飛速增長,已成為備受關注的公共健康問題[3-4]。肥胖人群多選擇節食和藥物治療來減肥,但常伴有嚴重的副作用。研究證明攝入來自全谷物、蔬菜和水果的膳食纖維(Dietary fiber,DF)可以降低肥胖癥的患病風險[5-6]。因此,調整膳食結構,攝入DF是預防肥胖的安全舉措之一。中國是大豆的主要生產國和最大消費國,每年生產約2000萬噸豆渣[7-8]。然而,豆渣通常作為飼料或直接拋棄,造成了嚴重的資源浪費和環境問題[9]。豆渣中DF的含量可占豆渣干物質的50%~60%,其中不溶性膳食纖維(Insoluble dietary fiber,IDF)占DF總量的90%以上,是IDF較好的來源[10-11]。
研究認為脂質代謝紊亂是引發肥胖的原因,而脂質代謝過程受到眾多信號通路調控,包括脂肪酸、甘油三酯(TG)合成及脂肪酸氧化等[12]。其中二酰甘油酰基轉移酶1(DGAT1)、二酰甘油酰基轉移酶2(DGAT2)、硬脂酰輔酶A去飽和酶1(SCD1)是甘油三酯合成關鍵酶[13]。此外,過氧化物酶體增殖物激活受體α(PPARα)在肝臟中高度表達,主要是通過增強其靶基因肉堿棕櫚酰轉移酶1a(CPT1a)的表達,促進脂肪酸β氧化,在代謝調節中起重要作用[14-15]。隨著對DF參與機體糖脂代謝研究的不斷深入,發現DF可以通過調節糖原合成、減少糖異生、調控脂質合成和分解代謝等途徑來緩解糖脂代謝紊亂[16-17]。其中可溶性膳食纖維(Soluble dietary fiber,SDF)的健康益處已被廣泛研究和應用[18-19],而IDF更多地被認為僅對促進腸道蠕動有益[20]。目前,關于IDF參與宿主脂質代謝的作用機制方面報道較少,張春霞等[21]發現山楂IDF可以參與脂質代謝調節過程,改善機體血脂水平,但并未進行機理研究。Chang等[22]研究了梨果渣中IDF的抗肥胖作用,但其主要分析IDF對機體腸道菌群的變化,并未深入探究IDF參與脂質代謝的作用機制。此外,Kim等[23]研究發現在肥胖小鼠日常飲食中添加豆渣,可以通過上調肝臟中PPARα表達水平,下調FAS表達水平來緩解肥胖,但沒有對豆渣中的IDF提取物進行相關研究。
綜上所述,雖然已有報道證實豆渣的IDF具有調節血脂的功效,但對豆渣的IDF提取物調節血脂及其機制的研究還未見報道,且前期研究發現豆渣DF可通過調節脂質合成代謝相關基因表達水平達到緩解機體肥胖的效果,因此本文以大豆不溶性膳食纖維(SIDF)為研究對象,探究其對HFD誘導小鼠肥胖的預防作用及其在基因水平上的作用機制,為SIDF作為功能成分預防肥胖提供更深入的理論依據,同時提高豆渣的附加值和綜合利用。
1 材料與方法
1.1 材料與儀器
大豆不溶性膳食纖維(純度>90.5%) 實驗室自制;總膽固醇(T-CHO)測試盒、甘油三酯(TG)測試盒、高密度脂蛋白膽固醇(HDL-C)測試盒、低密度脂蛋白膽固醇(LDL-C)測試盒、葡萄糖(GLU)測定試劑盒 南京建成生物工程研究所;小鼠胰島素(INS)酶聯免疫分析試劑盒 上海泛柯實業有限公司;6周齡C57BL/6J雄性小鼠 50只,平均體重18~22 g,購于北京華阜康生物科技股份有限公司,許可證號:SCXK(京)2014-0004;基礎飼料、高脂飼料 北京科澳協力飼料有限公司。
CPA-125電子天平 德國Sartorius公司;葉拓101系列鼓風干燥箱 上海葉拓儀器儀表有限公司;KL04-A離心機 美國Agilent公司;HBS-1096B酶標儀 美國Molecular Devices公司;Toptical196梯度熒光定量PCR儀 德國耶拿分析儀器股份有限公司;F013030045手持式勻漿器 美國Dremel公司。
1.2 實驗方法
1.2.1 動物分組及飼養 雄性C57BL/6J小鼠適應性飼養7 d后隨機分為5組:正常飲食對照組(ND)、高脂飲食對照組(HFD)、不溶性膳食纖維低(LSIDF)、中(MSIDF)、高劑量組(HSIDF),每組10只小鼠,每籠飼養5只。由于SIDF具有良好的吸水性和膨脹性,其灌胃劑量依據Ma等[24]和石彥囯等[25]的報道,稍作修改。ND組和HFD組灌胃生理鹽水,SIDF低、中、高劑量組灌胃劑量分別為250 mg/kg、500 mg/kg、1 g/kg BW/d。各組的飼料配比如表1,除ND組飼喂基礎飼料外,其余各組飼喂高脂飼料[26]。持續飼喂20周,攝食量及小鼠體重分別每天及每周進行監測記錄。動物實驗末期,將所有小鼠隔夜禁食12 h,眼球采血,3500 r/min 15 min離心后取上清備用。取肝臟、腹部脂肪、附睪脂肪及腎周脂肪,稱重后-80 ℃條件儲存。
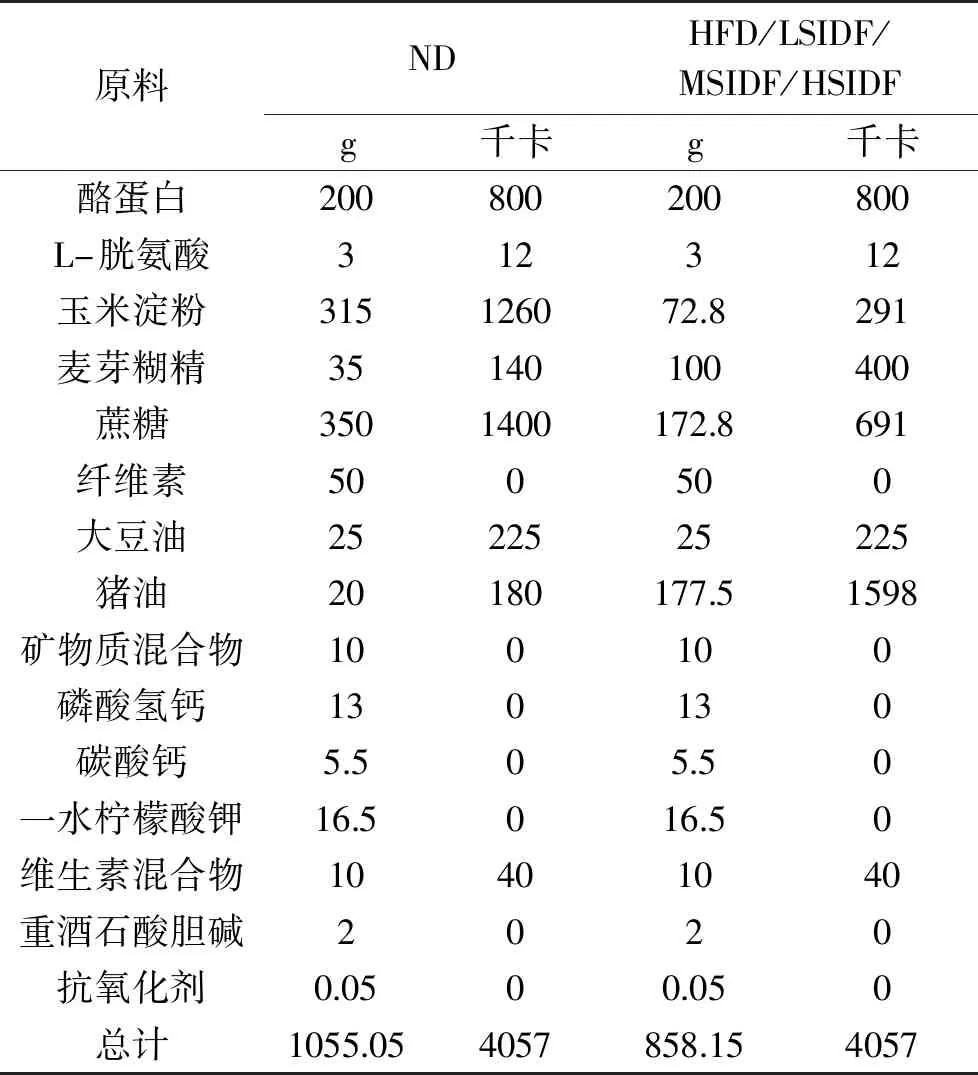
表1 飼料的組成
1.2.2 體重和攝食量 實驗過程中每周定時分別對各組小鼠進行稱重并記錄,精確到0.1 g。每次投放適量的食物,投放前對飼料進行稱重,隔天稱余下飼料的重量(各組小鼠籠盒中的大塊殘渣稱量記錄,殘渣碎屑忽略不計),計算每日食物攝入量。
1.2.3 血清中脂類指標的測定 取各組小鼠血清,測定各組小鼠血清中總膽固醇(TC)、TG,高密度脂蛋白膽固醇(High density lipoprotein cholesterol,HDL-C)和低密度脂蛋白脂蛋白(Low density lipoprotein cholesterol,LDL-C)的含量。
1.2.3.1 TC含量測定 選用96孔板操作,分別設置空白孔、標準孔和各組樣本孔,向空白孔中加入2.5 μL蒸餾水,標準孔中加入2.5 μL校準品,樣本孔中加入2.5 μL血清,各個操作孔中均加入250 μL工作液,混勻,37 ℃孵育10 min,波長510 nm處用酶標儀測定各孔吸光值。TC含量按式(1)計算。
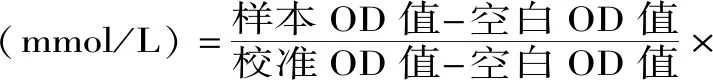
式(1)
1.2.3.2 TG含量測定 參照1.2.3.1中操作步驟,TG含量按式(2)計算。
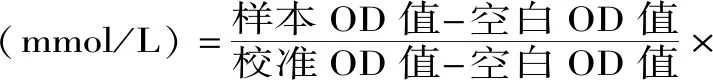
式(2)
1.2.3.3 HDL-C含量測定 選用96孔板操作,分別設置空白孔、標準孔和各組樣本孔,向空白孔中加入2.5 μL蒸餾水,標準孔中加入2.5 μL校準品,樣本孔中加入2.5 μL血清,各個操作孔中均加入180 μL R1溶液,混勻,37 ℃孵育10 min,波長546 nm處用酶標儀測定各孔吸光值A1。向各個操作孔中加入60 μL R2溶液,混勻,37 ℃孵育5 min,波長546 nm處用酶標儀測定各孔吸光值A2。HDL-C含量按式(3)計算。
HDL-C含量(mmol/L)=[(樣本A2-樣本A1)-(空白A2-空白A1)]/[(標準A2-標準A1)-(空白A2-空白A1)]×校準品濃度(mmol/L)
式(3)
1.2.3.4 LDL-C含量測定 參照1.2.3.3中操作步驟,LDL-C含量按式(4)計算。
LDL-C含量(mmol/L)=[(樣本A2-樣本A1)-(空白A2-空白A1)]/[(標準A2-標準A1)-(空白A2-空白A1)]×校準品濃度(mmol/L)
式(4)
1.2.4 肝臟中脂類指標的測定 準確稱取各組小鼠肝臟組織100 mg,置于5 mL離心管中,按重量(g)∶體積(mL)=1∶9的比例,加入0.9 mL無水乙醇,冰水浴條件下機械勻漿,2500 r/min,離心10 min,取上清液測定各組小鼠肝臟中TC和TG含量,具體實驗步驟參照1.2.3.1和1.2.3.2進行。
1.2.5 肝臟指數和脂肪系數的測定 分離出各組小鼠的肝臟、腹部脂肪、附睪脂肪和腎周脂肪組織,用生理鹽水清洗,濾紙吸干水分,稱量并記錄,肝臟指數按式(5)計算,脂肪系數按式(6)計算。

式(5)

式(6)
1.2.6 HE染色 將各組小鼠肝臟(約100 mg)浸于4%的多聚甲醛固定液中,常規石蠟包埋,石蠟切片,將石蠟切片進行蘇木素-伊紅(HE)染色。光學顯微鏡下從低倍到高倍依次觀察肝臟組織病理變化。
1.2.7 肝臟脂肪合成代謝相關基因表達的測定
1.2.7.1 肝臟組織中總RNA的提取及反轉錄 實驗方法根據劉清清[27]方法略有改動。采用Trizol法提取各組小鼠肝臟組織中總RNA,稱取肝臟組織50 mg,置于無RNA酶離心管內,加1 mL Trizol試劑,勻漿后每管加200 μL預冷的三氯甲烷,振蕩20 s,冰浴靜置15 min,4 ℃ 12000×g離心15 min,小心移取400 μL RNA上清液至離心管中,向每管加入等體積異丙醇沉淀RNA,室溫靜置10 min,4 ℃ 12000×g離心10 min,留取沉淀即為RNA,用75%乙醇洗滌,靜置5 min,4 ℃ 8000×g離心5 min,留取沉淀用無RNA酶水溶解并測定其濃度。根據測得濃度進行反轉錄制得cDNA于-20 ℃儲存備用。
1.2.7.2 實時熒光定量PCR 將1.2.7.1所得的cDNA取2 μL于PCR管中,分別加入SYBR Green I染料12.5 μL,上下游引物各1 μL以及蒸餾水8.5 μL進行PCR 擴增。各基因引物的上下游序列見表2。
1.3 數據處理
2 結果與分析
2.1 大豆不溶性膳食纖維對小鼠體重和攝食量的影響
如圖1(a)所示,SIDF干預期間,HFD組小鼠體重增加比ND組更快。補充SIDF 12周后,與HFD組相比,SIDF組小鼠體重增加開始逐漸減緩。SIDF干預20周時,與HFD組(38.56±1.15 g)相比,LSIDF、MSIDF、HSIDF組小鼠體重分別降低至(32.87±1.32)、(31.69±1.01)、(29.10±1.12) g(P<0.001),HSIDF組體重降低最為顯著。如圖1(b)所示,與ND組相比,HFD組攝食量顯著減少(P<0.05),但該組能量攝入較高。此外,SIDF干預組攝食量相對于HFD組有所減少(P>0.05)。結果表明,SIDF可控制小鼠體重增長,這是由于SIDF具有良好的吸水性和持水性,可以增加機體飽腹感,從而降低小鼠攝食量,進而達到抑制或減緩小鼠體重增長的效果。此結果與汪平權等[9]關于豆渣對小鼠體重控制作用研究結果表現一致,說明SIDF發揮主要作用。由此可見,長期攝入SIDF能有效減緩HFD引起的機體體重增加,對預防肥胖具有積極作用。
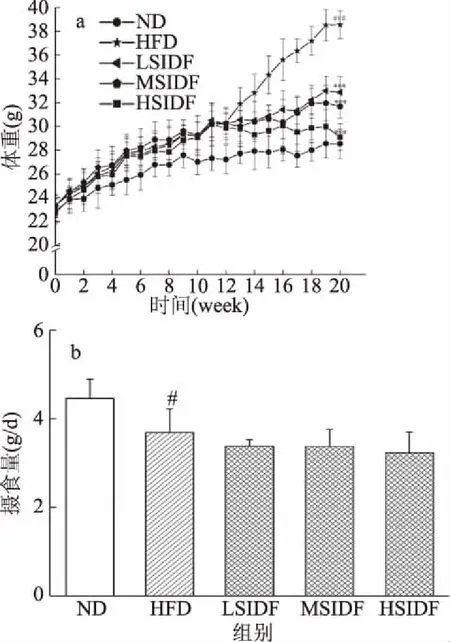
圖1 SIDF對HFD誘導小鼠體重和攝食量的影響

表2 實時熒光定量聚合酶鏈式反應的引物序列
2.2 大豆不溶性膳食纖維對小鼠血脂水平的調節作用
SIDF干預20周后,小鼠血清脂質水平如圖2所示,與ND組相比,HFD組血清中TC、TG和LDL-C水平顯著升高,分別升高10.32%(P<0.05)、13.61%(P<0.01)、60.55%(P<0.001),HDL-C水平顯著降低 21.98%(P<0.01)。由此可見,長期HFD會導致血脂代謝紊亂。與HFD組相比,LSIDF、MSIDF和HSIDF組小鼠血脂水平得到改善,TC水平分別顯著降低8.97%(P<0.05)、15.11%(P<0.001)、11.19%(P<0.01),TG水平分別顯著降低9.11%(P<0.01)、22.11%(P<0.001)、26.22%(P<0.001),LDL-C含量顯著降低25.72%、31.42%、36.76%(P<0.001),HDL-C含量顯著升高28.15%、25.35%、39.49%(P<0.001)。實驗結果說明SIDF對HFD引起的血脂水平升高起到拮抗作用,其中SIDF組TC、TG、LDL-C水平下降,HDL-C水平升高。王康樂等[28]指出當肝臟脂質代謝紊亂時,其血脂指標一般表現為TC、TG、LDL-C水平升高,HDL-C水平降低。由此可見,SIDF可通過調節血脂水平來改善肝臟脂質代謝紊亂。其中,血清TG水平降低與SIDF可以結合脂肪,直接阻礙脂肪的吸收有關。此外,SIDF可抑制腸道內TC的吸收,阻礙膽汁酸重吸收進入肝腸循環,導致膽汁酸和TC排出,同時HDL受體活性增強,可轉運血液中更多的TC轉移至肝臟分解代謝,因此導致血清中TC、LDL-C的含量降低,HDL-C含量升高從而實現調節脂質代謝的作用[29-30]。
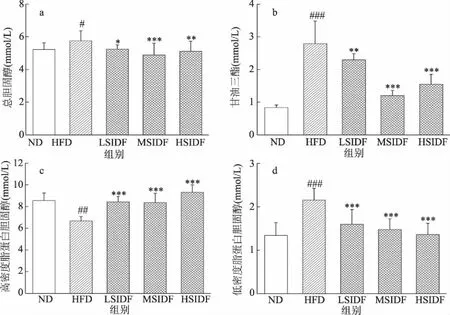
圖2 SIDF對HFD誘導小鼠血清血脂水平的影響
2.3 大豆不溶性膳食纖維對小鼠肝臟脂質水平的調節作用
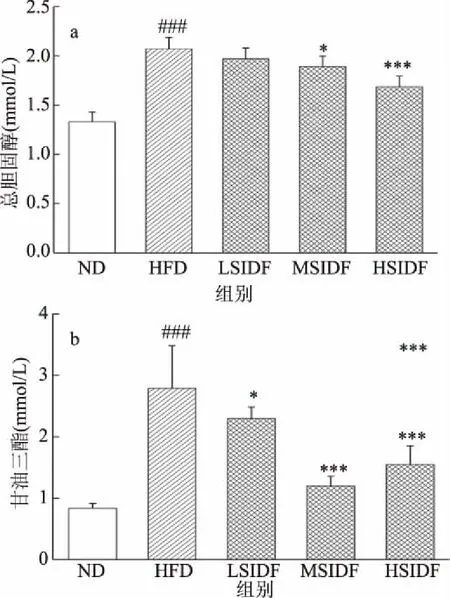
圖3 SIDF對HFD誘導小鼠肝臟脂質水平的影響
小鼠肝臟脂質水平如圖3所示,與ND組相比,HFD組小鼠肝臟TC水平顯著升高55.65%(P<0.001),TG水平升高至ND組的2.34倍(P<0.001)。與HFD組相比,LSIDF、MSIDF和HSIDF組小鼠肝臟中TC水平分別降低4.95%(P>0.05)、8.67%(P<0.05)、18.61%(P<0.001),TG水平分別降低17.75%(P<0.05)、56.97%(P<0.001)、44.5%(P<0.001),其中MSIDF和HSIDF組效果優于LSIDF組。實驗結果表明SIDF可有效調節小鼠肝臟脂質水平,降低TC、TG含量,由于SIDF可以促進TC和膽汁酸的排泄,進而加快肝臟中TC轉化為膽汁酸,因此間接導致肝臟TC、TG水平降低。報道已證實胡蘿卜和藜麥中IDF均可促進TC和膽汁酸排出,進而有效降低肝臟TC、TG水平[31-32]。因此攝入SIDF對HFD引起的肝臟脂質代謝紊亂具有調節作用,可有效降低肝臟中TC、TG水平。
2.4 大豆不溶性膳食纖維對小鼠肝臟指數和脂肪系數的影響
由圖4可知,與ND組(35.99±3.36 mg/g)相比,HFD組(32.49±2.33 mg/g)肝臟指數顯著降低(P<0.01),這與小鼠長期高脂飲食有關。與HFD組相比,LSIDF、MSIDF、HSIDF組肝臟指數分別為(28.88±2.02)、(29.63±4.07)、(29.27±2.89) mg/g(P<0.05),可能是由于攝入SIDF減少了肝臟脂肪堆積。由表3可知,與ND組相比,HFD組小鼠脂肪系數顯著升高(P<0.01),這與其體內白色脂肪堆積有關。
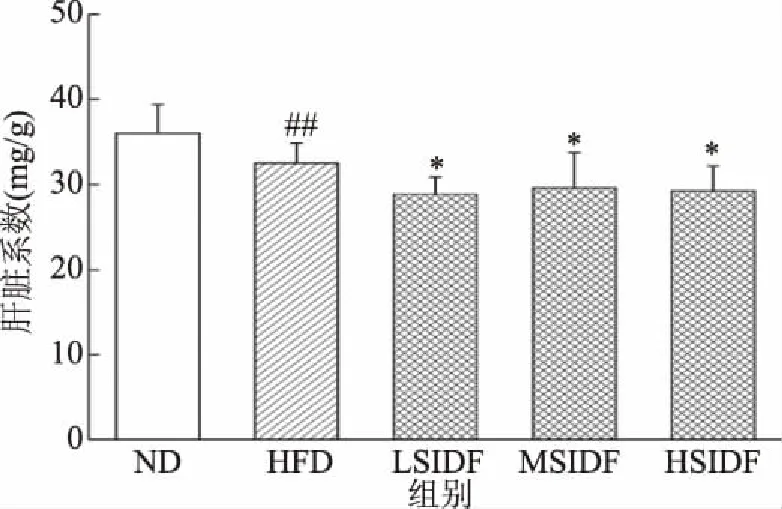
圖4 SIDF對HFD誘導小鼠肝臟指數的影響
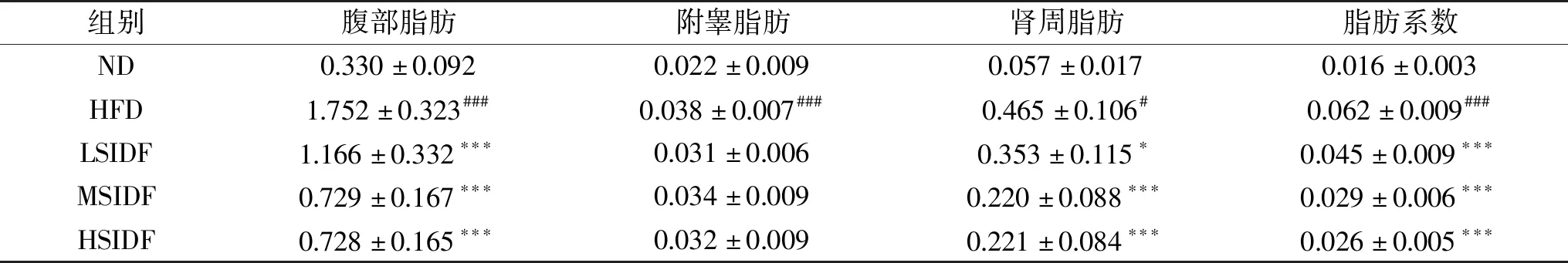
表3 SIDF對HFD誘導小鼠脂肪系數的影響
喬青蓮[33]認為肥胖主要是由于脂肪組織的過度堆積造成的。與HFD組相比,SIDF組脂肪系數顯著降低(P<0.001),且HSIDF組優于LSIDF和MSIDF組,存在劑量關系。此外,SIDF組腹部和腎周脂肪重量顯著減少(P<0.05)。實驗結果表明,攝入SIDF可降低小鼠肝臟指數和脂肪系數,且其脂肪系數與SIDF攝入量呈負相關。白色脂肪組織的積累還會誘發肝臟脂質代謝異常、胰島素抵抗、高血脂等代謝綜合征的重要原因[34]。因此攝入SIDF可通過減少體內白色脂肪積累,降低肝臟脂質變性的風險,進而達到預防或緩解肥胖的目的。
2.5 肝臟組織病理學分析
由圖5可知,與ND組相比,HFD組的肝臟組織中脂肪空泡明顯,有大量脂滴聚集,存在細胞腫脹和核消失的現象,說明長期HFD會導致肝臟組織脂肪變性,有明顯病變的特征。SIDF組相比于HFD組,其肝臟組織中存在少數脂滴,細胞腫脹和核消失的現象有所緩解,且隨著SIDF攝入量增加,改善效果越好,說明攝入SIDF能后減少肝臟脂滴聚集,減少肝臟脂肪變性的風險。
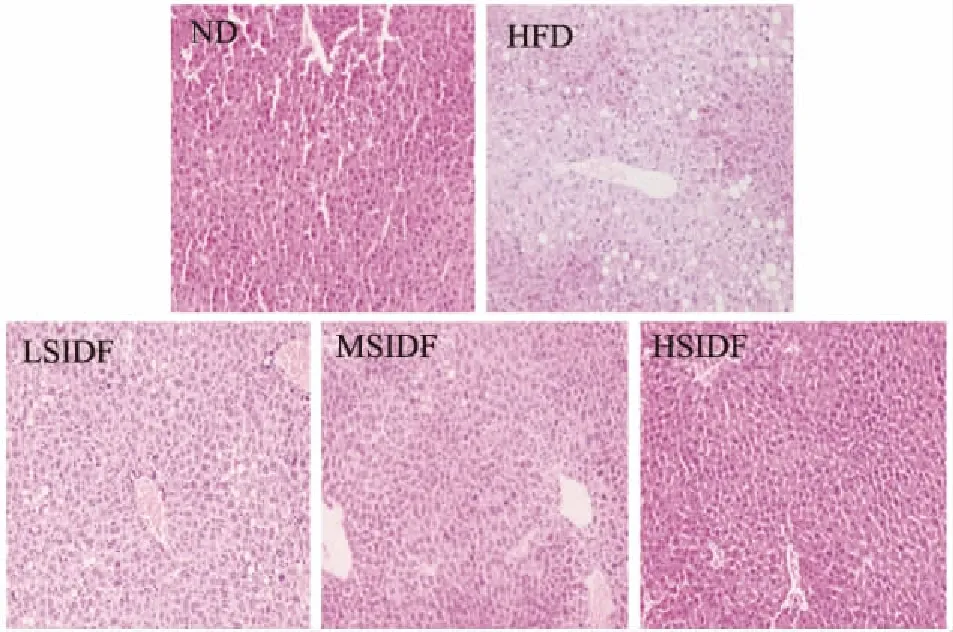
圖5 SIDF對小鼠肝臟病理學形態的影響(200×)
2.6 大豆不溶性膳食纖維對肝臟脂肪合成代謝相關基因表達的影響
SIDF干預20周后,小鼠肝臟甘油三酯合成相關基因表達水平如圖6(a)所示,DGAT1,DGAT2和SCD1是甘油三酯合成過程中的關鍵酶,與ND組相比,HFD組小鼠肝臟中DGAT1,DGAT2和SCD1 mRNA表達水平顯著升高(P<0.01)。與HFD組相比,LSIDF和MSIDF組對DGAT1,SCD1 mRNA表達水平無顯著影響(P>0.05)。HSIDF組可顯著下調DGAT1,SCD1 mRNA表達水平,分別下調0.66倍、0.45倍(P<0.01)。SIDF干預組DGAT2 mRNA表達水平顯著下調0.58、0.40、0.66倍,HSIDF組效果優于LSIDF和MSIDF組,說明長期攝入SIDF可降低甘油三酯合成速率。
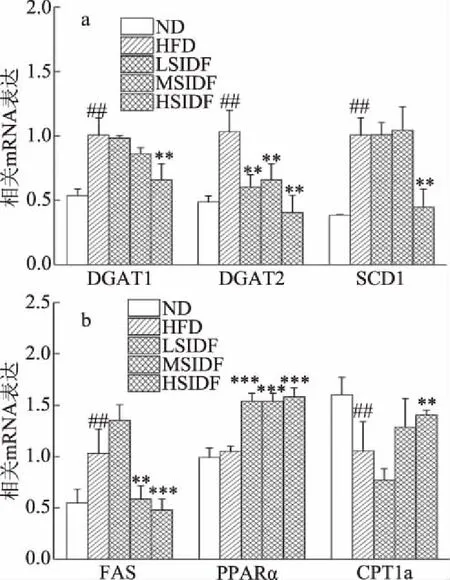
圖6 SIDF對HFD誘導小鼠肝臟脂質合成代謝相關基因表達水平的影響
小鼠肝臟脂肪酸合成分解相關基因表達水平如圖6(b),與ND組相比,HFD組FAS mRNA表達水平顯著上調(P<0.01),但長期干預后,MSIDF和HSIDF組FAS mRNA表達水平顯著下調0.59倍(P<0.01)、0.48倍(P<0.001)。與ND組相比,HFD組中CPT1a mRNA表達水平得到顯著抑制(P<0.01)。在干預 20 w后,FAS、CPT1a mRNA表達以劑量依賴性方式恢復至正常水平且差異顯著(P<0.05)。FAS、PPARα、CPT1a等被認為是脂肪酸合成及β氧化過程中具有代表性的關鍵酶[26,35]。
由此可見,IDFS可以上調脂質合成相關基因表達水平,同時下調脂肪酸β氧化相關基因表達水平。Kim等[23]研究發現在肥胖小鼠日常飲食中添加豆渣,可以通過上調肝臟中PPARαmRNA表達水平,下調FAS mRNA表達水平來緩解肥胖。通過本項研究認為這可能主要歸因于SIDF。由此可見,SIDF可以作為功能成分,通過減少脂質合成,加快脂質分解來達到預防肥胖的目的。
3 結論
實驗結果表明低、中、高劑量的SIDF均能減緩由HFD引起的體重增長,降低食物攝入量,并呈劑量依賴趨勢。經長期干預可以有效降低小鼠血清和肝臟脂質水平,還有助于減少體內白色脂肪積累,且與SIDF攝入量呈正相關。HSIDF組通過下調DGAT1、DGAT2、SCD1及FAS mRNA表達水平來降低脂質合成速率,同時上調PPARα和CPT1a mRNA表達水平來加速脂肪酸β氧化,促進脂質分解,可有效調節肝臟脂質水平。以上結果說明SIDF可以在基因水平上調節肝臟脂質代謝過程,為SIDF預防肥胖提供了更深入的理論依據,同時提高大豆的附加值和綜合利用。但仍存在許多不足,需進一步探討SIDF抑制HFD誘導肥胖的信號通路及分子調節機制。

