紅棗多糖提取、分離純化及生物活性研究進展
冀曉龍,尹明松,侯春彥,劉延奇,*
(1.鄭州輕工業大學食品與生物工程學院,河南鄭州 450001;2.河南省冷鏈食品質量安全控制重點實驗室,河南鄭州 450001;3.食品生產與安全河南省協同創新中心,河南鄭州 450001)
紅棗(Jujube),又名中華大棗,是鼠李科(Rhamnaceae)棗屬(ZizyphusjujubaMill.)植物棗樹的果實[1-2]。棗樹在我國已有四千多年的種植栽培歷史,主要分布在西北地區、黃河流域沿岸地區和東部地區[3-4]。我國紅棗的栽培面積及產量均居世界第一,同樣也是世界唯一的紅棗出口國,因此我國在開發紅棗及深加工產品方面具有獨特的優勢[1,5]。紅棗營養十分豐富,《本草綱目》記載紅棗具有補虛益氣、養血安神、健脾和胃等多種保健功能,被國家衛健委列為藥食同源食品[6-7]。紅棗中含有許多十分重要的生物活性成分,如:VC、多酚、黃酮、多糖、環核苷酸等[1,8-9]。近些年來,對紅棗的研究主要集中在多酚、黃酮、環磷酸腺苷等方面,隨著糖化學和糖生物學技術的快速發展,紅棗多糖也逐漸進入國內外學者的研究視野中,有相關研究表明紅棗多糖具有抗氧化、免疫調節、抗腫瘤、抗衰老、保肝、抗潰瘍、調節腸道菌群等多種功能活性[3,10-12]。植物多糖的生物活性與其結構特征密切相關,多糖的單糖組成情況、糖苷鍵類型與鏈接方式、空間構型等都影響其活性[13-15];對紅棗多糖結構的化學研究是其作為功能性食品應用的基礎條件[16-17]。本文基于對紅棗多糖各方面的研究成果為基礎,并結合最新研究動態,就紅棗多糖的提取、分離純化、理化性質及結構特征、生物活性等方面的研究進展進行綜述,以期為紅棗多糖構效關系提供理論依據;為進一步開發利用紅棗多糖提高其在食品和醫藥領域的應用提供參考。

表1 紅棗多糖的提取方法及評價
1 紅棗多糖的提取、分離純化
1.1 紅棗多糖提取
提取紅棗多糖前需對原料進行預處理,即洗凈紅棗、去核、脫水干燥(冷凍干燥)、粉碎、過篩得紅棗粉[3,18-19]。紅棗的品種、料液比、提取溫度、時間、溶劑、pH、提取次數等提取條件以及不同提取方法等因素對提取紅棗多糖的得率、結構及活性都有一定的影響[3-4]。紅棗多糖的提取方法有很多,主要包括溶劑浸提法(水浸提法、稀堿浸提法)、酶水解法、超聲波輔助提取法、微波輔助提取法、超高壓輔助提取法、亞臨界輔助提取法等,主要相關方法比較與評價見表1[20-31]。在實際生產與實驗室提取多糖中常采用兩種或更多的方法聯合使用,如上述涉及的酶法協同超聲波熱水浸提法,一般聯合使用會比單獨提取效率更高[32-33]。
1.2 分離純化
采用上述不同方法提取的紅棗粗多糖,常含有蛋白質、色素、小分子物質等雜質,這不僅影響紅棗多糖的質量與純度,還影響下一步純化、結構分析、高級結構表征及構象關系的研究[3,34-35]。除去紅棗粗多糖里雜蛋白常采用三氯乙酸法和Sevag法,Sevag法是植物多糖脫蛋白中最為常用的方法,具有成本低、檢測速度快,但也存在多糖損失量大、多糖活性被部分破壞等缺點[36-37]。有時制得的紅棗粗多糖干燥后顏色較深,需要進行脫色處理,采用離子交換樹脂法(DEAE纖維素吸附法、大孔吸附樹脂AB-8)和雙氧水法[38-40]。H2O2氧化法脫色效果好,但高濃度處理會破壞多糖的分子結構并影響其生物活性。
為進一步研究紅棗多糖的單糖組成、平均分子量、糖苷鍵類型、高級結構特征等,還需在提取紅棗粗多糖的基礎上對其做進一步分離純化[3,41]。常用的分離純化方法主要有離子交換樹脂法和凝膠過濾柱色譜。對于純化制備大量的紅棗多糖,報道最多的是利用DEAE-52、DEAE Sepharose CL-6B、DEAE-Sepharose Fast Flow纖維素離子交換柱層析和Sepharose CL-4B/6B、Sephadex G-200、Sephacryl S-300葡聚糖凝膠柱層析兩種層析方法(表2)[42-51]。Li等[42-43]采用水提醇沉獲得金絲小棗粗多糖,經超濾和DEAE-Sepharose CL-6B色譜柱分離、Sepharose CL-6B凝膠柱洗脫、Sephadex G-200進一步純化獲得單一組分金絲小棗組分ZSP3c。Ji等[48-51]采用超聲輔助熱水浸提木棗以提取多糖,經過DEAE-Sepharose Fast Flow分離、Sephacryl S-300純化得到均一的三種木棗多糖組分。
2 紅棗多糖的理化性質及結構特征
大多數植物多糖具有分子量大、空間結構復雜、生物化學活性不活躍等特點,因而研究難度比多酚類、黃酮類等化合物要大[52-53]。現在對植物多糖的結構特征主要研究集中在其一級結構特點,包括單糖組成、平均分子量、糖苷鍵連接方式、以及主鏈的基本構型等[54-56]。化學結構決定其功能活性,探究植物多糖的結構對研究其生物活性及潛在的構效關系十分重要[57-59]。由于原料來源、提取工藝、純化方法、分析方法的差異,植物多糖的研究結果也有所不同,如多糖的平均分子量、單糖組成均存在一定的差異[60-61]。
2.1 理化特性
紅棗多糖為淡黃色粉末,易溶于水,難溶于乙醇、丙酮、正丁醇等有機試劑[12]。研究表明,純化的紅棗多糖碘-碘化鉀實驗呈陰性(說明不含淀粉)和Molish反應為陽性(說明具備多糖一般性質)、紫外光譜檢測(260、280 nm處無檢測吸收峰)說明不含蛋白質和核酸,紅外光譜可檢測到紅棗多糖的特征吸收峰[16,48-51]。
2.2 平均分子量
植物多糖的理化特性與其平均分子量有很大關系[62-63]。要測定植物多糖的分子量,首要就是對其純度的鑒定[64]。目前,在紅棗多糖純度鑒別與平均分子量測定研究中普遍使用高效液相凝膠色譜法(HPGPC)[3,65]。Wang等[45]測得木棗多糖HJP1、HJP3的分子量分別是 6.762×104和2.936×104Da。Rostami等[23]對來自伊朗東部的紅棗進行分離純化得到兩種多糖組分JCP-1和JCP-2,其分子量大小分別為1.5×105和9.1×104Da。在紅棗多糖平均分子量的測定中,紅棗多糖的品種、提取工藝、測定方法的不同對紅棗多糖分子量的測定都有影響,紅棗多糖平均分子量大致范圍在104~106Da[3,16]。
2.3 單糖組成
分析植物多糖的單糖組成是研究其結構與生物活性的必要基礎前提。目前,研究紅棗多糖單糖組成的方法主要有氣相色譜法(GC)和液相色譜法(HPLC)[66-67]。Zhao等[68]首次對來自河北地區的冬棗果實、葉、花提取多糖并進行單糖分析,發現提取的三種多糖均含有不同摩爾比的鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和糖醛酸(半乳糖醛酸和葡萄糖醛酸)。Cui等[20]采用氣相分析對新疆大棗提取的酸性多糖(RQP1d、RQP2d)進行單糖組成分析,研究發現兩種紅棗多糖均由鼠李糖、阿拉伯糖、木糖、半乳糖、葡萄糖、甘露糖組成,其中PQP1d單糖摩爾比為9.76∶23.44∶18.77∶31.15∶2.07∶4.39,PQP2d單糖摩爾比為3.17∶32.78∶35.72∶7.82∶5.50∶0.35。Ji等[48]對木棗多糖進行純化并采用氣相方法進行分析,發現三種木棗多糖由不同比例的鼠李糖、半乳糖、半乳糖醛酸組成。就紅棗多糖的單糖組成和比例已報道的文獻結果雖不盡一致,但研究結果總體表明紅棗多糖主要由不同摩爾比的鼠李糖、阿拉伯糖、半乳糖、半乳糖醛酸構成,這主要是紅棗品種不同、提取工藝、純化方法、檢測手段不同等因素可影響紅棗多糖單糖組成的結果[3]。
2.4 化學結構
除對紅棗多糖的單糖組成和平均分子量研究之外,關于紅棗多糖的結構也逐漸被研究者所關注(表2);主要采用甲基化分析、高碘酸氧化、Smith降解、GC-MS、核磁共振技術(NMR)確定植物多糖的單糖殘基類型和糖苷鍵連接主要位點[48-51]。木棗多糖組分HJP3經部分酸水解,Smith降解和甲基化反應、近紅外光譜,NMR一維圖譜解析,研究結果表明HJP3主要由(1→2)-Rhap(11%),(1→5)-Araf(11.7%),(1→3,5)-Araf(14.8%),(1→4)-Galp(13.5%)和(1→4)-GalpA(15.1%)組成。理化研究表明HJP3是包含I型鼠李半乳糖醛酸結構域的典型果膠結構[45]。
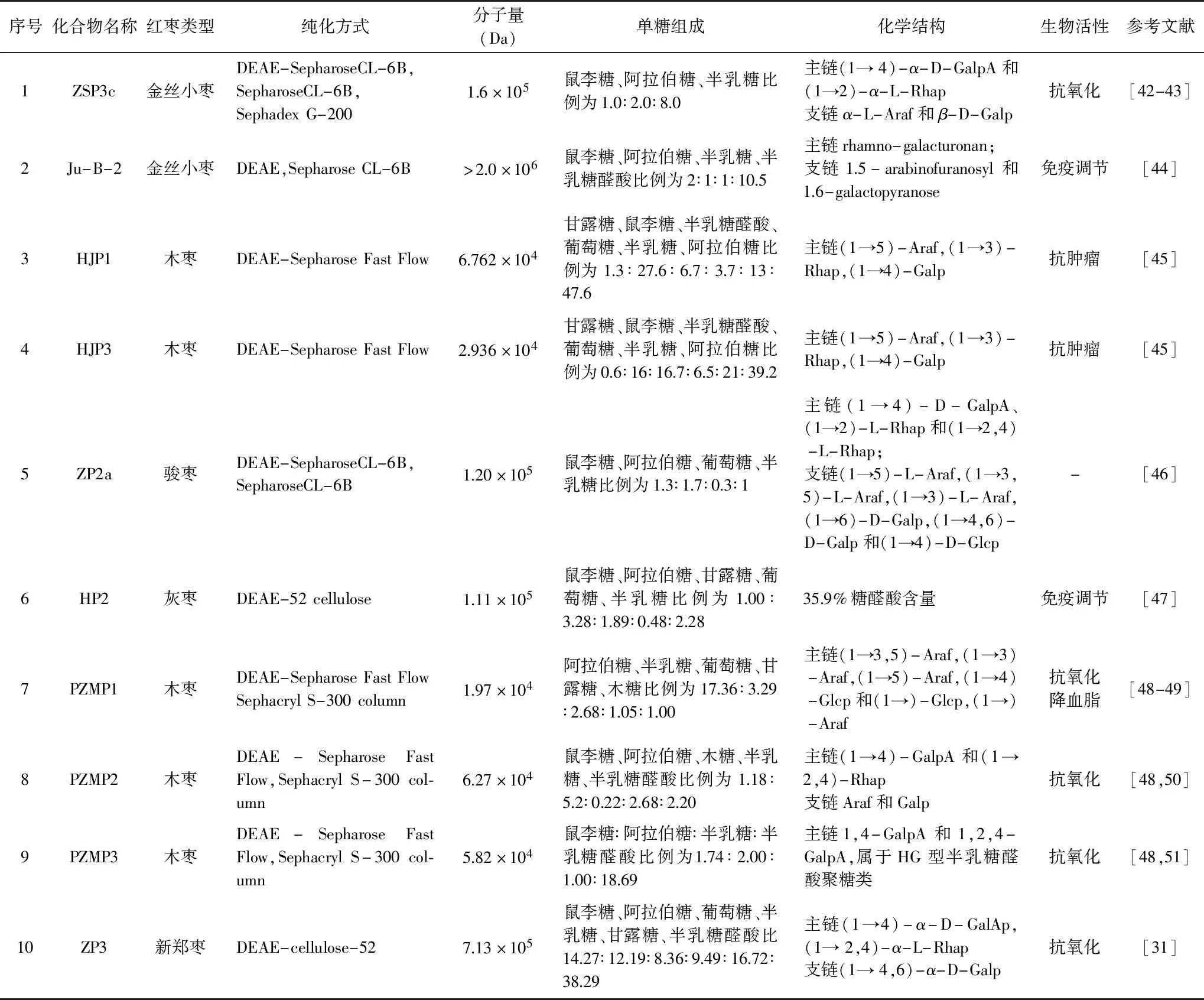
表2 紅棗多糖理化特性、化學結構與藥理活性
冬棗多糖經化學分析和多種儀器檢測之后,發現其結構主要由含有(1→5)-和(1→3,5)-Araf 殘基的阿拉伯糖殘基,含有(1→4)-和(1→2,4)-Galp 殘基的半乳糖殘基和含有(1→2)-和(1→2,4)-Rhap殘基組成,且具有較強的免疫活性[20]。駿棗多糖經氣相分析、甲基化分析、核磁分析和液相色譜-電噴霧質譜分析,發現其主鏈主要為1,4-D-GalpA重復單元[69]。
陜北木棗多糖經理化分析及氣相分析、近紅外分析、甲基化分析、核磁技術解析結構,研究結果表明PZMP1主鏈主要以1,3,5-Araf和1,5-Araf連接方式構成,1,4-Galp可能在主鏈存在[49]。PZMP2主鏈由半乳糖醛酸通過1,4-GalpA與鼠李糖通過1,2,4-Rhap相連接構成,屬于I型鼠李糖半乳糖醛酸聚糖類[50]。PZMP3主鏈由半乳糖醛酸通過1,4-GalpA和1,2,4-GalpA相連接構成,屬于HG型半乳糖醛酸聚糖類[51]。
2.5 高級結構特征
植物多糖對應的高級結構特征主要是由植物多糖在較為稀釋溶液中的分子不同參數所確定的,同時也可利用現有的先進的顯微技術直接進行掃描觀察[70-71]。現有關于紅棗多糖高級結構特征主要涉及其潛在的分子形貌特征,所涉及的儀器主要有X-射線衍射法、差示掃描量熱法、原子力顯微鏡、原子力顯微鏡[73]。Cui等[20]研究來自新疆大棗多糖的掃描電鏡結構,表明紅棗多糖組分RQP1d和RQP2d的表面相似,并出現粗深皺紋。Rostami等[23]研究紅棗多糖的乳化活性和乳化穩定性。研究結果顯示,在水包油型乳液模型中,1.5% JCP-1具有較高的乳化穩定性(95.5%)和具有較低的表面張力(44.1 mN/m)并形成小的液滴尺寸(1.32 μm)。木棗多糖溶液為非牛頓假塑性流體,表現出剪切變稀的特性;在頻率掃描的范圍內,儲能模量(G′)始終大于損耗模量(G″),表明木棗多糖在實際生產中更適合于做穩定劑[72]。X-衍射發現,中性木棗多糖僅含有1個彌散峰,而酸性糖可含有3~4個彌散峰;掃描電鏡結果顯示中性糖表面最為光滑,酸性糖呈現特殊結構性狀;原子力顯微鏡發現木棗多糖各組分在溶液中均并沒有完全的延展,這可能由于紅棗多糖分子量大小、酸性糖含量及分子結構特性對其微觀形態特征具有重要的影響所導致的[48]。
3 紅棗多糖的生物活性
目前關于植物多糖功能活性的研究主要集中在兩個方面:一方面是作為非特異治療劑,作用于相類似的對應分子,調節各種生理功能或糾正病理過程,目前研究較多;另一方面則是作為信息分子進入機體發揮補充調節或抑制的作用,目前研究相對較少[32,57]。多糖是紅棗中最主要的有效成分之一,具有多種藥理活性,主要有抗氧化、保肝、抗癌、抗炎、增強免疫力、調節腸道菌群等功效[73]。
3.1 抗氧化作用
越來越多的研究表明在生物體中由自由基(ROS)導致的氧化損傷是許多慢性疾病如心臟病、腫瘤等重要的誘因[74-76]。植物中的天然活性成分是一種非常有效的抗氧化劑來源,尤其是多糖,具有明顯的抗氧化活性[77-78]。Wang等[79]通過實驗研究證實陜北的灘棗多糖(ZSP)具有DPPH自由基、羥基自由基、超氧陰離子自由基的清除作用,且具有一定的抗氧化活性,隨著多糖濃度升高抗氧化能力也逐步提高;當ZSP濃度為200 μg/mL時,DPPH自由基清除作用達到79.2%,羥基自由基的清除能力為50.6%。Li等[42-43]發現提取的金絲小棗多糖(ZSP3c和ZSP4b)具有相似的單糖組成,但在清除自由基方面ZSP3c有直接的較強的體外抗氧化能力,這可能與金絲小棗多糖基本的理化性質和結構特征有直接關系。Ji等[48]發現提取的木棗多糖(PZMP1、PZMP2、PZMP3),分別測定其對DPPH自由基、羥自由基的清除能力及Fe2+螯合能力,結果表明三個純化多糖組分均表現出與濃度正相關的體外抗氧化活性,其中以PZPM3的體外抗氧化活性最強;這可能是單糖組成和結構活性區域的不同造成的。
3.2 免疫調節作用
天然植物多糖最重要的生物活性就是免疫調節功效,植物多糖可通過多種途徑與免疫細胞表面的多種受體相結合、激活不同的相關信號通路來調控動物機體的免疫系統[80-82]。Zhan等[69]研究駿棗多糖(ZJP)對RAW264.7巨噬細胞發揮抗炎免疫作用,ZJP可顯著抑制NO的產生,降低COX-2、TNF-α、IFN-γ和IL-17等促炎細胞因子的表達。分子水平研究分析表明,ZJP能抑制信號蛋白p38和JNK的磷酸化,揭示ZJP發揮抗炎免疫作用是通過抑制NF-κB和p38/JNK MAPK信號轉導通路來實現的。Chi等[83]研究了冬棗多糖(JPC)在慢性疲勞綜合癥(CFS)大鼠模型上的免疫調節活性;JPC能促進T淋巴細胞增殖,增強機體免疫細胞(NK)活性;JPC處理能增強白細胞介素2(IL-2)的相關基因表達和IL-2蛋白的生產,降低IL-10的產生;JPC可增加CFS大鼠抗氧化的能力并以此增強機體的免疫系統。Zou等[47]提取的灰棗多糖可增加實驗小鼠的脾臟和胸腺指標,促進血清溶血素形成,增強巨噬細胞吞噬活性,發揮免疫作用,抑制小鼠足墊水腫。
3.3 抗腫瘤作用
植物多糖的抗腫瘤活性受其形態、分支程度、分子量大小、水溶性等因素的影響;一般規律來說,分子量較小、水溶性相對較好的植物類多糖具有較強的抗腫瘤活性[84-85]。目前植物多糖發揮其抗腫瘤作用的機制如下:通過口服植物多糖預防腫瘤發生;增強抗腫瘤潛在免疫反應;直接發揮抗腫瘤活性,誘導腫瘤細胞凋亡;預防體內的腫瘤細胞的擴散或轉移[86-88]。為研究紅棗多糖的抗腫瘤作用機制,Wang等[45]從木棗中分離和純化兩個均勻的酸性多糖(HJP1和HJP3),細胞試驗表明HJP3能顯著性地抑制HepG2細胞的增殖,但對非腫瘤細胞株卻不存在細胞毒性,分析可能是紅棗多糖直接發揮抗腫瘤活性,誘導腫瘤細胞凋亡。從若羌棗籽經超聲提取的多糖是由阿拉伯糖、葡萄糖、木糖、半乳糖和鼠李糖組成,對宮頸癌(HeLa)細胞存在濃度依賴性通過誘導凋亡介導的機制抑制其增殖[89]。
3.4 保肝作用
只有部分的研究證實紅棗多糖對肝臟有直接保護作用,還需詳細深入的研究闡明紅棗多糖保肝的具體作用機制。Wang等[79]和Liu等[90]研究表明,黃河流域陜北灘棗多糖(ZSP)可劑量依賴性地抑制四氯化碳誘導的肝損傷;400 mg/kg的ZSP可顯著降低四氯化碳誘導的丙氨酸氨基轉移酶、門冬氨酸氨基轉移酶活性以及血清中乳酸脫氫酶和肝組織中MDA水平,ZSP處理的小鼠表現出較好的肝指數(HI)和較好的抗氧化作用;陜北灘棗多糖可通過清除機體自由基,有效保護CCl4誘導損傷的肝臟。酸棗多糖可通過誘導Nrf2核易位,增加HO-1、GSTA和NQO1在肝損傷小鼠中的蛋白表達;酸棗多糖可通過增強肝組織中Nrf2通路的表達而達到保肝作用[91]。
3.5 調節腸道菌群
現代藥理學研究表明,植物多糖可作為功能性食品來保護胃腸粘膜,調節腸道微生物,預防炎性應激損傷結直腸癌[92-93]。植物多糖可直接或者間接的誘導不同的生長因子產生從而促進組織修復,還可通過抑制胃腸道中性粒細胞/細胞因子,產生直接的抗炎作用;促進腸道有益微生物的增殖,產生短鏈脂肪酸抑制結直腸癌的發生發展[94-96]。在氧化偶氮甲烷(AOM)和葡聚糖硫酸鈉(DSS)造模結腸癌小鼠過程中,紅棗粗多糖通過灌胃處理進行膳食干預,研究發現紅棗多糖處理的小鼠糞便中有益菌種類增加,有害菌比例顯著降低;梭菌屬、雙歧桿菌屬、擬桿菌屬、乳酸菌屬等豐度顯著提高。紅棗多糖膳食干預所導致的差異代謝物,參與三羧酸循環途徑、糖酵解/糖異生途徑,調節腸道菌群,從而抑制結腸癌的發生發展[97-98]。攝入紅棗多糖可有效縮短胃腸轉運時間,增加糞便中水分,減少盲腸和糞便氨含量,增加盲腸中不同濃度的短鏈脂肪酸,同時降低糞便中不同結腸細菌酶的活性,調節結直腸處菌群比例,使有益菌菌群顯著增加[99]。
4 紅棗多糖結構對活性的影響
4.1 紅棗多糖分子量對活性的影響
植物多糖分子量的大小是影響多糖生物活性的重要因素,不同的植物多糖產生生物活性的分子量范圍也是不同的[100-101]。紅棗多糖中大分子量的多糖組分所占比例較大,同時也具有較好的生物活性[3]。Li等[42-43]從金絲小棗中提取得到單糖組成相似、但分子量不同的兩種紅棗多糖組分(ZSP2、ZSP4b),較大分子量ZSP2具有較高的抗氧化活性,這可能分子量較大的金絲小棗多糖更易在水溶液中保持原有的多糖空間構象,更易在體外發揮抗氧化作用。Ji等[48]比較了分子量大于50 kDa的多糖組分(PZMP2、PZMP3)和分子量小于50 kDa的紅棗多糖組分(PZMP1)的體外抗氧化活性,結果顯示分子量大的多糖組分具有更強的羥基自由基和DPPH自由基清除活性;這表明分子量更大的紅棗多糖可能具有更強的體外抗氧化活性。
4.2 紅棗多糖單糖組成對活性的影響
紅棗多糖作為一種雜多糖,主要含有鼠李糖、阿拉伯糖、半乳糖、半乳糖醛酸[3,10,16]。同時,不同的紅棗多糖組分之間所含單糖種類和各單糖比例也存在顯著性的差異,這種差異性可能是與其具有多種生物活性相關[3]。研究表明含有更多糖醛酸(半乳糖醛酸、葡萄糖醛酸)的紅棗多糖組分具有更好的抗氧化活性與免疫活性。Li等[43]曾經報道過金絲小棗中含糖醛酸較高的兩個多糖組分ZSP3c和ZSP4b,在體外含有較強的抗氧化活性。Ji等[43]和Liu等[31]都報道過半乳糖醛酸含量較高的紅棗多糖組分具有較強的體外清除羥基自由基和DPPH自由基的能力。
4.3 紅棗多糖糖苷鍵對活性的影響
紅棗多糖屬于果膠多糖、阿拉伯半乳聚糖、半乳聚糖類,它們同樣影響著多糖的活性[3,102]。植物多糖中含有β-(1→3)糖苷鍵可增加免疫活性細胞的活動而增強其抗腫瘤活性[103];而在紅棗多糖研究中,Wang等[45]發現木棗多糖中含有主鏈(1→5)-Araf和(1→4)-GalpA具有較強的抗腫瘤活性,而Ji等[48]發現紅棗多糖主鏈含阿拉伯糖糖苷鍵、半乳糖醛酸糖苷鍵具有較強的抗氧化活性,不同的研究結果可加深紅棗多糖對其功能活性作用及其機制的基礎認識。
5 結語
近年來,伴隨著國內外相關學者對紅棗多糖研究的日益重視,紅棗多糖的許多生物活性及功能已逐步進入大眾視野,國內學者對紅棗多糖的提取、分離純化、免疫保肝、抗氧化、調節腸道菌群等方面進行相關基礎的研究,同時也取得很大的進展。紅棗多糖作為一種天然活性物質,研究價值極大、市場前景非常的廣闊。但是,就目前的研究成果而言,還存在很多亟待解決的問題。其一,紅棗多糖的結構研究還處在研究其一級結構中單糖的組成、糖基排列順序、糖苷鍵連接方式、糖鏈有無分支、分支的大小與位置的基礎階段,還需深入研究紅棗多糖的空間構象等高級結構表征問題,為揭示紅棗多糖分子結構與功能之間關系奠定基礎。其二,仍需在動物模型、腸道微生物菌群宏基因組學、代謝組學水平上對紅棗多糖的抗氧化、免疫調節、抗腫瘤等活性進行構效關系研究。其三,鑒于紅棗多糖具有的多種生理活性和潛在良好的市場前景,可大力發展其作為新型的功能性食品強化劑和重要的藥物載體原料。

