3種瓣型茉莉基因組大小測定與比較
齊香玉 陳雙雙 馮景 王華娣 鄧衍明

摘要:茉莉具有較高的觀賞、茶用和藥用價值,但關于其基因組學的研究還相對匱乏。以單瓣、雙瓣和多瓣茉莉的嫩葉為材料,選用6種常用的細胞解離液,利用基因組大小已知的水稻(Oryza sativa)日本晴、玉米(Zea mays)B73和番茄(Lycopersicon. Esculentum L. Stupicke polni tyckove rane)為內參,以建立適合于茉莉的流式細胞術基因組大小測定方法。結果表明,WPB細胞解離液對茉莉和內標解離效果最好,粒子清晰集中,無重疊峰且區分度良好;單瓣、雙瓣和多瓣茉莉的基因組1C DNA含量分別為0.809 5、0.804 5、0.592 6 pg;單瓣和雙瓣茉莉間的基因組大小無顯著性差異,但它們與多瓣茉莉的基因組大小有顯著性差異。本研究建立了流式細胞術測定茉莉基因組大小的方法,同時測定了3種瓣型茉莉的基因組大小,為茉莉的基因組學及物種進化研究提供參考。
關鍵詞:茉莉;基因組大小;流式細胞術;細胞解離液
中圖分類號: S685.160.1? 文獻標志碼: A
文章編號:1002-1302(2020)19-0040-05
收稿日期:2019-11-25
基金項目:國家自然科學基金(編號:31772338)。
作者簡介:齊香玉(1986—),女,安徽桐城人,博士,助理研究員,主要從事觀賞植物遺傳育種與分子生物學研究。E-mail:409241891@qq.com。
通信作者:鄧衍明,博士,研究員,主要從事花卉遺傳育種與分子生物學研究。E-mail:nksdym@163.com。
基因組大小(或稱C值)是指一個物種單倍體核的DNA含量,通常用質量(pg)或核苷酸堿基對數目(Mb)表示,1 pg相當于978 Mb[1]。迄今為止,植物DNA C值數據庫(plant DNA C-values database)已有12 273個物種的C值數據,其中包括10 770種被子植物、421種裸子植物、303種蕨類植物、334種苔蘚植物和445種藻類[2]。基因組反映了物種全部和特定的遺傳信息[3]。測定基因組大小可以預估物種的DNA含量,為植物的基因組學及其親緣進化研究提供理論依據。目前,測定基因組大小的方法主要有Feulgen微光密度法[4]、流式細胞術(flow cytometry,FCM)[5]和基因組測序法[6]。FCM具有操作簡單、高效、準確等優點,因而被廣泛應用于不同物種基因組大小的測定,如五節芒[7]、草莓[8]、槭屬植物[9]等,也常被用于物種倍性鑒定,如柴胡[10]、棗[11]、旱柳[12]、荔枝[13]等。
茉莉(Jasminum sambac)別稱茉莉花、茶葉花,屬木犀科(Oleaceae)素馨屬(Jasminum Linn.)常綠直立或攀援狀灌木。茉莉原產于印度及巴基斯坦等地,在1 700多年前的漢代傳入我國,最早在東南沿海地區栽培,然后逐漸北上直到長江流域,是“一路一帶”經濟植物開發與應用的重要成員之一[14]。茉莉具有較高的觀賞、茶用和藥用價值,歷來受到我國人民的喜愛,被譽為“花樹中的珍品” “天下第一香”[15]。茉莉品種較多,但根據花形結構的不同,主要劃分為單瓣、雙瓣和多瓣茉莉3種類型[16]。不同瓣型茉莉在花朵大小和形態、香氣類型和產花量等觀賞和經濟性狀上都存在差異。王湘平等對雙瓣茉莉的染色體數目和核型進行分析發現,染色體數目為2n=2X=26,染色體核型公式為2n=2X=8 m+16 sm+2 sm(SAT),核型為3B類型[17]。然而,關于茉莉基因組大小的研究尚未見報道,有關茉莉分子生物學的研究還相對滯后。隨著測序技術的發展和測序成本的降低,開展茉莉的全基因組測序成為可能。對物種的基因組大小進行預估,能為測序成本預算及組裝策略研究提供重要的理論依據。因此,本試驗擬用流式細胞儀技術對單瓣、雙瓣和多瓣茉莉的基因組大小進行測定分析,旨在為后期開展茉莉的基因組學及種群進化研究提供數據參考。
1 材料與方法
1.1 試驗材料
供試的3種瓣型(單瓣、雙瓣和多瓣)茉莉的嫩葉均采自江蘇省農業科學院茉莉種質資源圃。試驗作為內標的水稻日本晴(Oryza sativa L. subsp. japonica Nippobare)由江蘇省農業科學院糧食作物研究所張亞東研究員提供,玉米(Zea mays)B73由南京農業大學農學院李盛本教授提供,番茄(Lycopersicon? esculentum L. Stupicke polni tyckove rane)由捷克共和國實驗植物學研究所(奧洛摩茨)Jaroslav Dolezel教授提供。
1.2 儀器設備及試劑
試驗使用的儀器是美國Becton-Dickinson(BD)公司的FACSCalibur流式細胞儀。熒光染料碘化丙啶(PI)、孔徑37 μm的尼龍濾膜、鞘液、培養皿、EP管、刀片等購自南京博巧生物科技有限公司。
1.3 試驗方法
1.3.1 細胞解離液的選擇
為獲得適合茉莉的最佳細胞解離液,分別對Otto、Gal、WPB、GPB、LBO1、Tris-MgCl2等多種解離液進行逐一嘗試。
1.3.2 細胞核懸液的制備
取3種瓣型茉莉的新鮮嫩葉,用去離子水洗去表面的灰塵,濾紙吸干后,各稱取3份,每份約0.5 g,分別放入預冷的培養皿中,加入1 mL預冷的細胞解離液,用鋒利的刀片上下快速切碎,過程中保證樣品浸沒在解離液中。吸取培養皿中的解離液,用37 μm濾膜過濾到 1.5 mL 離心管中,然后置于冰上孵育5 min,1 000 r/min 離心5 min,棄去上清液,并將離心管倒置在濾紙上使殘余的液體自然流干,收集沉淀的細胞,再加入 500 μL 預冷解離液。采用同樣的方法獲得水稻、玉米和番茄幼嫩葉片的細胞核懸液。
1.3.3 DNA特異性染色
將單瓣茉莉和雙瓣茉莉細胞核懸液分別與水稻和玉米細胞核懸液混勻,多瓣茉莉分別與水稻和番茄細胞核懸液混勻,獲得混合細胞核懸液。向制備好的混合細胞核懸液中同時加入RNAase A至終濃度為50 μg/mL和碘化丙啶(propidium iodide,PI)染液至終濃度為 100 μg/mL,置于冰上,避光染色20 min。
1.3.4 基因組大小的測定和計算
樣品檢測前,對流式細胞儀進行預熱30 min。采用488 nm的藍光激發,收集670/30通道的熒光,檢測PI的發射熒光強度。每個樣品在檢測時低速收集10000個細胞,變異系數(CV)控制在5%以內,且每個樣品3次重復。使用流式細胞儀自帶的FACSTM軟件100650分析數據,待測樣本核DNA含量計算公式如下:
待測樣本核DNA含量=對照樣本核DNA含量×待測樣本G0/G1峰熒光強度對照樣本G0/G1峰熒光強度。
2 結果與分析
2.1 細胞解離液的選擇
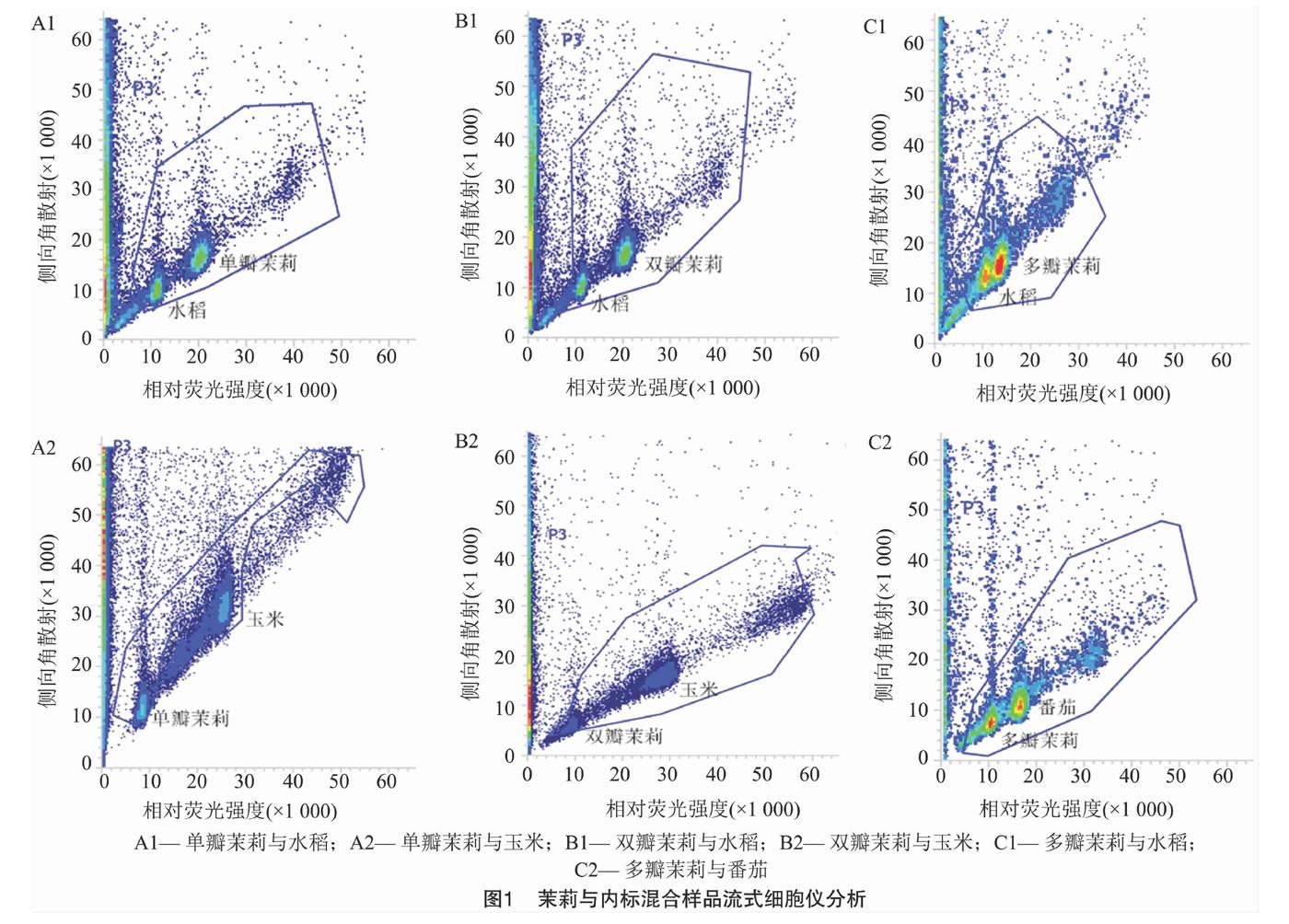
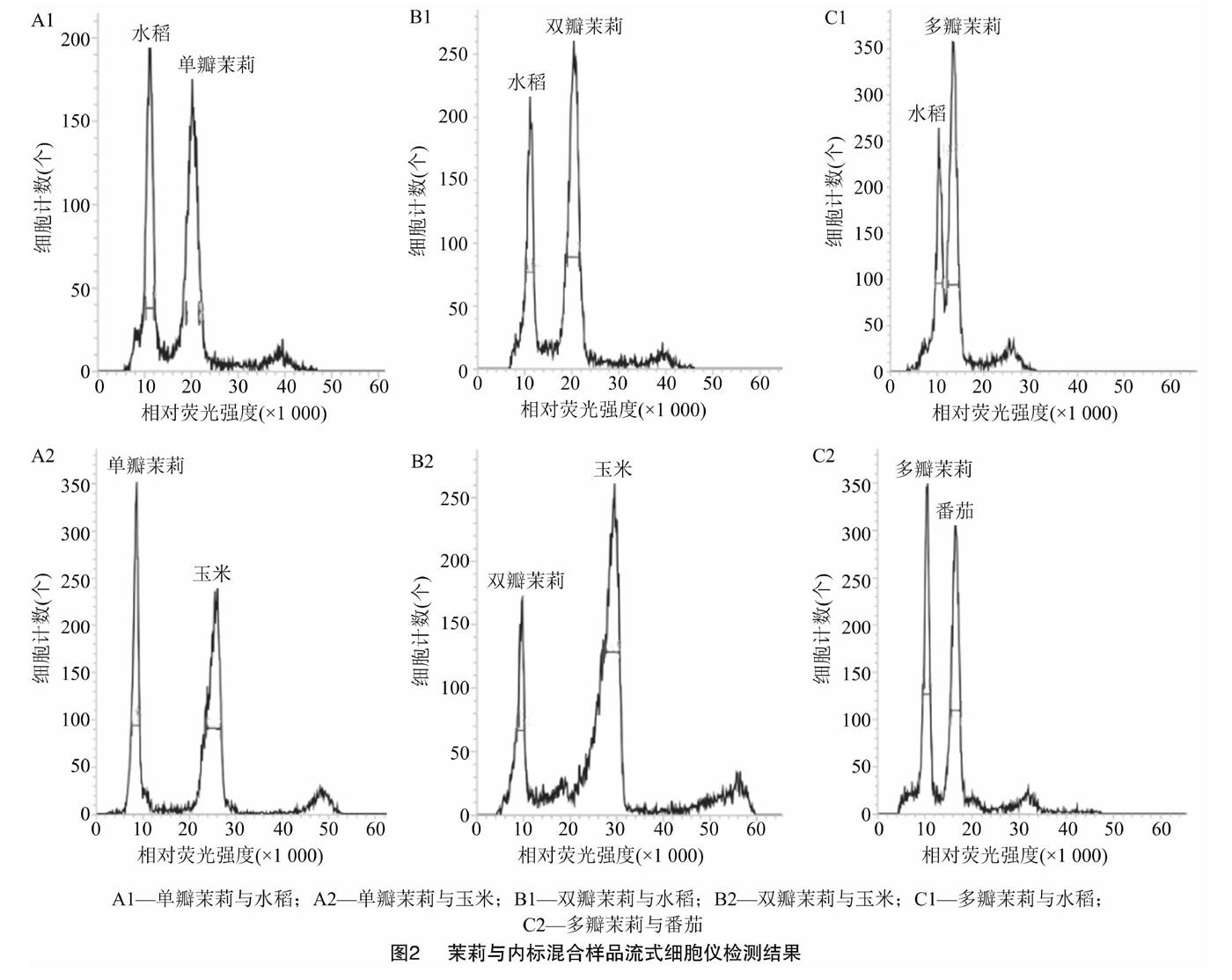
不同裂解液對不同植物的解離效果不同[7,9,11]。為探索茉莉細胞最適合的裂解液,此次研究利用流式細胞儀逐一對6種常用的解離液(Otto、Gal、WPB、GPB、LBO1、Tris-MgCl2)進行比較。最終篩選出WPB解離液,其對茉莉和內標的解離效果最好,變異系數(CV)值控制在5%以內。由圖1可知,茉莉與內標的粒子清晰集中,混合樣品的粒子團能同時被檢測到。由圖2可知,獲得的峰圖清晰,雜峰較少、無重疊峰且區分度良好。因而保證了用基因組大小已知的水稻、玉米和番茄作為內標,測定茉莉基因組大小的合理性及準確性。
2.2 基因組大小的測定結果
PI是一種熒光染料,能夠均勻嵌入到雙鏈DNA的堿基對中,其嵌入量與DNA含量成正比,因此可以用相對熒光強度表示DNA相對含量。比較單瓣、雙瓣、多瓣茉莉及內標的嫩葉單獨制樣上機檢測結果,基于基因組相差倍數盡量小于2倍的原則,確定以水稻日本晴、玉米B73作為內標,分別測定單瓣茉莉(圖2-A1和圖2-A2)和雙瓣茉莉(圖2-B1和圖2-B2)的基因組大小;以水稻日本晴、番茄Stupicke polni tyckove rane作為內標,測定多瓣茉莉(圖2-C1和圖2-C2)的基因組大小。已有研究中,水稻日本晴的2C DNA含量為0.88 pg,玉米B73的2C DNA含量為4.91 pg,番茄Stupicke polni tyckove rane的2C DNA含量為1.96 pg。根據混合樣品的PI發射熒光強度,比較茉莉與內標樣本峰值的倍數關系,3次重復檢測,計算出單瓣茉莉的基因組1C DNA含量為0.809 5 pg,雙瓣茉莉的基因組1C DNA含量為0.804 5 pg,多瓣茉莉的基因組1C DNA含量為0.592 6 pg(表1)。從表1可以看出,同一瓣型茉莉用2個內標檢測,測得的基因組大小無顯著性差異;單瓣茉莉和雙瓣茉莉基因組大小無顯著性差異,但多瓣茉莉與單瓣、雙瓣茉莉基因組大小均有顯著性差異。
3 討論與結論
目前評估基因組大小的方法較多,其中流式細胞術因操作簡單、高效、準確等優點,已成為物種基因組大小測定[7-10]和物種倍性鑒定[11-13]的重要技術方法。茉莉不僅具有較高的觀賞價值,還具有較高的茶用和藥用價值,市場前景廣闊。此前,并沒有茉莉基因組大小的研究。木犀科其他物種基因組大小已有報道,如樊慧杰等利用流式細胞術測定了連翹屬植物連翹的基因組大小為0.74 Gb[18]。Suda等利用流式細胞術測定了濃香茉莉(Jasminum odoratissimum)的基因組大小為1.44 pg[19]。然而,不同物種的基因組大小存在很大差異[3],不同物種的流式細胞術測定條件不同[11-13],所以對于茉莉基因組大小的測定,要對流式細胞術的方法進行探索。
不同植物的葉片結構和次生代謝物組成均不相同,可見材料的選擇、細胞核的提取及染色時間是流式細胞術的關鍵步驟[3]。本研究選取新鮮幼嫩葉片,取樣后立即制樣。通過對6種不同解離液的篩選,最終篩選出WPB解離液,其對茉莉和內標的解離效果最好,CV值控制在5%以內,粒子清晰集中,獲得的峰圖清晰,雜峰較少,無重疊峰且區分度良好,保證了結果的可靠性和準確性。木本植物細胞核中含有單寧酸,單寧酸會干擾熒光染色的酚類化合物,對Gal和LBO1裂解液產生負面影響,故Gal和LBO1裂解液不適合用于木本植物細胞核懸液的提取[20],與本研究的試驗結果一致。
內標樣品的選擇是流式細胞術測定結果可靠準確的關鍵因素。本研究采用已知基因組的水稻日本晴和玉米B73或水稻日本晴和番茄作為雙內標對單瓣、雙瓣和多瓣茉莉進行測定分析,結果顯示,茉莉與內標間的峰區分度良好、無重疊,且DNA含量的CV值均控制在5.0%以內[3],可確保試驗結果的準確性,因此,本試驗結果可靠穩定。
Bennett等對24種被子植物種內DNA含量變化的研究發現,種內DNA含量變化是很普遍的現象,種內DNA含量變化在4%~28%之間[21]。鄧果特等采用流式細胞儀測定來自不同地區五節芒的基因組大小發現,湖南省郴州市、湖北省紅安縣和江西省修水縣采集的五節芒基因組大小間無顯著性差異,廣東省連山壯族瑤族自治縣、江蘇省連云港市和福建省永安市采集的五節芒基因組大小間無顯著性差異,但它們兩者之間有顯著性差異,說明五節芒存在種內DNA含量變異[7]。本研究同時測定的3個瓣型茉莉基因組大小中,單瓣茉莉基因組大小(0.809 5 pg)和雙瓣茉莉基因組大小(0.804 5 pg)無顯著性差異,但它們與多瓣茉莉基因組大小(0592 6 pg)之間存在顯著性差異,這與上述研究結果吻合。造成多瓣茉莉與單瓣和雙瓣茉莉間基因組大小存在顯著性差異的原因可能很多,如染色體的多倍化、B染色體、非整倍體、染色質變異及基因重復與丟失等,這些都可能會對DNA含量的種內變異有一定的作用[22]。此外,植物基因組DNA含量會被某種特定的選擇力影響,如緯度、氣候、海拔及地區差異都有可能造成DNA含量的變異[23-24]。具體是何原因導致茉莉種內DNA含量變異,還需進一步研究。
總之,本研究首次建立了流式細胞術測定茉莉基因組大小的方法,并測定了3種不同瓣型茉莉的基因組大小,豐富了茉莉的生物學信息,為茉莉的基因組學及系統進化等研究奠定了重要的理論基礎。
參考文獻:
[1]Largia M J V,Shilpha J,Pothiraj G,et al. Analysis of nuclear DNA content,genetic stability,Bacoside A quantity and antioxidant potential of long term in vitro grown germplasm lines of Bacopa monnieri (L.)[J]. Plant Cell Tissue and Organ Culture,2015,120(1):399-406.
[2]Leitch I J,Johnston E,Pellicer J,et al. Plant DNA C-values Database[DB/OL]. (2019-04-01)[2019-10-21]. https://cvalues.science.kew.org/.
[3]Dolezel J,Bartos J,Voglmayr H,et al. Nuclear DNA content and genome size of trout and human[J]. Cytometry A,2003,51(2):127-128.
[4]Levine R F,Bunn P A,Hazzard K C,et al. Flow cytometric analysis of megakaryocyte ploidy:comparison with Feulgen microdensitometry and discovery that 8N is the predominant ploidy class in guinea pig and monkey marrow[J]. Blood,1980,56(2):210-217.
[5]Dolezel J,Greilhuber J,Suda J. Estimation of nuclear DNA content in plants using flow cytometry[J]. Nature Protocols,2007,2(9):2233-2244.
[6]Teh B T,Lim K,Yong C H,et al. The draft genome of tropical fruit durian (Durio zibethinus)[J]. Nature Genetics,2017,49(11):1633-1641.
[7]鄧果特,劉清波,蔣建雄,等. 五節芒基因組大小測定[J]. 植物遺傳資源學報,2013,14(2):339-341.
[8]陳丙義,李金鳳,霍恒志,等. 6種野生草莓基因組大小估算[J]. 果樹學報,2015,32(91):51-56.
[9]馬秋月,李淑順,馬 驤,等. 基于流式細胞技術的兩種槭屬植物基因組大小測定[J]. 南京林業大學學報 (自然科學版),2018,42(5):201-205.
[10]都明理,徐 嬌,朱楚然,等. 3種柴胡染色體數目測定及基因組大小估測[J]. 江蘇農業科學,2019,47(11):191-193.
[11]王利虎,呂 曄,羅 智,等. 流式細胞術估測棗染色體倍性和基因組大小方法的建立及應用[J]. 農業生物技術學報,2018,26(3):511-520.
[12]張 健,王 瑩,馬祥建,等. 基于流式細胞術的旱柳染色體倍性與基因組大小測定[J]. 江蘇農業科學,2018,46(22):40-43.
[13]賴 彪,吳傳龍,秦永華,等. 流式細胞儀測定荔枝倍性和基因組大小的細胞核提取液篩選與應用[J]. 果樹學報,2019,36(7):939-946.
[14]袁昌齊,束成杰,賈曉東,等. “一帶一路”經濟植物應用與開發(南亞篇)[J]. 中國野生植物資源,2016,35(2):1-2.
[15]鄧衍明,葉曉青,李聰聰. α-萘乙酸對茉莉水培生根及根尖解剖結構的影響[J]. 江西農業學報,2012,24(2):35-37.
[16]Deng Y M,Sun X B,Gu C S,et al. Identification of pre-fertilization reproductive barriers and the underlying cytological mechanism in crosses among three petal-types of Jasminum sambac and their relevance to phylogenetic relationships[J]. PLoS One,2017,12(4):e0176026.
[17]王湘平,賴志明,蘇金為. 茉莉染色體核型研究[J]. 福建農學院學報,1992,21(1):63-66.
[18]樊慧杰,柴 智,殷福棟,等. 連翹基因組大小的流式細胞儀測定[J]. 時珍國醫國藥,2019,30(3):758-760.
[19]Suda J,Kyncl T,Jarolímová V. Genome size variation in Macaronesian angiosperms:forty percent of the Canarian endemic flora completed[J]. Plant Systematics and Evolution,2005,252(3/4):215-238.
[20]Loureiro J,Rodriguez E,Dolezel J,et al. Flow cytometric and microscopic analysis of the effect of tannic acid on plant nuclei and estimation of DNA content[J]. Annals of Botany,2006,98(3):515-527.
[21]Bennett M D,Leitch I J. Nuclear DNA amounts in angiosperms[J]. Annals of Botany,1995,76(2):113-176.
[22]Biémont C. Genome size evolution:within-species variation in genome size[J]. Heredity,2008,101(4):297-298.
[23]Grime J P,Mowforth M A. Variation in genome size-an ecological interpretation[J]. Nature,1982,299(5879):151-153.
[24]Hall S E,Dvorak W S,Johnston J S,et al. Flow cytometric analysis of DNA content for tropical and temperate new world pines[J]. Annals of Botany,2000,86(6):1081-1086.

