產低溫幾丁質酶菌株的篩選、鑒定與產酶條件優(yōu)化
陳立功,吳家葳,張慶芳,遲乃玉,王曉輝,*
(1.大連大學生命科學與技術學院,遼寧大連 116622;2.遼寧省海洋微生物工程技術研究中心,遼寧大連 116622)
幾丁質(chitin)是自然界含量十分豐富的生物多糖,是N-乙酰氨基葡萄糖單體的天然多聚體[1-2]。幾丁質在自然界中廣泛存在,真菌、昆蟲外骨骼及節(jié)肢動物外殼中都含有幾丁質成分。它是海洋中蝦蟹殼的主要成分,主要是作為結構物質起支撐和保護的作用[3-4]。幾丁質主要來源于海洋,但每年有超過8萬噸幾丁質被視為廢物丟棄[5-6]。近些年來隨著人們對海洋的不斷探索,對海洋資源的不斷開發(fā)利用,以及在環(huán)境保護、能源利用等領域的研究進展,人類越來越認識到幾丁質作為地球上含量豐富的天然多糖,具有被變廢為寶的潛力。研究顯示,幾丁質降解后產生的不同聚合度的幾丁寡糖或幾丁單糖,具有良好的誘導植物抗病性及抗菌等作用,被廣泛地應用于農業(yè)、保健及化妝品等行業(yè)[7-10]。
幾丁質酶(chitinase,EC 3.2.1.14)通過水解β-(1→4)糖苷鍵降解幾丁質,廣泛存在于各種真菌、細菌、動植物中[10-11]。因幾丁質酶能夠通過降解真菌細胞壁及昆蟲外骨骼中的幾丁質成分,對其產生殺傷作用,故在農業(yè)中可用來抑菌和殺蟲[12-15]。幾丁質的生物降解主要是通過幾丁質酶來實現的,相比于物理降解法和化學降解法,生物降解法具有高效綠色等優(yōu)勢[16-17]。
近些年來,微生物幾丁質酶系的研究已經較為系統(tǒng),但海洋來源的幾丁質酶的相關研究較少[18]。報道發(fā)現的幾丁質酶大多為中高溫酶,需要在40~50 ℃溫度下充分發(fā)揮作用,限制了其應用范圍,增加了生產成本[19-20]。海洋微生物產生的低溫酶由于其特殊的晶體結構使其比中溫酶、高溫酶更有優(yōu)勢。該酶具有低溫下高酶活力及高催化效率、結構高效柔順性和熱不穩(wěn)定性(經過溫和的熱處理,在不影響產品品質的情況下即可使低溫酶的活力喪失)等生物學特性[21-23]。目前,國內外研究中未見發(fā)光桿菌屬菌株產低溫幾丁質酶的發(fā)酵條件優(yōu)化的相關報道。
本研究選取具有低溫、低光照等特點的海洋環(huán)境[24-25]為菌株來源庫,以渤海海域海泥為樣品,經平板篩選得到產低溫幾丁質酶的菌株,對其進行了形態(tài)學鑒定、分子生物學鑒定及最佳產酶條件的單因素優(yōu)化。
1 材料與方法
1.1 材料與儀器
菌種來源 中國遼寧大連渤海海域海底泥(123°391′E,39°6972′N);篩選培養(yǎng)基 膠體幾丁質1.0 g/L,蛋白胨10.0 g/L,K2HPO45.0 g/L,KH2PO45.0 g/L,NaCl 5.0 g/L,MgSO4·7H2O 5.0 g/L,ZnSO4·7H2O 5.0 g/L,FeSO4·7H2O 5.0 g/L,瓊脂1.5%~2.0%,海水,pH7.0;發(fā)酵培養(yǎng)基、2216E種子培養(yǎng)基 參考王曉輝等[26]的配方;幾丁質 生工生物工程(上海)股份有限公司;蛋白胨 北京奧博星生物技術有限責任公司;其它試劑 均為國產分析純。
LTI-700低溫恒溫培養(yǎng)箱 上海愛朗儀器有限公司;CRY-2112恒溫搖床 上海茸研儀器有限公司;Thermo Multiskan1510酶標儀 芬蘭Labsystems公司;CI-L型顯微鏡 日本Nikon公司。
1.2 實驗方法
1.2.1 膠體幾丁質 根據王曉輝等[26]的方法進行1%膠體幾丁質的制備。
1.2.2 篩選方法 菌株初篩:取海泥樣品加入無菌水中,輕微振蕩使其完全溶解。梯度稀釋后按梯度(10-4、10-5、10-6)涂布于篩選培養(yǎng)基上培養(yǎng),挑取產生透明圈的菌株進行劃線純化。菌株復篩:1%接種量將菌株接種至發(fā)酵培養(yǎng)基進行發(fā)酵培養(yǎng),20 ℃、160 r/min培養(yǎng)2~3 d后進行酶活驗證,取發(fā)酵液10000 r/min離心10 min,取上清液檢測酶活。
1.2.3 酶活測定 取上清0.5 mL,與0.5 mL 1%膠體幾丁質混合,35 ℃下水浴保溫15 min,10000 r/min離心5 min,取上清200 μL煮沸5 min,冷卻后,加入200 μL DNS溶液煮沸5 min,冷卻后加入600 μL超純水,10000 r/min離心10 min,取200 μL于96孔板中測定OD520,三組平行實驗[27]。酶活單位定義(U):在上述條件下,催化產生l μmol N-乙酰-D-氨基葡萄糖所需的酶量。
1.2.4 菌株鑒定 形態(tài)學鑒定:參考《常見細菌系統(tǒng)鑒定手冊》進行形態(tài)學鑒定;分子生物學鑒定:將菌株送往上海京通生物科技有限公司進行16S rDNA鑒定。
1.2.5 生長曲線與產酶曲線 5 mL種子培養(yǎng)基中接種純化菌株的單菌落,并于20 ℃、160 r/min的搖床中培養(yǎng)24 h。
生長曲線測定:1%接種量將種子液接種至100 mL 2216E培養(yǎng)基,20 ℃、160 r/min發(fā)酵,4 h檢測一次OD600。三組平行實驗。
產酶曲線測定:1%接種量將種子液接種至100 mL發(fā)酵培養(yǎng)基,20 ℃、160 r/min發(fā)酵,4 h檢測一次酶活。三組平行實驗。
1.2.6 發(fā)酵產酶條件優(yōu)化試驗 碳源種類優(yōu)化:碳源種類為膠體幾丁質、粉狀幾丁質、k-卡拉膠、褐藻酸鈉、殼聚糖、淀粉、發(fā)酵用麩皮、發(fā)酵用秸稈粉、微晶纖維素、羧甲基纖維素鈉,碳源添加量為5.0 g/L,胰蛋白胨5.0 g/L,發(fā)酵溫度20 ℃,裝液量100 mL/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
碳源添加量優(yōu)化:膠體幾丁質添加量為2.0、4.0、6.0、8.0、10.0、12.0、14.0 g/L,胰蛋白胨5.0 g/L,發(fā)酵溫度20 ℃,裝液量100 mL/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
氮源種類優(yōu)化:氮源種類為胰蛋白胨、酵母粉、酵母膏、玉米漿、牛肉膏、硫酸銨、硝酸鉀、硝酸銨、尿素,氮源添加量為5.0 g/L,膠體幾丁質12.0 g/L,發(fā)酵溫度20 ℃,裝液量100 mL/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
氮源添加量優(yōu)化:酵母膏添加量為2.0、4.0、6.0、8.0、10.0、12.0 g/L,膠體幾丁質12.0 g/L,發(fā)酵溫度20 ℃,裝液量100 mL/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
發(fā)酵溫度優(yōu)化:膠體幾丁質12.0 g/L,酵母膏6.0 g/L,發(fā)酵溫度為5 ~50 ℃,梯度間隔為5 ℃,裝液量100 mL/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
發(fā)酵初始pH優(yōu)化:膠體幾丁質12.0 g/L,酵母膏6.0 g/L,發(fā)酵溫度為15 ℃,初始pH為3.0~12.0,裝液量100 mL/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
裝液量優(yōu)化:膠體幾丁質12.0 g/L,酵母膏6.0 g/L,發(fā)酵溫度為15 ℃,初始pH7.0,裝液量為(25、50 、75、100、125、150、175 mL)/250 mL,接種量1%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
接種量優(yōu)化:膠體幾丁質12.0 g/L,酵母膏6.0 g/L,發(fā)酵溫度為15 ℃,初始pH7.0,裝液量為75 mL/250 mL,接種量為0.4%、0.8%、1%、2%、3%、4%、5%、6%,于160 r/min搖床中培養(yǎng)80 h,檢測酶活。
發(fā)酵轉速優(yōu)化:膠體幾丁質12.0 g/L,酵母膏6.0 g/L,發(fā)酵溫度為15 ℃,初始pH7.0,裝液量為75 mL/250 mL,接種量1%,發(fā)酵轉速為80~240 r/min,梯度間隔為20 r/min,培養(yǎng)80 h,檢測酶活。
發(fā)酵時間優(yōu)化:膠體幾丁質12.0 g/L,酵母膏6.0 g/L,發(fā)酵溫度為15 ℃,初始pH7.0,裝液量為75 mL/250 mL,接種量1%,發(fā)酵轉速220 r/min,每隔12 h檢測酶活。
所有實驗均為三組平行。
1.3 數據分析
使用GraphPad Prism 8.0.1軟件對發(fā)酵條件優(yōu)化數據進行處理,所有實驗均為三組平行。
2 結果與分析
2.1 菌株篩選與鑒定結果
篩選培養(yǎng)基培養(yǎng)3 d后,平板上長出帶有透明圈的菌株,挑取該菌株進行三區(qū)劃線純化。純化后得到單菌落接種于發(fā)酵培養(yǎng)基,發(fā)酵后進行酶活檢測復篩,確定該菌株為產幾丁質酶菌株,命名為LG-1。
形態(tài)學鑒定結果:將菌株LG-1劃線在固體發(fā)酵培養(yǎng)基上,20 ℃生長2 d后觀察菌落形態(tài),單個菌落呈白色或淡黃色,不透明,表面光滑且邊緣整齊,中間略厚,易挑取;挑取單菌落染色后進行顯微形態(tài)觀察,該菌株為兩端圓的短桿狀,無芽孢;簡單染色及革蘭氏染色結果表明,該菌為革蘭氏陰性桿菌,參考《常見細菌系統(tǒng)鑒定手冊》可以初步判斷為發(fā)光桿菌屬,具體判斷需要進一步進行16S rDNA序列測定,如圖1。
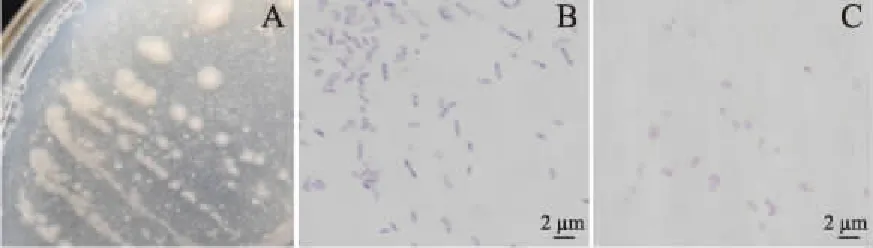
圖1 菌株LG-1的菌落形態(tài)和顯微形態(tài)
分子生物學鑒定結果:將16S rDNA測序結果與GenBank數據庫基因序列進行比較,搜索得到同源性達到99%以上的菌株,均為發(fā)光桿菌。結合形態(tài)學特征綜合比較,確定菌株LG-1為發(fā)光桿菌屬,圖2為Photobacteriumsp. LG-1的系統(tǒng)發(fā)育樹。

圖2 Photobacterium sp. LG-1的16S rDNA的序列系統(tǒng)發(fā)育樹
2.2 生長曲線與產酶曲線測定
如圖3所示,菌株LG-1在該條件下培養(yǎng)時,接種后發(fā)酵培養(yǎng)8 h內為延滯期,此階段菌株生長緩慢,酶活性較低;此后菌株進入對數生長期,此階段增殖加快,發(fā)酵液內菌體濃度迅速增加,這一階段幾丁質酶活性亦快速升高;大約52 h時菌株生長進入穩(wěn)定期,此階段菌株代謝活動減慢,增殖速度隨之降低,發(fā)酵液內菌體濃度相對穩(wěn)定;菌株生長進入72 h后,緩慢進入衰亡期,此階段菌株增殖速度小于死亡速度,可能因為發(fā)酵進入此時期時,發(fā)酵液內營養(yǎng)物質消耗過多,不能滿足大量菌體生長繁殖需要。菌株LG-1在發(fā)酵培養(yǎng)及中培養(yǎng)80 h時幾丁質酶活達到最大值,為0.932 U/mL。確定該菌株產酶最適培養(yǎng)時間為80 h。
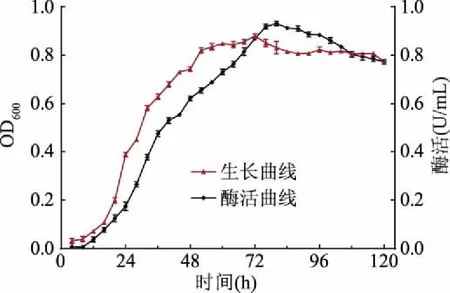
圖3 幾丁質酶產生菌LG-1生長曲線及產酶曲線
2.3 菌株LG-1產酶條件優(yōu)化
2.3.1 碳源種類優(yōu)化結果 由圖4可以看出,幾丁質是該菌株生長產酶的優(yōu)良碳源,且膠體幾丁質比晶體粉狀幾丁質對菌株產酶有更好的誘導能力,確定膠體幾丁質是誘導菌株LG-1產酶的最優(yōu)碳源。k-卡拉膠、褐藻酸鈉、淀粉、發(fā)酵用麩皮、發(fā)酵用秸稈粉有一定的誘導產酶能力。
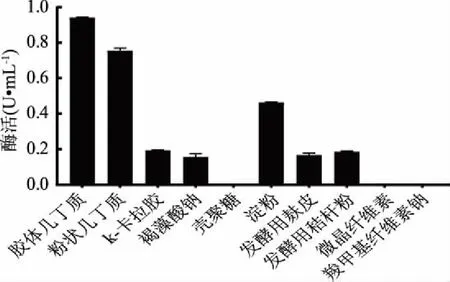
圖4 碳源種類對酶活的影響
2.3.2 碳源添加量優(yōu)化結果 在一定濃度范圍內,膠體幾丁質濃度與幾丁質酶活性呈正比例關系(如圖5),且當膠體幾丁質濃度處于較低濃度時,其濃度的改變會對幾丁質酶活性產生明顯影響;當發(fā)酵液中膠體幾丁質濃度為12 g/L時,幾丁質酶的酶活達到最高,超過12 g/L后幾丁質酶活下降。因此,確定最佳膠體幾丁質濃度為12 g/L。
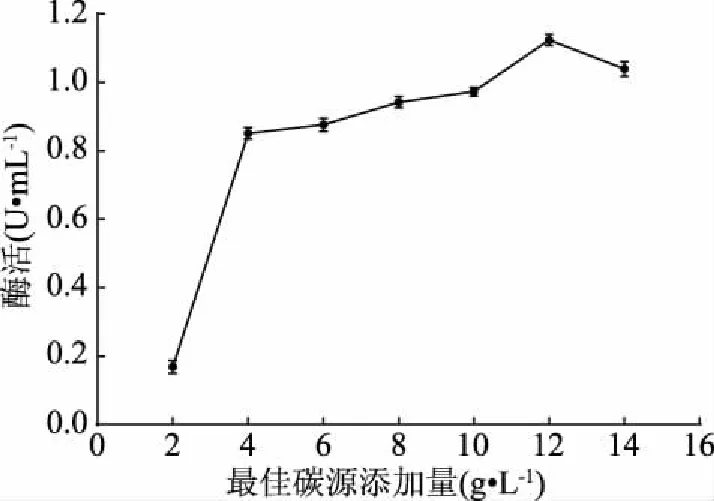
圖5 膠體幾丁質濃度對酶活的影響
2.3.3 氮源種類優(yōu)化結果 結果如圖6所示,酵母膏是菌株LG-1產幾丁質酶的最優(yōu)氮源,且胰蛋白胨、牛肉膏對菌株產幾丁質酶亦有較好的誘導作用;相比而言,硝酸鉀、酵母粉及硫酸銨誘導菌株產酶的能力相對較弱;而有機氮源中的玉米漿、無機氮源中的硝酸銨和尿素則不能誘導菌株產生幾丁質酶。
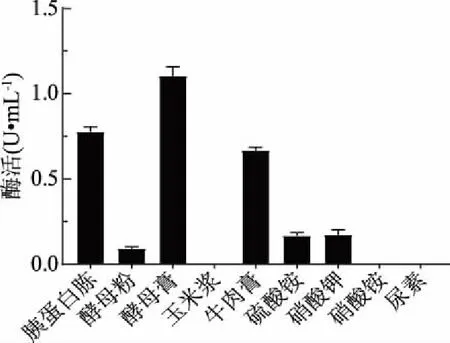
圖6 氮源種類對酶活的影響
2.3.4 氮源添加量優(yōu)化結果 由圖7可知,低濃度和高濃度的酵母膏都不利于菌株LG-1產幾丁質酶,隨著酵母膏濃度增加,幾丁質酶活性先升高后下降,幾丁質酶的活性在酵母膏濃度為6 g/L時達到最大。因此,確定最佳酵母膏濃度為6 g/L。
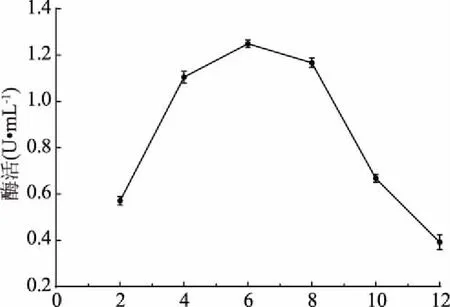
圖7 酵母膏濃度對酶活的影響
2.3.5 發(fā)酵溫度優(yōu)化結果 由圖8可知,當發(fā)酵溫度為15 ℃時,菌株LG-1發(fā)酵液中的幾丁質酶活性最高,且當發(fā)酵溫度為5 ℃時,此時溫度較低,大多數菌株在此溫度下生長代謝緩慢或處于休眠狀態(tài)[4],而菌株LG-1卻仍能生長產酶;當發(fā)酵溫度增加至30 ℃后,幾丁質酶活性很低,相比較而言,該菌株在相對較低溫度下更利于產酶。因此,最佳發(fā)酵溫度為15 ℃。
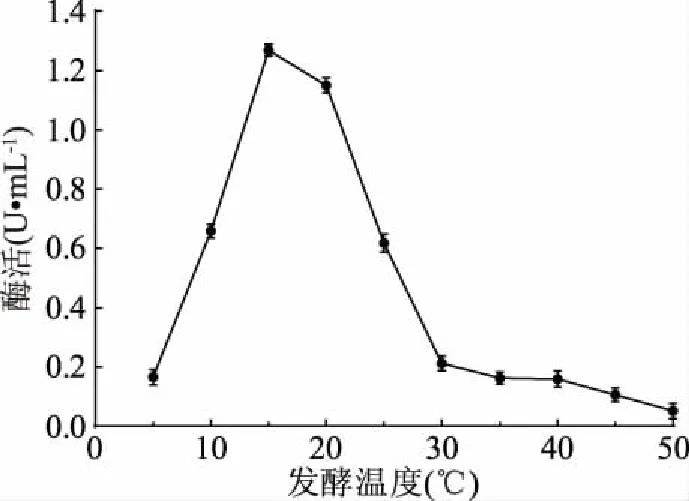
圖8 發(fā)酵溫度對酶活的影響
2.3.6 初始pH優(yōu)化結果 如圖9所示,菌株LG-1在pH7.0時產酶活力最高,表明菌株在偏中性的環(huán)境中更易生長產酶,在pH6~8范圍內菌株產酶能力較高,環(huán)境過酸過堿都會影響幾丁質酶的活性。因此,確定最佳發(fā)酵培養(yǎng)基初始pH為7.0。
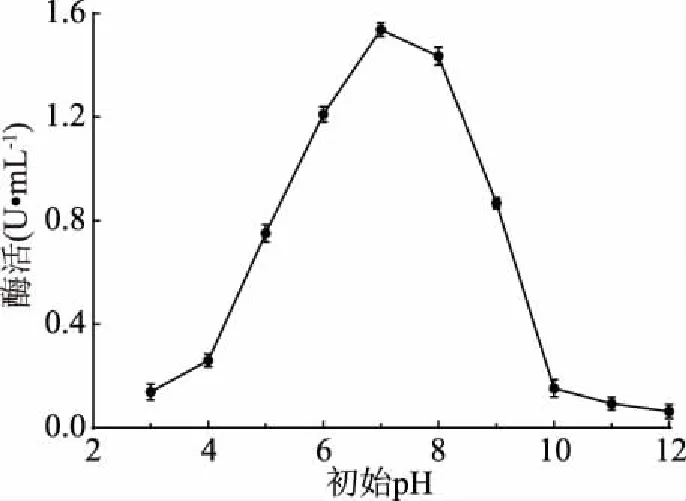
圖9 初始pH對酶活的影響
2.3.7 裝液量優(yōu)化結果 由圖10可知,當裝液量為75 mL/250 mL時菌株LG-1產酶最高,增大或減少裝液量都會使酶活性降低,較高的裝液量直接影響培養(yǎng)基中的溶氧,說明菌株LG-1為需氧發(fā)酵。因此,確定最適裝液量為75 mL/250 mL。
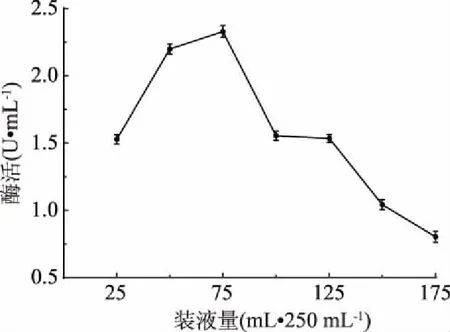
圖10 裝液量對酶活的影響
2.3.8 接種量優(yōu)化結果 如圖11所示,接種量為1%時,幾丁質酶活性最高,幾丁質酶活性隨著接種量的增大而降低,這可能是因為過高的接種量會使培養(yǎng)基中物質急劇消耗,較高的菌濃度會大量消耗培養(yǎng)基中的氧氣。故1%為菌株LG-1的最佳接種量。

圖11 接種量對酶活的影響
2.3.9 發(fā)酵轉速優(yōu)化結果 結果如圖12所示,較低轉速菌株LG-1產酶能力較低,隨著發(fā)酵轉速的增加,幾丁質酶活性增加,當轉速為220 r/min時,酶活達到最高點,增大轉速可以增加培養(yǎng)基中的溶氧量,結合裝液量和接種量優(yōu)化結果,說明菌株LG-1發(fā)酵對溶氧量要求較高。因此,確定最適發(fā)酵轉速為220 r/min。

圖12 轉速對酶活的影響
2.3.10 發(fā)酵時間優(yōu)化結果 由圖13可知,相比于優(yōu)化前,菌株快速產酶時間有所推遲,從48 h開始酶活性急劇增加,在96 h時酶活達到最高,為4.566 U/mL。
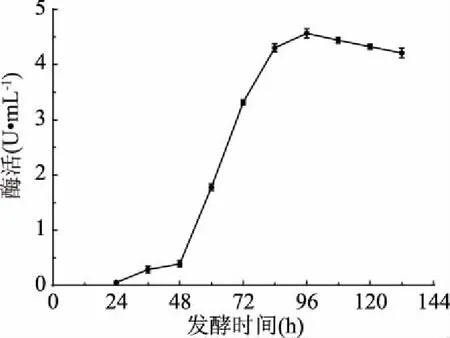
圖13 發(fā)酵時間對酶活的影響
3 結論與討論
從“適者生存”的觀點出發(fā),能夠在海洋這種低溫、低光照環(huán)境中生存的微生物,其自身及其產生的酶極有可能具備耐低溫和低溫下仍然具有較高活力的特點。所以,本研究以海洋底泥為樣品,篩得1株產幾丁質酶活力較高的菌株,經形態(tài)學鑒定及分子生物學鑒定為革蘭氏陰性發(fā)光桿菌,命名為Photobacteriumsp. LG-1,酶活復篩證明該菌株對幾丁質有較好的降解作用。
本實驗篩選到的產幾丁質酶細菌LG-1對膠體幾丁質及晶體粉狀幾丁質有很好的降解作用,且兩者誘導產酶相差不大,自然狀態(tài)下,幾丁質以晶體形式存在,膠體幾丁質需要通過在粉狀幾丁質中加入強酸并通過一定過程才能制成,增加了生產成本且造成了環(huán)境污染及資源浪費[28-30]。LG-1對晶體幾丁質的降解能力使得其完全可以直接以蝦蟹殼為原料,進行低溫幾丁質酶的誘導分泌,大大降低了成本。同時LG-1還有較好的淀粉酶活性,對k-卡拉膠、褐藻酸鈉、發(fā)酵用麩皮、發(fā)酵用秸稈粉有一定降解能力,具有廣闊的工業(yè)應用前景。
為了獲得更多高活性、高質量的低溫幾丁質酶,對菌株LG-1最佳產酶條件進行了單因素優(yōu)化,實驗結果表明,菌株LG-1在不同培養(yǎng)條件下產酶能力有很大差異,膠體幾丁質和酵母膏能夠大量誘導菌株產酶;菌株在較低溫度下產酶能力明顯強于高溫,這可能與菌株來源和低溫幾丁質酶特性有關;裝液量、接種量及發(fā)酵轉速結果表明,較低的裝液量和較高的轉速更利于菌株產酶,說明菌株發(fā)酵產酶對溶氧量需求較高。發(fā)酵條件優(yōu)化結果為:膠體幾丁質12.0 g/L、酵母膏6.0 g/L、初始pH7.0、裝液量75 mL/250 mL、接種量1%、海水1 L,在15 ℃,220 r/min培養(yǎng)96 h,酶活力達4.566 U/mL,相比于未優(yōu)化前的酶活0.932 U/mL,提高了389.91%。且該菌所產幾丁質酶在低溫下仍有很高活性,若應用于工業(yè)生產會大大降低生產成本,具備較大的應用潛力。
本研究從產低溫幾丁質酶菌株篩選開始,對所獲得菌株Photobacteriumsp. LG-1進行了發(fā)酵條件的單因素優(yōu)化,大大提高了菌株Photobacteriumsp. LG-1的產酶活性。下一步研究方向會在單因素優(yōu)化的基礎上,對菌株產酶活性進行響應面的優(yōu)化,完成系統(tǒng)性的產酶優(yōu)化過程,進一步提高其產酶活性,并對其發(fā)酵條件進行5 L放大,滿足基本實驗需求的同時,逐漸向工業(yè)化發(fā)酵產酶邁進。本實驗為下一步幾丁質酶的酶學性質研究及產業(yè)應用提供參考。

