基于CRISPR/Cas13的RNA編輯系統及其在核酸檢測中的應用
張愛霞,朱慶鋒,陳 沛,于 洋,魏文康,晏石娟,劉文華
(廣東省農業科學院農業生物基因研究中心,廣東 廣州 510640)
核酸檢測技術在傳染病病原檢測、食品安全檢疫和環境生態監測等方面發揮重要作用。快速核酸檢測對于診斷和監測感染性病原體并提供最新的疾病信息以控制傳播和及時治療必不可少,即時檢測(Point-of-care testing,POCT)有助于提高效率,及時優化決策,降低成本,尤其對資源受限的地區更為重要。根據世界衛生組織的標準,理想的病原體診斷檢測應是廉價、靈敏、特異、易用、快速、無需大型設備即可實現[1]。目前常用的核酸檢測技術主要有聚合酶鏈反應(Polymerase chain reaction,PCR)技術、基因芯片、等溫擴增技術和基因測序技術,但這些技術存在操作復雜、設備昂貴或靈敏度低等局限[1-2]。因此,迫切需要開發更為簡便快捷、靈敏度高、特異性強的新一代核酸檢測技術。
成簇規律間隔短回文重復序列及其相關基因(Clustered regularly interspaced short palindromic repeats/CRISPR associated gene,CRISPR/Cas)系統是存在于細菌和古菌中的一種適應性免疫系統,能在單鏈向導RNA(Single guide RNA,sgRNA)指引下將Cas核酸酶與靶序列相結合并對其進行切割[3]。該系統中的CRISPR/Cas13是目前CRISPR/Cas家族中唯一只靶向單鏈RNA(Single-stranded RNA,ssRNA)的系統,自2016年6月報道[4]以來,CRISPR/Cas13系統就備受全球研究人員的關注和重視,這不僅因為它是一種只靶向RNA的新型CRISPR系統,更重要的是其具有特異性切割和“附帶切割”能力。高的靶向效率和優異的酶切能力使CRISPR/Cas13系統在核酸檢測方面具有廣闊的應用前景。本文綜述了基于CRISPR/Cas13的核酸檢測系統的研究現狀,以期為相關領域的進一步研究提供參考。
1 CRISPR/Cas13在CRISPR系統中的類別歸屬及其亞型
目前已知的CRISPR/Cas系統有6型和30多種亞型[5],根據Cas的蛋白組成及發揮作用的方式,CRISPR/Cas系統可分為1類系統(Class 1)和2類系統(Class 2)兩大類群。Class 1的Cas是一種多酶復合物,包括Ⅰ、Ⅲ和Ⅳ型;Class 2則僅含單個多結構域的Cas蛋白[6],包括Ⅱ(Cas9)、Ⅴ(Cas12)和Ⅵ(Cas13)型[7-8]。Cas13屬于2類CRISPR/Cas系統的Ⅵ型,包含單一的效應蛋白質Cas13,CRISPR/Cas13系統類似于CRISPR/Cas9系統,但Cas9靶向的是DNA,而Cas13僅靶向切割ssRNA[4]。
CRISPR/Cas13系統根據Cas蛋白的系統發育可分為 4 種亞型[6](圖1),即VI-A、VI-B(VIB1、VI-B2)、VI-C和VI-D[9-10],這4個亞型同源性不高,同源序列僅限于Cas13上的高等真核生物和原核生物核苷酸結合域(Higher eukaryotes and prokaryotes nucleotide-binding,HEPN)位點。VI-A 亞型具有Cas1和Cas2,其Cas13蛋白稱為Cas13a,目前科學家已經從Leptotrichia buccalis、Leptotrichia wadei、Leptotrichia shahii和Lachnospiraceae bacterium等多種細菌中解析出了Cas13a結構,根據其來源不同分別稱為LbuCas13a[11]、LwaCas13a[12]、LshCas13a[13]和LbaCas13a[14]。VI-B亞型缺少Cas1和Cas2,具有Csx28和Csx27,Csx28能增強Cas13b活性,Csx27對其有抑制作用,從而進一步分成VI-B1 和VIB2[15]。絕大多數VI-D亞型都有相關的含WYL結構域的輔助蛋白,這個結構域通常與原核防御系統有關[16]。VI-D亞型的Cas13d比較小,平均長度比Cas13a和Cas13c短190~300個氨基酸序列,這為RNA的調控和檢測提供了便利[16]。對于VI-C亞型,目前相關研究較少[6]。
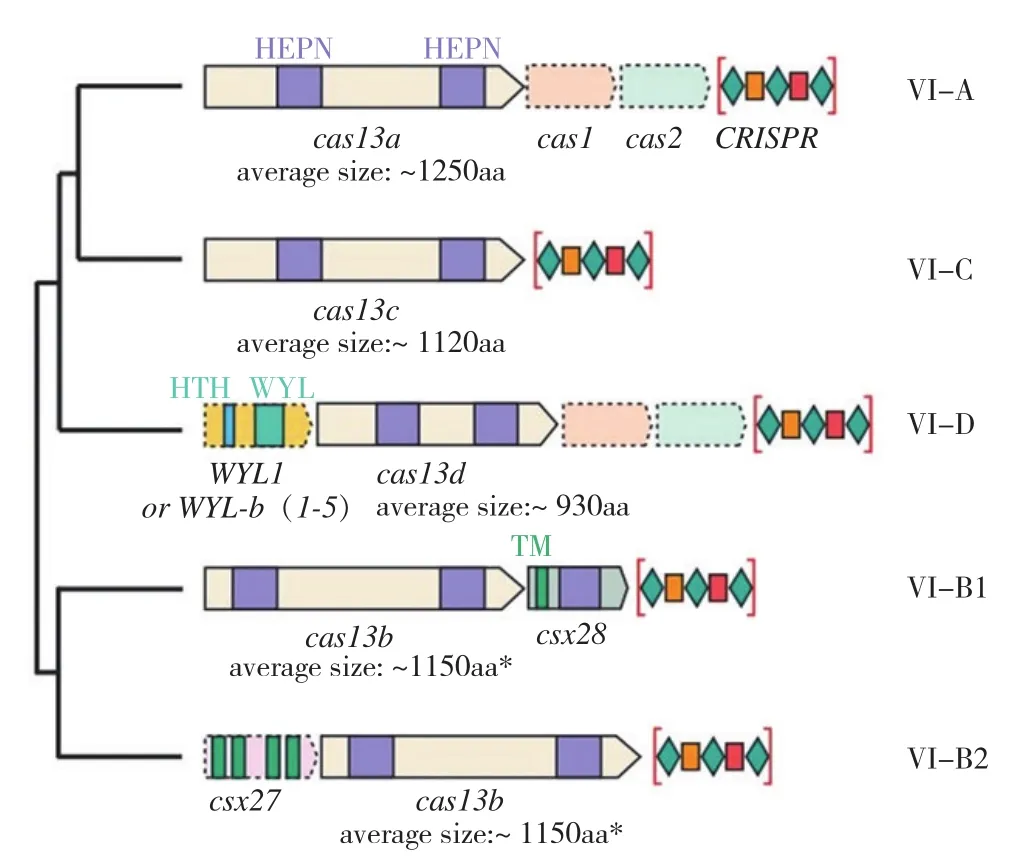
圖1 CRISPR/Cas13系統的4 種亞型[6]Fig. 1 Four subtypes of CRISPR/Cas13 system[6]
2 CRISPR/Cas13系統的組分特征及其分子作用機制
2.1 Cas13蛋白
2017年,中國科學院生物物理研究所解析了LbuCas13a與CRISPR RNA(crRNA)二元復合物的晶體結構和LbuCas13a蛋白的晶體結構[13]。LbuCas13a具有“雙瓣葉”球狀蛋白質結構,由1個 crRNA識 別 瓣 葉(Recognition lobe,REC)和1個核酸酶瓣葉(Nuclease lobe,NUC)組成。REC葉片包含NTD(N-terminal domain,NTD)和Helical-1結構域,NUC葉片包含兩個HEPN結構域、Helical-2結構域以及連接兩個HEPN結構域的連接結構域[13](圖2)。負責切割crRNA前體和靶RNA的活性位點分別位于Helical-1和HEPN結構域。HEPN催化切割位點位于Cas13a蛋白的外表面,Cas13a蛋白一旦被靶RNA活化,即可行使非特異性RNA酶功能,裂解附近的其他ssRNA[11]。

圖2 Cas13a與crRNA復合物的晶體結構及其催化活性中心[13]Fig. 2 Crystal structure of Cas13a in complex with crRNA and its catalytic active sites[13]
HEPN催化切割位點中存在一些高度保守的氨基酸殘基,對靶RNA的切割起主要作用,分別是HEPN1結構域中第597位精氨酸(Arg597)、第602位組氨酸(His602)和HEPN2結構域中第1 278位精氨酸(Arg1278)、第1 283位組氨酸(His1283)。活化的HEPN催化切割位點形成1個含R-X4-6-H 基序的“X”形三維空間結構,上述4個關鍵氨基酸殘基位于外表面,從而對RNA酶切發揮關鍵作用[13,17](圖 2)。此外,HEPN1結構域中第598位天冬酰胺(Asn598)和HEPN2結構域中第1 279位天冬酰胺(Asn1279),對Cas13a的酶切活性也起著重要作用[13,17]。Cas13b和Cas13d也包含2個HEPN結構域,有類似 Cas13a的功能[18-19]。
2.2 crRNA
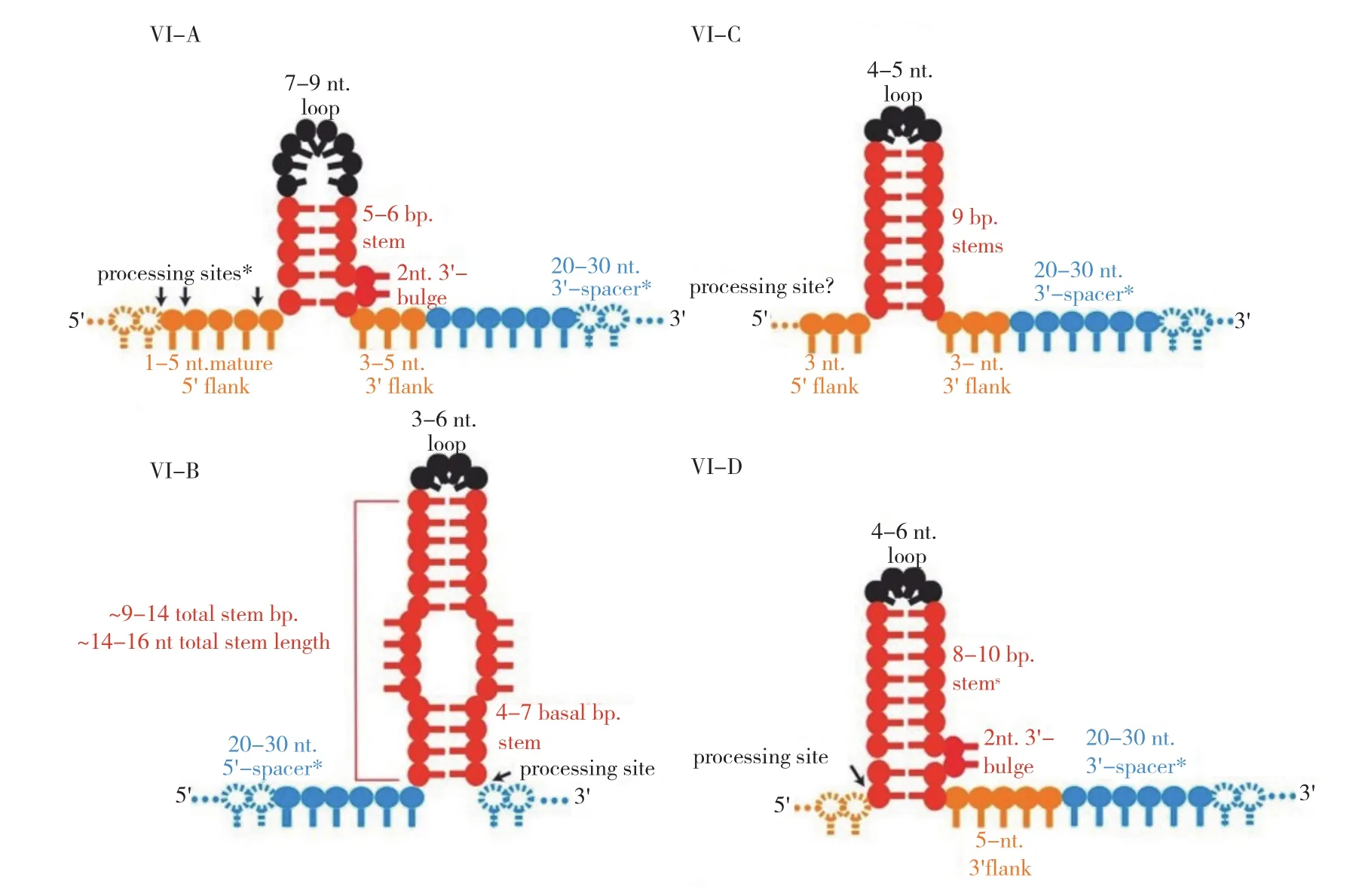
圖3 CRISPR/Cas13系統4種亞型的crRNA結構[6]Fig. 3 crRNA structure of four subtypes of CRISPR/Cas13 system[6]
crRNA是CRISPR/Cas13系統的另一個重要組成元件,由2個區域組成,即重復區域和引導區域(間隔區域)。CRISPR/Cas13系統4個亞型的crRNA 結構略有不同[6](圖3)。CRISPR/Cas13a中的crRNA[19]的重復區域有31個堿基,位于5'端,其二級結構是 1個莖環結構,包含1個由5個堿基配對形成的莖(莖上有2個堿基AC或AA的凸起)、1個由7~9個堿基形成的環,以及莖環結構兩端的鄰近基序。重復區域能在Cas13a酶切靶RNA時保護自身不被切割,而且在促進crRNA與Cas13a緊密結合方面起關鍵作用。引導區域有28個堿基,位于3'端,其序列可與靶RNA序列互補形成1個28 bp形似A-DNA螺旋的引導-靶RNA二聚體。在CRISPR/Cas13b系統中,crRNA前體被加工成一個66 nt 的成熟crRNA,含36 nt的重復區域和30 nt的引導區域[15]。二級結構分析顯示,與其他3個亞型相比,其crRNA具有更長的重復序列莖(9~14 bp),莖上具有幾個不成對的區域和凸起,莖環更小[20]。在CRISPR/Cas13d 系統中,crRNA具有36 nt的重復區域,包含 8~10 nt的莖和 4~6 nt的 環,1個末端含AAAAC基序的3'端側翼單鏈區[9,16]。
2.3 CRISPR/Cas13系統的分子作用機制
2.3.1 CRISPR/Cas13系統在體內的防御分子機制CRISPR/Cas13系統在體內的防御分子機制主要體現在4個階段(圖4):(1)外源核酸序列的獲取[21]。獲取外源核酸序列(如噬菌體和質粒)并整合在 CRISPR 陣列的“間隔”序列中形成新的間隔,研究認為Cas1、Cas2是新間隔形成的主要功能蛋白[22]。(2)crRNA 的表達與加工[14]。pre-crRNA是CRISPR基因座轉錄表達的初產物,而Cas13具有處理自身pre-crRNA為成熟crRNA的RNase活性[9,17],pre-crRNA與Cas13蛋白結合,引起Cas13蛋白構象變化而形成一個酸堿催化中心,催化酶切pre-crRNA形成成熟的crRNA[23-24]。(3)HEPN-RNase活性激活。靶ssRNA與Cas13-crRNA復合物結合,并與crRNA堿基互補配對,從而使Cas13蛋白發生協同構象變化,在HEPN結構域形成催化反應中心,激活了Cas13蛋白的HEPNRNase的酶切活性。(4)酶切反應階段。激活的Cas13蛋白能特異性切割靶ssRNA,還具有“附帶切割”的RNase活性,導致原核細胞中其他ssRNA被降解[4,11]。

圖4 CRISPR/Cas13系統的防御分子作用過程[6]Fig. 4 Molecular interaction process of CRISPR/Cas13 system[6]
2.3.2 CRISPR/Cas13系統的靶向特異性分子機制 激活的Cas13蛋白能特異性切割靶ssRNA,其靶向特異性主要由以下3個因素決定(圖5):(1)crRNA和靶RNA之間堿基的準確配對。Cas13-crRNA復合物在與靶RNA結合之前處于無活性狀態,只有靶RNA與crRNA互補配對形成穩定結合從而誘發Cas13的協同構象變化,才能激活Cas13的酶切活性,導致Cas13對靶RNA的高度靶向特異性[13,24]。而非配對 ssRNA無法穩定地與Cas13-crRNA復合物相結合,不能激活Cas13的酶切活性。(2)crRNA與靶RNA形成的二聚體中,有個對錯配十分敏感的區域,如果此處發生錯配則Cas13a不能切割靶RNA[6,11]。(3)前間隔序列側翼位點(Protospacer-flanking site,PFS),其作用如同CRISPR/ Cas9系統靶位點側翼的原間隔子相鄰基序(Protospacer adjacent motif,PAM)[25-26]。研究發現,LshCas13a的PFS為protospacer-3' 側翼的A、U或C(H)而不是G[2]。如果為G,則會顯著降低 HEPN 核酸酶的活性[27]。Gootenberg等[28]通過體外裂解試驗,證明LwaCas13a具有輕微的“H”PFS偏好,但對細菌篩選[12]或人類細胞系質粒文庫篩選[20]PFS時,沒有檢測到LwaCas13a的PFS偏好。不同來源的Cas13b的PFS也有差別,利用來自Bergeyella zoohelcum和Prevotella buccae的Cas13b在細菌中進行靶標文庫篩選時,PFS為5'和3'端的雙向PFS,其中5'端的一般為D(A/U/G),3'端的一般為NAN或NNA[15],但對PspCas13b進行細菌中錯配的目標文庫實驗時,則不需要PFS[20]。對于Cas13d,使用細菌篩選策略均未檢測到PFS序列。
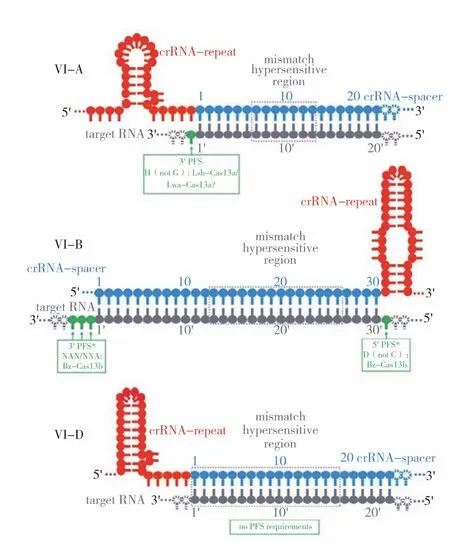
圖5 CRISPR/Cas13系統的靶向特異性分子機制[6]Fig. 5 Molecular mechanism of the target specificity of CRISPR/Cas13 system[6]
3 基于CRISPR/Cas13系統的特異性高靈敏度酶報告解鎖技術的產生和發展
2016年,East-Seletsky等[17]通過引入 RNA熒光報告分子,開發出基于CRISPR/Cas13a檢測不同靶RNA的新方法。RNA熒光報告分子上連接熒光基團和淬滅基團,激活的Cas13a除了進行靶RNA特異性切割外還“附帶切割”RNA熒光報告分子,隨著熒光基團和淬滅基團之間的連接RNA鏈斷裂而發出熒光,而通過檢測熒光信號即可進行特定核酸檢測。該研究顯示,檢測1~10 pmol /L的靶RNA可在30 min內產生十分明顯的核酸降解信號,但pmol /L級別的檢測靈敏度不能滿足臨床檢測需求,因此僅引入RNA熒光報告分子仍不夠,還需要更多的設計策略來提高檢測的靈敏度。
2017年,張峰研究團隊[28]設計研發出基于CRISPR/Cas13系統的特異性高靈敏度酶報告解鎖(Specific high-sensitivity enzymatic reporter unlocking,SHERLOCK)技術(圖6)。該技術除了加入RNA熒光報告分子,還進行了重組酶聚合酶擴增(Recombinase polymerase amplification,RPA),即對靶DNA或RNA進行RPA或RT-RPA擴增,擴增后的DNA產物用T7核糖核酸聚合酶轉錄為RNA,然后在crRNA引導下激活Cas13a, 激活的Cas13a切割RNA熒光報告分子從而能檢測到熒光信號。SHERLOCK技術能夠檢測到amol /L級(10-18mol/L)濃度的RNA或DNA,實現了單分子靈敏度和單堿基特異性檢測。而且SHERLOCK所用檢測試劑可凍干制備成濾紙片,成本低廉,使用方便,非常適用于即時檢測。研究發現,SHERLOCK具有多種功能:(1)短時間內檢測患者血液或尿液樣本中Zika病毒的存在并區分非洲和美國Zika病毒株的基因序列;(2)識別特定的細菌類型,如大腸桿菌;(3)檢測抗生素耐藥性基因;(4)在模擬的游離DNA中識別癌癥突變;(5)識別人基因組上的SNP。雖然SHERLOCK具有高靈敏度和高特異性,但檢測通量低且不能定量。為了進一步提升SHERLOCK的性能,2018 年張峰研究團隊[29]對SHERLOCK技術進行了優化升級,稱之為第二代SHERLOCK(SHERLOCKv2)。第一代SHERLOCK只能每次檢測一種核酸序列,但SHERLOCKv2一次分析可同時提供多達4種不同目標的熒光信號,可同時測試多個目標。除了檢測目標數量的升級外,SHERLOCKv2也使用了額外的CRISPR相關酶(Csm6)來放大其檢測信號,從而使得靈敏度提高了100倍。SHERLOCKv2還能夠進行定量測定,檢測限可低至2 amol/L。SHERLOCKv2有效解決了第一代SHERLOCK檢測通量低、不能定量的問題,而且檢測時使用了側向層析試紙條檢測,使檢測更加便捷。雖然SHERLOCK技術使檢測擺脫了設備及人員的局制,但檢測樣本遺傳物質提取成為即時檢測的限制因素,同年,張鋒研究團隊[30]研發了一種加熱未提取診斷樣品以消除核酸酶(Heating unextracted diagnostic samples to obliterate nucleases,HUDSON)的方法,該方法僅需對臨床樣本進行核酸酶滅活和加熱等快速處理,即可進行SHERLOCK反應,而且2 h內便可肉眼觀測結果,如在全血、血清和唾液的病毒檢測中,以極高的靈敏度(1 copy/μL) 檢測并區分出4種DENV血清型以及地區性ZIKV毒株。
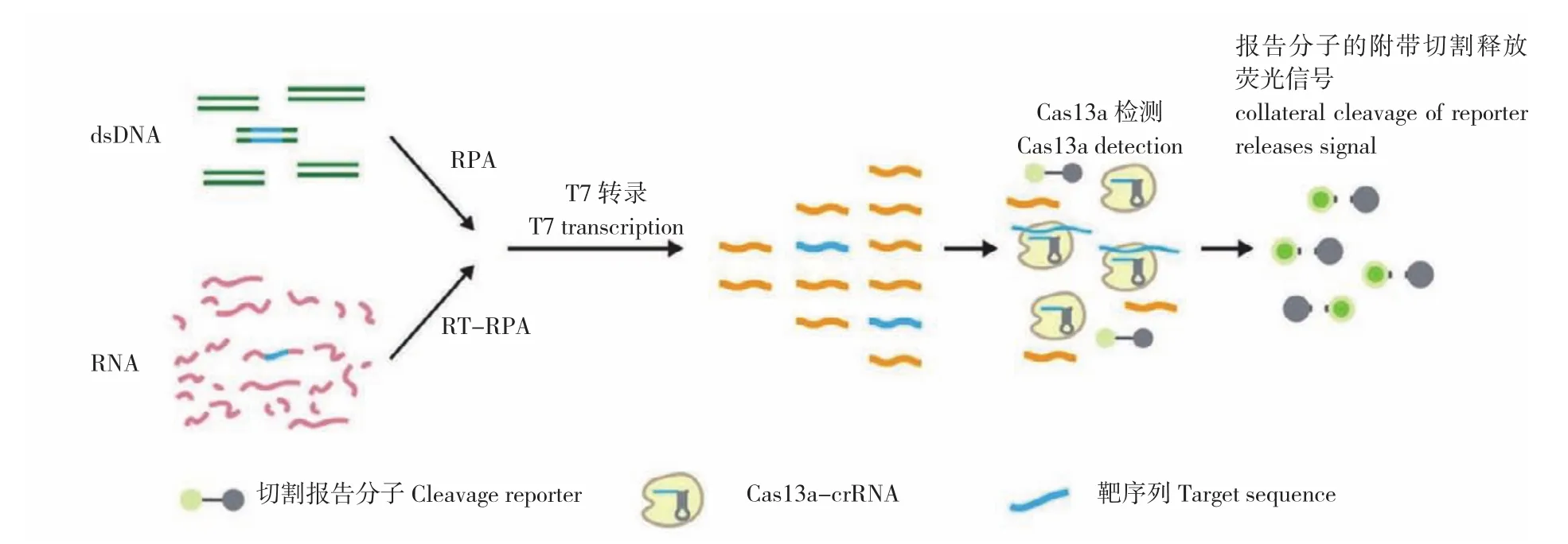
圖6 基于CRISPR/Cas13的SHERLOCK核酸檢測示意圖[25]Fig. 6 Schematic diagram of SHERLOCK nucleic acid detection based on CRISPR/Cas13[25]
4 CRISPR/Cas13系統在核酸檢測中的應用
CRISPR/Cas13系統能特異切割靶ssRNA,且具有非特異性的“附帶切割”能力[4],這些優良特性以及SHERLOCK技術的產生和發展為CRISPR/Cas13系統在核酸檢測領域的應用提供了技術支撐和設計思路。
4.1 CRISPR/Cas13系統在病原體檢測中的應用
Chang等[31]利用基于CRISPR/Cas13的SHERLOCK技術在37℃下成功檢測了豬繁殖與呼吸綜合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV),檢測限為172 copies/μL,而且與豬圓環病毒2型、豬細小病毒、豬瘟病毒、偽狂犬病病毒無交叉反應。Liu等[32]以H7N9的HA基因的體外轉錄RNA為靶點設計特異性crRNA,與RT-RPA和T7轉錄系統結合,成功建立了基于CRISPR/Cas13a的H7N9快速檢測方法。此外,CRISPR/Cas13系統也成功用于EB病毒[33]、埃博拉病毒[34]等的準確、快速檢測。最近的新型冠狀病毒SARS-CoV-2疫情給全人類的健康帶來了巨大沖擊。張峰[35]使用合成的2019-nCoV RNA片段,設計并測試了兩種crRNA,每種crRNA均能特異性識別2019-nCoV的一種特征性核酸片段,通過基于CRISPR/Cas13的SHERLOCK技術,可以檢測出僅10~100 copies/μL的病毒。2020年2月,張峰研究團隊[36]向全球公布了該技術的詳細操作流程,為方便快速準確地檢測新型冠狀病毒感染者提供了有力的技術支撐。Patchsung等[37]使用SHERLOCK技術對154個鼻咽和咽喉拭子樣本的SARS-CoV-2進行檢測,在每個反應42個RNA拷貝的檢測限內,熒光讀數法100%特異和100%敏感,而用側流層析法是為100%特異和97%敏感。為了能同時測試多個病原體,Ackerman等[38]開發了可同時測試多個樣本的核酸多元評價組合陣列反應(Combinatorial arrayed reactions for multiplexed evaluation of nucleic acids,CARMEN),CARMEN和Cas13檢測結合(CARMEN-Cas13)使用,可以在單個陣列上對4 500多個crRNA目標進行可靠的測試,并且實現了對甲型流感病毒的全面分型。
CRISPR/Cas13系統不僅成功應用于病毒檢測,還可檢測食品和臨床樣本中少量病原菌。Shen等[39]將核酸變構探針和CRISPR/Cas13a組合,研發了APC-Cas檢測系統,該系統能特異靈敏地定量檢測牛奶等各類樣品中的腸炎沙門氏菌細胞,而且還可以識別小鼠血清中低數量的腸炎沙門氏菌細胞,將早期和晚期感染的小鼠與未感染的小鼠區分開。Zhou等[40]開發了一種基于CRISPR/Cas13a的細菌檢測(CRISPR/Cas13a-based bacteric detection,CCB)方法,能夠特異檢測到低至100 amol/L的金黃色葡萄球菌基因組DNA,其性能與傳統的培養計數法相當,但檢測時間短且靈敏度高。
4.2 CRISPR/Cas13系統在耐藥突變檢測中的應用
除了病原體的檢測,CRISPR/Cas13系統在耐藥突變檢測方面也發揮了重要作用。Wang等[41]建立了一種基于PCR的CRISPR/Cas13a檢測系統(PCR-CRISPR),可用于乙型肝炎病毒(HBV)及其YMDD(酪氨酸-蛋氨酸-天冬氨酸)耐藥突變的檢測,每次可檢測到1個拷貝,對臨床上低水平的HBV DNA和耐藥突變的檢測具有重要價值。此外,Ackerman等[38]通過CARMEN結合Cas13檢測實現了對數十種HIV耐藥突變的多重鑒定。
4.3 CRISPR/Cas13系統在物種識別和轉基因鑒定中的應用
準確的物種識別是生態學研究和監測基本的方面,也是農業生產中必須明確的重要部分。Baerwald等[42]使用基于 CRISPR/Cas13的 SHERLOCK 技術,成功鑒定了3種現場極易被誤認的魚類物種,充分證明SHERLOCK技術能夠實現高度精確的物種分類鑒定。轉基因生物及其產品的有效識別是農業轉基因生物產業鏈條全過程監管的有效保障。張峰研究團隊[43]成功利用基于CRISPR/Cas13的SHERLOCK技術在30 min內即可檢測出轉基因大豆中的抗草甘膦基因,并能對大豆混合物中抗草甘膦基因的水平進行量化。
4.4 基于CRISPR/Cas13的核酸檢測技術存在的問題
相對于傳統的PCR技術,基于CRISPR/Cas13的核酸檢測技術具有更高的靈敏度,更好的特異性,而且無需昂貴設備和專業操作人員,方便快捷,成本低廉,因此成為生物檢測領域的耀眼新星[1,44-45]。然而,目前所使用的基于CRISPR/Cas13系統的核酸檢測技術還存在一些不足,主要體現在以下方面:(1)基于CRISPR/Cas13系統的核酸檢測技術一般需使用RNA熒光報告探針,但RNA容易降解,致使可能出現假陽性的檢測結果;(2)DNA或RNA的有效獲取是核酸檢測的基礎,簡便快捷無需依靠儀器即可有效獲取DNA或RNA,是CRISPR/Cas13核酸檢測技術能在即時檢測中應用的保障,因此,需要進一步開發特別是針對植物或動物組織DNA或RNA 的簡便獲取技術;(3)由于單獨使用Cas13檢測的靈敏度偏低,基于CRISPR/Cas13的核酸檢測技術一般需要兩個反應步驟,第一個步驟是擴增反應,第二個步驟是將擴增的樣本加入到包含Cas13蛋白和其他反應試劑的試管中進行檢測反應,這不但增加了檢測流程的復雜性,而且樣本在轉移步驟可能被污染。因此,需要進一步開發更為簡便的檢測手段,讓擴增RNA或DNA的步驟和Cas13蛋白檢測的化學反應能夠在同一個試管中進行,或挖掘更多新型Cas并建立更為簡單高效的無需擴增的CRISPR/Cas檢測方法。
5 展望
基于CRISPR/Cas13系統的核酸檢測技術的靈敏性和特異性非常突出,已經達到amol/L甚至zmol/L的范圍,并能檢測點突變[29],這必將在核酸檢測領域發揮舉足輕重的作用。對于檢測速度,最快的分析(如SHERLOCKv2)至少需要15 min[29],以后可以通過鑒定新的Cas蛋白和工程改造已存在的Cas蛋白,以及優化信號放大系統,以進一步提高檢測速度。基于CRISPR/Cas13系統的核酸檢測技術使用了無需核酸提取的病原體檢測(HUDSON)[30]、等溫擴增以及試紙條檢測,為了檢測更加便捷,今后應發展一步診斷法,包括病原體核酸釋放、預擴增、CRISPR-Cas誘導反應和信號讀出等。未來還可以將人工智能(Artifificial intelligence,AI) 與 CRISPR-Cas13診斷測試相結合,構建一個快速、準確和更智能的感染性病原體診斷預警系統。
隨著CRISPR/Cas系統在細菌、古菌和細菌大病毒中的不斷發現,基于CRISPR/Cas系統的核酸檢測技術得以不斷豐富發展。如CRISPR基因編輯先驅蛋白Cas9,失去切割活性的變體dCas9也可被固定在石墨烯納米材料上,成為核酸檢測芯片[46]。Cas phi是新近發現的具有功能的最小分子量的Cas12類蛋白,識別和切割dsDNA被激活后,同樣具有ssDNA附帶切割活性[47]。因此以CRISPR/Cas系統為基礎的核酸檢測技術,必將彌補以PCR為基礎的傳統核酸檢測技術的不足,在醫學、農業和食品等領域發揮重要作用。

