乳腺癌術后輔助化療對循環腫瘤細胞影響的觀察研究
孫曉瑩 馬飛 田朋飛 李曉爽 朱愛華 王津京

【摘要】 目的:本研究旨在觀察乳腺癌術后輔助化療后外周血循環腫瘤細胞陽性率及含量的變化,評價術后輔助化療的有效性。方法:選取2015年11月-2016年8月本院收治的10例擬行術后輔助化療的乳腺癌患者,分別于輔助化療前后采集外周靜脈血3~5 ml,通過免疫磁珠法及免疫熒光顯色法檢測樣品中循環腫瘤細胞,對比分析化療前后CTCs的檢出率、含量及變化趨勢。結果:術后輔助化療前后CTCs的檢出率分別為80%(8/10)、60%(6/10),平均CTCs含量分別為2.1(1.5,3.25)ml和0.7(0.0,1.0)ml,輔助化療后外周靜脈血中CTCs的含量較化療前有減少趨勢,差異有統計學意義(P=0.026)。結論:乳腺癌術后輔助化療可減少患者外周血CTCs的含量。乳腺癌患者術后輔助化療前后外周血CTCs含量檢測結果對預測、評估近期治療療效重要指導價值。
【關鍵詞】 乳腺癌 循環腫瘤細胞 輔助化療
doi:10.14033/j.cnki.cfmr.2020.26.005 文獻標識碼 A 文章編號 1674-6805(2020)26-00-04
The Value of Adjuvant Chemotherapy for Postoperative Breast Cancer on Circulating Tumor Cells/SUN Xiaoying, MA Fei, TIAN Pengfei, LI Xiaoshuang, ZHU Aihua, WANG Jinjing. //Chinese and Foreign Medical Research, 2020, 18(26): -17
[Abstract] Objective: To analyse the changes in the content of circulating tumor cells in peripheral blood after adjuvant chemotherapy for postoperative breast cancer and to evaluate the effectiveness of chemotherapy. Method: Ten cases of postoperative breast cancer patients accepted adjuvant chemotherapy was collected from November 2015 to August 2016 in our hospital. Peripheral venous blood was taken before and after adjuvant chemotherapy. Contents of circulating tumor cells in the sample was detected by immunofluorescent staining. The detection rate and change trend of CTCs before and after chemotherapy were compared and analyzed. Result: Rates of CTCs detection before and after adjuvant chemotherapy were 80% (8/10) and 60% (6/10), and the average numbers of CTCs were 2.1 (1.5, 3.25) ml and 0.7 (0.0, 1.0) ml respectively. The contents of CTCs detected in peripheral venous blood after adjuvant chemotherapy decreased compared with that before chemotherapy, and the difference was statistically significant (P=0.026). Conclusion: Adjuvant chemotherapy can reduce the number of CTCs in peripheral blood of patients with postoperative breast cancer. Meanwhile content numbers of peripheral blood CTCs before and after adjuvant chemotherapy in breast cancer patients are valuable in predicting and evaluating adjuvant therapeutic efficacy.
[Key words] Breast cancer Circulating tumor cells Adjuvant chemotherapy
First-authors address: Beijing Chaoyang District Huanxing Cancer Hospital, Beijing 100021, China
乳腺癌是發病率最高的女性惡性腫瘤,隨著手術、化療、放療等治療手段的綜合應用,其治愈率有了很大的提高,但仍有20%~30%乳腺癌會出現復發和轉移,最終導致患者死亡[1-2]。腫瘤細胞可直接或經淋巴途徑間接進入血液系統,進而在遠處組織器官定植形成轉移灶,這部分來自腫瘤原發灶或轉移灶播散進入血液的腫瘤細胞被稱為循環腫瘤細胞(circulating tumor cells,CTCs)。CTCs的出現被認為可能是腫瘤遠處轉移的一種標志,與乳腺癌臨床預后有密切關系[3-6]。而且,CTCs的檢測作為液體活檢的一種重要方式,具有創傷小、可連續檢測等優勢,促進了相關領域的快速發展。目前諸多關于CTCs的研究更著重于癌癥的早診早篩、評估預后、早期發現腫瘤轉移及指導晚期腫瘤個體化治療等。但對于早期手術及輔助治療的乳腺癌患者,缺乏評價輔助治療效果的腫瘤標記物。本研究通過對乳腺癌患者術后輔助化療前后血液中循環腫瘤細胞含量的檢測,探討CTCs動態變化與輔助化療效果的關系及對乳腺癌患者的臨床意義。
1 資料與方法
1.1 一般資料
選擇2015年11月-2016年8月中國醫學科學院腫瘤醫院桓興病區腫瘤內科收治的乳腺癌患者10例,均已接受手術治療,擬行術后輔助化療。納入標準:(1)首次行手術切除治療,經組織病理學檢查確診為浸潤性乳腺癌;(2)臨床病理資料完整;(3)未接受任何輔助治療;(4)HER2基因均為陰性。排除標準:(1)已發生遠處轉移;(2)妊娠期;(3)合并其他系統惡性腫瘤;(4)合并嚴重心肺疾病;(5)依從性差,不能按方案輔助化療。患者年齡33~52歲,平均41.1歲。本研究經醫院醫學倫理委員會審批通過,所有患者均對本研究知情并簽署知情同意書。
1.2 方法
本研究患者接受表柔比星+環磷酰胺,序貫紫杉醇的密集化療方案(1例多西他賽+卡鉑化療方案化療)。術后腫瘤組織雌激素受體(ER)、孕激素受體(PR)及Ki-67的表達情況采用免疫組化SP法檢測;人表皮生長因子受體2(HER2)采用免疫組織化學法(IHC)及原位熒光雜交技術(FISH)檢測。根據美國臨床腫瘤學會和美國病理學家學會公布的乳腺癌指南評估ER/PR/HER2表達狀況。按照美國癌癥聯合會(American Joint Commission on Cancer,AJCC)2018年第8版乳腺癌TNM分期標準進行分期。
使用EDTA抗凝采血管分別于輔助化療前后采集患者3~5 ml外周血,留取2 ml有效血液樣本。本檢測針對外周血液中循環腫瘤細胞(CTC)測試流程如下:將特異性識別CTC表面的上皮細胞黏附分子(EpCAM)的多肽修飾的磁性納米顆粒與血液樣品混合,利用磁力捕獲血液中的CTC,用4%的多聚甲醛室溫下固定細胞,然后通過免疫熒光染色方法對捕獲的細胞進行鑒定。免疫熒光染色為三色標記法,分別為細胞核染色劑(DAPI)、上皮細胞標記物細胞角蛋白(CK)的抗體,以及白細胞抗原(CD45)的抗體。
DAPI可透過細胞膜對DNA染色,它在嵌入雙鏈DNA后發出藍色熒光;異硫氰酸熒光素(FITC)標記的CK抗體與上皮來源的腫瘤細胞表面的CK抗原結合,發出525 nm波長的綠色熒光;藻紅蛋白(PE)標記的人CD45抗體與血液中白細胞表面的CD45抗原結合,發出578 nm波長的紅色熒光。于多肽修飾的磁性納米顆粒富集到的所有細胞進行三色染色,其中DAPI+/CK+/CD45-并且符合細胞形態的細胞指認為循環腫瘤細胞,見圖1。
1.3 觀察指標
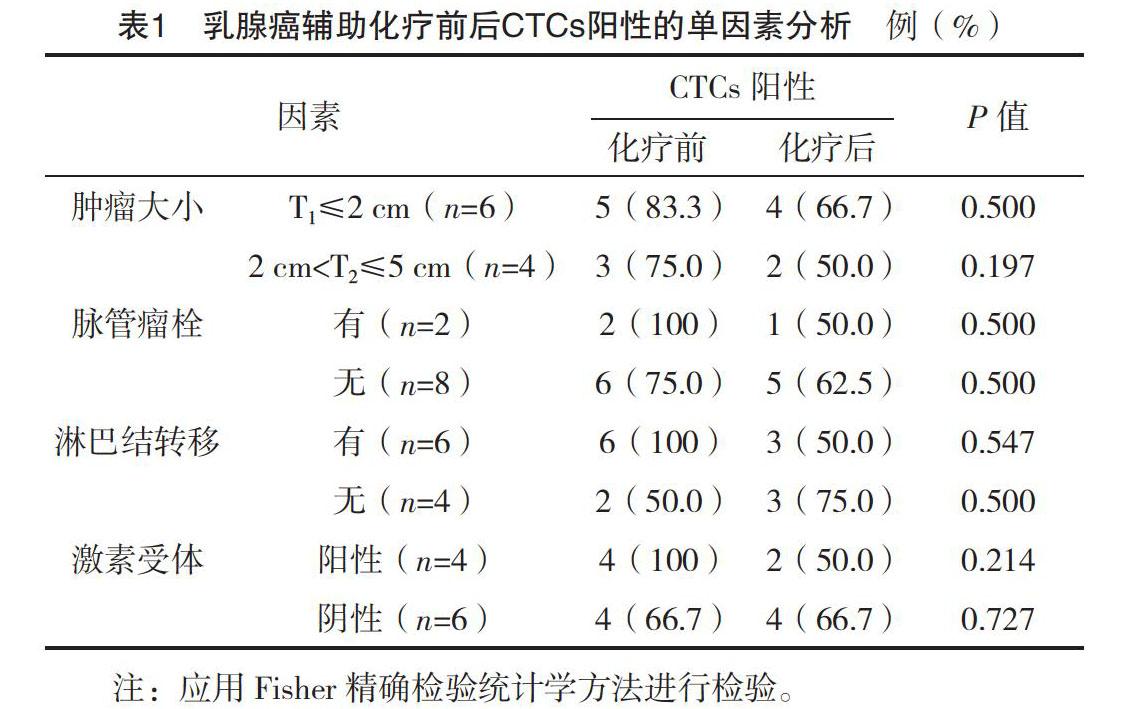
統計輔助化療前后兩組患者CTCs的陽性率(以不同CTCs組相應CTCs≥1個為陽性)及各組患者輔助化療前后CTCs(DAPI+/CK+/CD45-)陽性值,來表示外周血腫瘤細胞含量。通過檢測患者外周血CTCs,分別比較化療前后CTCs陽性率與腫瘤大小、脈管瘤栓、淋巴結轉移情況、激素受體的差異,分析CTCs陽性與臨床病理特征的相關性。
1.4 統計學處理
應用SPSS 25.0統計學軟件對數據進行處理。應用偏度和峰度檢驗對化療前后外周血CTCs含量進行正態分布檢驗,在α=0.05的檢驗水平下,本研究數據不符合正態分布,以M(P25,P75)表示,采用非參數Wilcoxon秩和檢驗;計數資料以率(%)表示,組間比較采用字2檢驗,在適當的情況下采用Fisher精確檢驗進行研究。P<0.05為差異有統計學意義。
2 結果
2.1 術后輔助化療前后CTCs陽性的單因素分析
乳腺癌患者輔助化療前后外周血CTCs與其病理特征差異無統計學意義(P>0.05),乳腺癌輔助化療前后外周血CTCs含量與病理特征無明確相關性,見表1。
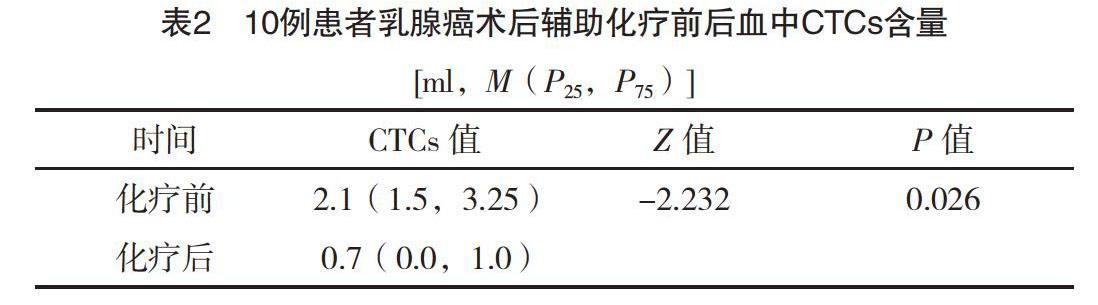
2.2 輔助化療前后患者CTCs含量比較
近些年有關CTCs研究納入的病例數從十幾例到幾百例不等[7-9]。本研究輔助化療前循環腫瘤細胞陽性率(CTCs≥1個)為80%(8/10),平均循環腫瘤細胞含量為2.1(1.5,3.25)ml;輔助化療后循環腫瘤細胞陽性率為60%(6/10),平均循環腫瘤細胞含量為0.7(0.0,1.0)ml,明顯低于化療前,差異有統計學意義(P<0.05),見表2。
3 討論
乳腺癌是一種全身性疾病,30%~40%的初治乳腺癌患者骨髓、靜脈血和常規病理檢查區域淋巴結存在著微轉移,提示微轉移是導致乳腺癌患者術后復發、轉移的重要原因[10]。經手術切除后的乳腺癌患者血液中仍可檢測到循環腫瘤細胞,可能手術會增加腫瘤細胞脫落進入血液的風險[9,11-12],本研究中80%患者手術切除腫瘤后輔助化療前檢測血液循環中檢測到CTCs,輔助化療后CTCs的檢出率降低至60%。比較患者術后輔助化療前后血中CTCs數目,差異有統計學意義(P=0.026)。
血中循環腫瘤細胞一般是指進入機體循環血液中的實體腫瘤細胞,能夠真實反映腫瘤負荷和具有發展為轉移灶的潛力。CTCs在確定診斷、治療決策和監測治療效果中有很重要的作用。研究表明,CTCs的存在對于乳腺癌遠處轉移、生存都是一個獨立的預后指標[13-15]。CTCs實時檢測已被廣泛用于評價乳腺癌的新輔助化療、放療、維持化療等治療手段的有效性,除乳腺癌外,其應用價值同樣在結直腸癌、前列腺癌及非小細胞肺癌等腫瘤中被證實[16-18]。本研究中觀察到術后輔助化療可減少外周血CTCs檢出率和含量,提示了化療的有效性。
與此同時,有研究認為CTCs作為對化療反應的預測,其表型也常隨藥物治療、疾病進程等變化[19-20]。CTCs是一類異質性很強的腫瘤細胞,其中一些為腫瘤干細胞(cancer stem cells,CSCs),另一些被認為是上皮間變細胞(epithelial-mesenchymal transition,EMT),但大多數腫瘤細胞不具有上述特征,相關研究認為CSCs和EMT狀態的腫瘤細胞對化療具有抵抗性,是腫瘤復發及轉移的原因[21-22]。因此,CTCs的檢測需要根據腫瘤細胞生物特性進行分類,從而更精準高效的預測、評估腫瘤治療療效及預后。
綜上所述,本研究結果顯示通過術后輔助化療,患者外周血CTCs檢出率和單位體積的含量減少,初步提示CTCs狀態的變化與化療效果有一定的關系。限于本研究納入研究對象少,因此CTCs在術后輔助化療效果評估中的作用價值仍需大樣本、多中心臨床研究進一步驗證。作為一種新的實時便捷、創傷小的檢測手段,CTCs檢測具有很大的潛力來改變目前癌癥檢測的現狀。然而,CTCs的臨床應用還處于起步階段,存在著諸多問題亟待解決。通過對循環腫瘤細胞生物特性進一步的分類研究和完善CTCs檢測方法,最終使腫瘤患者獲益。
參考文獻
[1] DeSantis C E,Ma J,Gaudet M M,et al.Breast cancer statistics[J].CA Cancer J Clin,2019,69(6):438-451.
[2] Wang P P,Liu S H,Chen C T,et al.Circulating tumor cells as a new predictive and prognostic factor in patients with small cell lung cancer[J].J Cancer,2020,11(8):2113-2122.
[3]馬齊襄,朱曉丹,胡凱文,等.腫瘤轉移的種子與土壤學說新認識[J].腫瘤防治研究,2015,42(10):1049-1053.
[4] Maman S,Edry-Botzer L,Sagi-Assif O,et al.The metastatic microenvironment:lung-derived factors control the viability of neuroblastoma lung metastasis[J].Int J Cancer,2013,133(10):2296-2306.
[5] Wang C H, Chang C J,Yeh K Y,et al.The Prognostic Value of HER2-Positive Circulating Tumor Cells in Breast Cancer Patients:A Systematic Review and Meta-Analysis[J].Clin Breast Cancer,2017,17(5):341-349.
[6] Lv Q, Gong L,Zhang T,et al.Prognostic value of circulating tumor cells in metastatic breast cancer: a systemic review and meta-analysis[J].Clin Transl Oncol,2016,18(3):322-330.
[7] Monterisi S,Castello A,Toschi L,et al.Preliminary data on circulating tumor cells in metastatic NSCLC patients candidate to immunotherapy[J].Am J Nucl Med Mol Imaging,2019,9(6):282-295.
[8] Brown J C,Rhim A D,Manning S L,et al.Effects of exercise on circulating tumor cells among patients with resected stage Ⅰ-Ⅲ colon cancer[J].Plos One,2018,13(10):e0204875.
[9] Hall C,Valad L,Lucci A.Circulating Tumor Cells in Breast Cancer Patients[J].Crit Rev Oncog,2016,21(1):125-139.
[10] Zhang Y, Lv Y, Niu Y, et al. Role of Circulating Tumor Cell (CTC) Monitoring in Evaluating Prognosis of Triple-Negative Breast Cancer Patients in China[J].Med Sci Monit,2017,23(23):3071-3079.
[11] Li S,Yan W, Yang X,et al.Less micrometastatic risk related to circulating tumor cells after endoscopic breast cancer surgery compared to open surgery[J].BMC Cancer,2019,19(1):1070.
[12] Lozar T, Gersak K, Cemazar M,et al.The biology and clinical potential of circulating tumor cells[J].Radiol Oncol,2019,53(2):131-147.
[13] Park H S, Han H J,Lee S,et al.Detection of Circulating Tumor Cells in Breast Cancer Patients Using Cytokeratin-19 Real-Time RT-PCR[J].Yonsei Med J,2017,58(1):19-26.
[14] Wang C H,Chang C J,Yeh K Y,et al.The Prognostic Value of HER2-Positive Circulating Tumor Cells in Breast Cancer Patients: A Systematic Review and Meta-Analysis[J].Clin Breast Cancer,2017,17(5):341–349.
[15] Wu Z X,Liu Z,Jiang H L,et al.Circulating tumor cells predict survival benefit from chemotherapy in patients with lung cancer[J].Oncotarget,2016,7(41):67586-67596.
[16] Obayashi K,Akatsuka J,Endo Y,et al.Initial detection of circulating tumor cells from metastatic prostate cancer patients with a novel small device[J].Prostate Int,2019,7(4):131-138.
[17] Wang D,Yang Y,Jin L,et al.Prognostic models based on postoperative circulating tumor cells can predict poor tumor recurrence-free survival in patients with stage Ⅱ-Ⅲ colorectal cancer[J].J Cancer,2019,10(19):4552-4563.
[18] Yamauchi Y,Safi S,Blattner C,et al.Circulating and Tumor Myeloid-derived Suppressor Cells in Resectable Non-Small Cell Lung Cancer[J].Am J Respir Crit Care Med,2018,198(6):777-787.
[19] Kraan J,Sleijfer S,Foekens J A,et al.Clinical value of circulating endothelial cell detection in oncology[J].Drug Discov Today,2012,17(13):710-717.
[20] Danova M,Comolli G,Manzoni M,et al.Flow cytometric analysis of circulating endothelial cells and endothelial progenitors for clinical purposes in oncology: A critical evaluation[J].Mol Clin Oncol,2016,4(6):909-917.
[21] Cheng Y H,Chen Y C,Lin E,et al.Hydro-Seq enables contamination-free high-throughput single-cell RNA-sequencing for circulating tumor cells[J].Nat Commun,2019,10(1):2163.
[22] Lin E,Rivera-Báez L,Fouladdel S,et al.High-Throughput Microfluidic Labyrinth for the Label-free Isolation of Circulating Tumor Cells[J].Cell Syst,2017,5(3):295-304.
(收稿日期:2020-06-08) (本文編輯:何玉勤)

