3,8′-聯芹菜苷元通過抑制氧連接氮乙酰葡糖胺轉移酶(OGT)降低HeLa細胞遷移侵襲潛能
劉 欣,張娜娜,曹 禺,朱 彤,李文利,張嘉寧,劉宇博
(大連理工大學,生命科學與藥學學院,遼寧 盤錦 124000)
蛋白質的氧連接氮乙酰葡糖胺(O-GlcNAc)修飾是一種廣泛存在于哺乳動物細胞內的翻譯后修飾,是一種非經典的糖基化,其底物蛋白為細胞質和細胞核中的可溶蛋白。不同于復雜的細胞膜蛋白聚糖修飾,O-GlcNAc糖基化是一種發生在底物蛋白絲/蘇氨酸殘基上的單糖修飾[1]。與磷酸化修飾類似,O-GlcNAc修飾是動態變化的過程[2]:糖基供體尿苷二磷酸氮乙酰葡糖胺(UDP-GlcNAc)在氧連接氮乙酰葡糖胺轉移酶(O-linked N-acetylglucosamine transferase, OGT)的催化作用下連接到底物蛋白上,完成O-GlcNAc修飾;而在對應糖苷酶(OGA)的作用下,O-GlcNAc從蛋白質的肽鏈上水解,完成去糖基化[3]。OGT活性的異常對是包括癌癥在內的多種慢性疾病的共同特征。已有大量研究表明,OGT催化的O-GlcNAc[4-6]糖基化異常與腫瘤細胞代謝重編程介導的快速增值和遷移侵襲密切相關[7]。因此,抑制OGT酶活性帶來的O-GlcNAc修飾降低將有望抑制腫瘤細胞增殖和轉移,用于多種腫瘤的治療[8-9]。
目前,已報道的OGT小分子抑制劑主要包括四氧嘧啶類化合物、氮乙酰半乳糖胺衍生物、OSMI-1(喹啉酮-6-黃酰胺衍生物)、苯并惡唑啉酮衍生物[10-11],以及本課題組前期報道的四氫穗花杉雙黃酮(tetrahydroamen-toflavone)[12]。其中,天然產物類四氫穗花杉雙黃酮顯示出較低的IC50值,且具有細胞毒性小的優勢。在此基礎上,本研究進一步分析了四氫穗花杉雙黃酮的天然產物類似物,分析其與OGT的結合能和細胞外OGT抑制活性。通過細胞內及外活性檢測[13],均確認3,8′-聯芹菜苷元(3,8′-Biapigenin)具有優于四氫穗花杉雙黃酮的OGT抑制活性,可通過抑制HeLa細胞的O-GlcNAc修飾,降低腫瘤細胞的遷移侵襲潛能。且有研究表明確實有相關藥物,例如噻吩取代長鏈查爾酮可抑制腫瘤細胞的增殖[4]。
1 材料與方法
1.1 材料
1.1.1細胞 人宮頸癌細胞系HeLa,購自中科院上海細胞庫。
1.1.2軟件及數據庫 分子對接與結合能分析軟件Discovery Studio 4.5(Accelrys Software公司,美國),化學結構式繪制軟件Chembiodraw 15.0(Cambridgesoft公司,美國),蛋白質結構數據庫(PDB)。
1.1.3試劑 氧連接氮乙酰葡糖胺轉移酶(OGT)多肽底物(CKII肽,氨基酸序列為KKKYPGGSTPVSSANMM,強耀公司,#04010026647,中國),四氫穗花杉雙黃酮及其類似物(ChemFaces,#48236-96-0,中國),二甲基亞砜(DMSO,Sigma公司,#67-68-5,美國)和尿苷二磷酸氮乙酰葡糖胺(UDP-GlcNAc,Sigma公司, 91183-98-1,美國),O-GlcNAc抗體(RL2,Abcam公司,#ab2739,英國),OGT活性分析試劑盒(Promega公司,#V6961,美國),其它化學試劑為國產分析純。
1.1.4儀器 二氧化碳細胞培養箱、Nanodrop型微量分光光度儀、Pico17型高速低溫離心機(Thermo Fisher公司,美國),FluorChem HD2型化學發光成像儀(伯樂公司,美國),Synergy H1型全功能熒光酶標儀(BioTek公司,美國)。
1.2 方法
1.2.1四氫穗花杉雙黃酮類似物與OGT結合能分析 利用Discovery Studio 4.5對受體OGT(Protein Bank Database,3PE4)晶體結構進行優化,從而達到去水加氫等目的;分別將候選化合物利用Discovery Studio 4.5軟件中Libdock模塊進行以OGT為受體的剛性分子對接,得到由Libdock計算所得的受體與配體結合自由能;使用C-Docker模塊再次對接,輸出半柔性對接條件下的受體與配體結合自由能;對兩種對接方式所得結果按平均值進行排序,使用聚類分析算法獲得最終的候選分子。
1.2.23,8′-聯芹菜苷元分子動力學模擬分析 使用Discovery Studio 4.5軟件對3,8′-聯芹菜苷元進行能量最優處理,利用分子對接結果中OGT與3,8′-聯芹菜苷元的結構,以OGT/UDP的X射線晶體結構(3PE4)為模板,去除UDP結構和晶體中的水分子,以OGT蛋白分子脯氨酸(Pro)559為中心,建立活性中心。并調節相應大小,以覆蓋UDP和OGT的結合位置。使用Discovery Studio 4.5軟件中分子動力學模擬模塊對分子對接結構進行預處理后賦予Amber立場,模擬發生體系在pH 7.4環境下,設定分子動力學優化的采樣區間為10 ns,輸出優化的結構。
1.2.3OGT活性細胞外活性測定 使用高效液相色譜法(HPLC法)分析四氫穗花杉雙黃酮及其類似物對OGT活性的抑制作用。將200 μmol·L-1的FAM熒光標記的OGT底物多肽CKII肽(FAM-KKKYPGGSTPVSSANMM),1 mmol·L-1的UDP-GlcNAc,100 nmol·L-1的人源OGT蛋白,12.5 mmol·L-1MgCl2,緩沖體系(150 mmol·L-1NaCl,1 mmol·L-1EDTA,2.5 mmol·L-1三羥丙基膦,20 mmol·L-1Tris-HCl,pH 7.4)的反應混合物和候選小分子在37 ℃孵育30 min后,加入等體積的甲醇終止反應,將反應混合物以10 000×g離心10 min。將上清液(40 μL)加載到Agilent 1260 Infinity HPLC系統上,使用熒光檢測器以基于糖肽產物和肽底物的積分面積定量分析產物得率。使用Zorbax SB-C18 StableBond為分析柱(4.6 mm×250 mm,5 μm;Agilent)。流動相A為質量分數為0.1% TFA水溶液,流動相B為質量分數為0.1% TFA的乙腈溶液。液相使用梯度洗脫組分(流速為1 mL/min;0 min洗脫溶劑混合物A/B=90/10;20 min洗脫溶劑混合物A/B=70/30)。每個反應重復2次或3次后,利用GraphPad 5計算IC50值。
在無細胞反應體系中檢測體外OGT酶活,使用OGT活性分析試劑盒檢測候選分子對OGT酶活的抑制情況。多肽底物為無標記的CKII肽(KKKYPGGSTPVSSANMM),于黑色96孔板進行,反應體系組成為250 mmol·L-1的OGT,125 μmol·L-1的CKII,40 μmol·L-1的UDP-GlcNAc,其它反應試劑和步驟參照試劑盒說明書,使用GraphPad 5計算IC50值。
1.2.4細胞培養 HeLa細胞使用含質量分數為10%胎牛血清,質量分數為1%青/鏈霉素的RPMI-1640培養基在37 ℃,飽和濕度的質量分數為5% CO2培養箱中常規培養并傳代。
1.2.5Western blot及凝集素印跡實驗 使用候選小分子處理細胞相應時間后,收集5×106的HeLa細胞,使用Western細胞裂解液提取總蛋白,Nanodrop蛋白定量后,利用質量分數為10%的SDS-PAGE電泳分析總蛋白樣品,然后濕法轉膜(PVDF膜)。利用BSA封閉液室溫封閉2 h后,使用1 ∶1 000的抗體或凝集素在4 ℃條件下孵育過夜,PVDF膜洗滌3次,每次5min,在室溫條件下使用二抗(1 ∶5 000)中孵育1 h,洗滌3次后,使用化學發光檢測試劑進行顯色反應。
1.2.6細胞劃痕實驗 將1×106的HeLa細胞并接種到6孔板中,細胞貼壁生長近滿后劃痕,PBS洗3次,更換無血清培養基繼續培養加入候選小分子抑制劑,使用DMSO作為對照,繼續培養相應時間使用顯微鏡觀察劃痕愈合情況。
1.2.7Transwell侵襲實驗 將Matrigel基質膠與RPMI 1640培養基按1 ∶5比例混勻后加入Transwell小室底部,取5×105個HeLa細胞接種于Transwell上室(200 μL無血清培養基),下室內加入500 μL完全培養液。將相應濃度的候選小分子抑制劑加入上室內,繼續培養48 h,以DMSO為對照。使用質量分數為4%多聚甲醛固定上室細胞10 min,使用結晶紫染料染色30 min。PBS洗滌后使用棉簽擦去小室上層細胞,利用倒置顯微鏡觀察小室下層細胞,統計侵襲細胞數目。
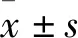
2 結果
2.1 3,8′-聯芹菜苷元具有OGT體外抑制活性選取10個已知OGT小分子抑制劑四氫穗花杉雙黃酮(tetrahydroamentoflavone)的類似物分子(Fig 1A),依據OGT與天然底物的結合模式,利用兩種對接方式Lib-Dock(剛性對接)和C-Docker(半柔性對接)。結合能力情況如Fig 1B所示,其中結合能力3,8′-聯芹菜苷元在候選分子中具有優于四氫穗花杉雙黃酮的結合能。OGT活性分析試劑盒檢測表明所有候選分子在50 μmol·L-1濃度下均具有不同程度的OGT抑制活性,其中3,8′-聯芹菜苷元可抑制OGT活性超過82%(Fig 1C)。
2.2 3,8′-聯芹菜苷元結合在OGT的底物結合口袋為了進一步闡釋3,8′-聯芹菜苷元抑制OGT的作用機制,使用分子動力學模擬優化3,8′-聯芹菜苷元與OGT(3PE3)的分子對接結果,經20 ns優化后,輸出結構穩定狀態構象,聚類后挑選最大聚類的典型構象。該構象在20 ns的模擬軌跡中的頻率約為60.8%。Fig 2A和Fig 2B給出3,8′-聯芹菜苷元與OGT底物結合口袋結合的穩定狀態構象,其中3,8′-聯芹菜苷元的B環與His920和Gln839形成兩個較穩定的氫鍵相互作用,C環羥基與His920形成較穩定的氫鍵相互作用,D環與Thr922形成較穩定的氫鍵相互作用,E環羥基與Ala896和Phe837形成2個較穩定的氫鍵相互作用。同時3,8′-聯芹菜苷元與OGT活性口袋處的Met501、His498、Lys634、Thr633、His901、Asn838、His558殘基形成一個范德華力網。這些穩定的相互作用,使得3,8′-聯芹菜苷元能夠穩定結合在OGT活性口袋內。

Fig 2 Binding model analysis of 3,8′-Biapigenin and OGTA:Binding pose of 3,8′-Biapigenin with OGT after molecular dynamics simulation;B:Analysis of binding model of 3,8′-Biapigenin and OGT.
2.3 3,8′-聯芹菜苷元OGT抑制活性優于四氫穗花杉雙黃酮使用HPLC法[15]分析3,8′-聯芹菜苷元和四氫穗花杉雙黃酮對OGT活性的抑制作用 (Fig 3A),結果顯示加入候選分子相比與對照OGT單獨反應1 h,9 min出現的產物峰明顯減弱,相應在18 min的底物峰增強,證明候選分子均能抑制OGT將CKII肽糖基化反應。但由結果圖可見,3,8′-聯芹菜苷元作用1 h的產物峰明顯低于四氫穗花杉雙黃酮作用組,且底物峰呈相反趨勢,證明在相同反應時間內,3,8′-聯芹菜苷元具有優于四氫穗花杉雙黃酮的OGT抑制活性。進一步使用0.025 μmol·L-1~400 μmol·L-1的濃度梯度的3,8′-聯芹菜苷元作用于OGT無細胞反應體系,結果顯示3,8′-聯芹菜苷元對OGT抑制呈濃度依賴特征,計算3,8′-聯芹菜苷元對OGT的半數抑制濃度(IC50)值為12.88 μmol·L-1(Fig 3B),優于文獻報道的四氫穗花杉雙黃酮21.8 μmol·L-1的IC50值。
2.4 3,8′-聯芹菜苷元有效抑制細胞內OGT活性為了進一步研究3,8′-聯芹菜苷元在活細胞中的OGT抑制活性,使用25 μmol·L-1~200 μmol·L-1的3,8′-聯芹菜苷元處理HeLa細胞24 h,Western blot檢測細胞內OGT催化的蛋白質O-GlcNAc修飾變化情況。結果表明隨著3,8′-聯芹菜苷元濃度的增加,O-GlcNAc修飾呈現減少趨勢(Fig 4A)。使用100 μmol·L-1的3,8′-聯芹菜苷元處理HeLa細胞6~24 h,細胞內糖基化修飾水平隨時間延長逐漸降低(Fig 4B),證明3,8′-聯芹菜苷元可以時間和濃度梯度方式抑制HeLa細胞內的OGT活性。使用凝集素半刀豆球蛋白A(concanavalin A, ConA)和野豌豆凝集素(fluorescein labeled vicia villosa lectin, VVL)檢測100 μmol·L-1的3,8′-聯芹菜苷元處理24 h后的HeLa細胞蛋白質N-聚糖和O-聚糖修飾(Fig 4C),未見明顯改變,證明其它聚糖結構不受3,8′-聯芹菜苷元影響。
2.5 3,8′-聯芹菜苷元抑制HeLa細胞遷移侵襲潛能50 μmol·L-1~100 μmol·L-1的3,8′-聯芹菜苷元處理HeLa細胞48 h能夠明顯抑制細胞劃痕愈合(Fig 4D)。Transwell細胞侵襲實驗結果表明,100 μmol·L-1的3,8′-聯芹菜苷元和四氫穗花杉雙黃酮處理48 h均能有效抑制HeLa細胞的侵襲潛能(Fig 4E)。這些結果表明3,8′-聯芹菜苷元能夠抑制細胞內的OGT,通過降低胞內O-GlcNAc糖基化修飾抑制腫瘤細胞遷移侵襲潛能。

Fig 4 3,8′-Biapigenin inhibited OGT activity in HeLa cells and effect of 3,8′-Biapigenin on HeLa cell invasiveness and migration capabilityA:Western blot of HeLa cell lysates after 3,8′-Biapigenin treatment at different doses(0~200 μmol·L-1) for 24 h;B:Western blot of HeLa cell lysates after 3,8′-Biapigenin treatment at 100 μmol·L-1 for indicated times;C:Lectin blot of HeLa cell lysates after 3,8′-Biapigenin treatment at 100 μmol·L-1 for 24 h.D:Results of HeLa cells wound scratch assay after 50~100 μmol·L-13,8′-Biapigenin treatment,**P<0.01 vs invasion assays showed the invasion ability of HeLa cells treated with 100 μmol·L-13,8′-Biapigenin and Tetrahydroamentoflavone for 48 h,**P<0.01 vs

Fig 3 3,8′-Biapigenin inhibited OGT in an enzyme-based assayA:Inhibitory effect of 3,8′-Biapigenin and Tetrahydroamentoflavone on OGT activity by using HPLC method;B:3,8′-Biapigenin inhibited OGT activity in a dose-dependent manner.
3 討論
針對腫瘤的研究表明,腫瘤細胞糖基化修飾的異常是腫瘤的分子特征之一。這種改變通常表現為相關糖基轉移酶及其調控的特征性糖鏈結構的表達改變。蛋白質的O-GlcNAc糖基化修飾機制類似于磷酸化,發生在蛋白質的絲氨酸和蘇氨酸殘基上。這種糖基化方式存在于所有高等真核生物的胞核和胞質中,對胞內的多種信號通路具有調節作用,并與幾乎所有細胞生理過程和包括腫瘤在內的多種重大疾病的發生和發展密切相關。由于底物蛋白眾多,O-GlcNAc糖基化修飾被發現參與包括侵襲轉移在內的多種腫瘤生物學行為的調控。與受到數百個激酶調控的磷酸化修飾不同,胞內僅有一種OGT酶調控這一修飾過程。OGT的功能是將糖基供體UDP-GlcNAc的N乙酰葡糖胺部分共價連接到蛋白質上。因此,抑制OGT的活性將能夠調控胞內蛋白的O-GlcNAc修飾。
本文通過基于結構的分子對接方法,分析了多個已報道的OGT天然產物抑制劑四氫穗花杉雙黃酮的類似物與OGT的結合能,這些化合物親和力各異,其中3,8′-聯芹菜苷元具有優于四氫穗花杉雙黃酮的結合能和體外OGT抑制活性,故選取該分子作為OGT抑制劑候選分子。通過分子動力學優化,發現3,8′-聯芹菜苷元能夠與受體OGT的底物結合口袋形成5個氫鍵相互作用,并與周圍7個氨基酸殘基形成范德華力網。相比于文獻報道的四氫穗花杉雙黃酮與OGT形成的3個氫鍵作用力外,3,8′-聯芹菜苷元還具備額外4個穩定的氫鍵相互作用。這些相互作用將有利于3,8′-聯芹菜苷元穩定作用于OGT的活性口袋。OGT無細胞反應體系抑制活性結果表明,3,8′-聯芹菜苷元抑制OGT所需的IC50值低于四氫穗花杉雙黃酮,HPLC法結果中也得到了驗證,這些結果與分子對接和動力學優化結果相符。此外,3,8′-聯芹菜苷元表現出較好的細胞內OGT抑制活性。ConA和VVL凝集素印跡結果說明,3,8′-聯芹菜苷元在抑制OGT的同時沒有對其它糖基轉移酶活性造成明顯影響,N-聚糖和O-聚糖修飾沒有明顯變化,證明3,8′-聯芹菜苷元具有較少的脫靶效應。文獻報道,OGT催化的O-GlcNAc修飾參與多種腫瘤細胞遷移侵襲過程[5]。細胞劃痕和Transwell實驗結果表明,3,8′-聯芹菜苷元對OGT活性的抑制能夠明顯抑制HeLa細胞的遷移和侵襲過程,再次證明3,8′-聯芹菜苷元具有細胞內的抑制活性,并影響O-GlcNAc修飾參與的腫瘤細胞轉移過程。
綜上,3,8′-聯芹菜苷元通過與OGT底物口袋結合,抑制細胞內OGT酶活和胞內蛋白的O-GlcNAc修飾,進一步降低腫瘤細胞的遷移侵襲潛能。這些結果為OGT小分子抑制劑和O-GlcNAc修飾功能的研究提供了參考,為治療腫瘤轉移相關研究提供了相關工具,但3,8′-聯芹菜苷元抑制腫瘤轉移作用機制還有待進一步的研究。

