雞矢藤環烯醚萜苷抑制NO-CGMP/PKG信號保護新生大鼠神經元
王 坤,胡才彪,章 成,秦志強,周蘭蘭
(1.安徽醫科大學藥理學教研室,安徽 合肥 230032;2. 深圳職業技術學院醫護學院,廣東 深圳 518055)
疼痛(pain)一直困擾著人類,一氧化氮/環磷酸鳥苷/蛋白激酶G(NO/cGMP/PKG)是體內參與痛覺中樞傳遞作用的重要蛋白通路[1], NO/cGMP/PKG通路的激活能使抑制劑受體磷酸化(如γ-氨基丁酸)而降低其疼痛抑制作用,脊髓興奮性氨基酸釋放增加導致繼發性痛覺過敏,同時促進胞內Ca2+濃度升高,繼而引發一系列胞內過程。不同來源以及不同氧化還原狀態的一氧化氮(nitric oxide,NO)可能具有神經元保護或者損害作用,而過量NO可能通過各種機制導致細胞和組織損傷[2-3]。研究發現,iNOS和nNOS活性神經元主要位于L3-L5脊髓段的背角側和中央管周圍[4]。nNOS在脊髓內表達上調受iNOS調節,可能是維持小鼠慢性周圍神經病理性疼痛的重要因素[5]。我們前期結果及其他研究均表明,cGMP依賴的蛋白激酶PKGI在傷害性感受鏈的發育及脊髓痛覺過敏機制中是發揮cGMP功能作用的關鍵調節因子[6-7]。鞘內注射NOS抑制劑(例如L-NAME和L-NMMA)抑制NO合成,或直接敲除NO或抑制cGMP合成,均可減少神經性疼痛的傷害感受行為[5,8]。
雞矢藤環烯醚萜苷(iridiod glycosides from Paederia scandens,IGPS)是從茜草科植物雞矢藤中提取的一類有效活性成分,主要有效成分包括雞矢藤苷、雞矢藤次苷、車葉草苷等。IGPS是GRA公認安全的具有有效治療作用的植物成分之一[9]。課題組前期研究結果顯示,IGPS在小鼠福爾馬林試驗、扭體試驗、坐骨神經結扎模型等均顯示良好鎮痛活性,且無成癮性[6,10]。本文采用NO供體硝普鈉(sodium nitroprusside,SNP)誘導的背根神經節神經元傷害模型,進一步研究IGPS抑制NO-CGMP/PKG信號、保護新生大鼠神經元的作用。另外,為排除直接在離體培養細胞加中藥提取物的可能影響,本研究采用了在藥理學中經有效驗證的血清藥理學方法制備IGPS含藥血清。
1 材料與方法
1.1 藥品與試劑IGPS由安徽醫科大學藥理學教研室提供,棕黃色粉末,臨用時用蒸餾水配制,批號151120。SNP(431451,Sigma 公司);兔抗鼠神經元特異性烯醇化酶(NSE,BA0535,BOTER 公司);Bradford蛋白濃度測定試劑盒、NO含量和NOS活性測定試劑盒均購自南京建城生物工程研究所;cGMP試劑盒購自上海中醫藥大學核試驗室;Revert AidTMFirst Strand cDNA synehesis Kit (00033699,Fermentas公司);PCR MasterMix (17304,北京天根公司);Fluo-3,AM(F026,DOJINDO Laboratories)。
1.2 動物♂SD大鼠,體質量200±20 g,購于安徽醫科大學實驗動物中心(合格證號:皖醫實動準字第 01 號)。實驗前給予動物至少3 d適應周期。于溫度(22~24)℃、相對濕度(60±5)%,及12 ∶12 h明暗循環條件下飼養。
1.3 新生大鼠背根神經節神經元純化、培養及神經元特異性烯醇化酶免疫組化鑒定無菌條件下取新生大鼠脊神經節, Collagenase-Dispase在37 ℃ CO2培養箱消化,加入MEM-F12培養基,培養皿提前用多聚賴氨酸和層粘連蛋白包被處理,離心得到單細胞懸液以1×108個·L-1密度接種于培養皿,37 ℃、5% CO2條件下培養1周。取出培養板,用2%多聚甲醛(含0.3% Triton X-100)室溫固定30 min,加1 ∶100 NSE,加1 ∶200生物素化山羊抗兔IgG。使用DAB顯色試劑盒,依次經梯度濃度乙醇脫水、透明、封片,于倒置顯微鏡下隨機選取5個視野,同一視野下計數染色的陽性細胞與總細胞數量之比,即為神經元細胞純度。
1.4 IGPS含藥血清制備♂SD大鼠40只,飼養3 d后隨機分組:正常對照組,IGPS(70、140、280 mg·kg-1)組,灌胃給藥,連續3 d,每日2次。最后1次灌胃1 h后于大鼠腹主動脈采血,4 ℃靜置過夜,2 000 r·min-1離心25 min,取上層血清,0.22 μm 微孔濾膜濾過除菌,56 ℃水浴滅活,-20 ℃條件下凍存備用。
1.5 SNP致DRG神經元損傷模型制備、MTT法測定細胞活力及IGPS含藥血清的處理DRG細胞培養72 h,隨機分為正常對照組、模型組和IGPS含藥血清組(280、140、70 mg·kg-1)。模型組及用藥組均用200 μmol·L-1SNP溶液灌注預處理30 min,然后各藥物組加入由正常細胞培養基1 ∶8稀釋的IGPS含藥血清100 μL。并設置調零組(只加培養基和藥物且不含DRG細胞)和陰性對照組(培養孔內含DRG細胞的同時加入培養基和空白血清),每個濃度設置5個復孔,所有組別DRG細胞處理后分別繼續培養24 h。各實驗孔內加入MTT(終濃度 0.5 g·L-1), 置于培養箱37 ℃、5% CO2孵育 4 h,加入DMSO(150 μL/孔),酶標儀于570 nm波長處測定各孔吸光度(A 值)。
1.6 DRG神經元cGMP/PKG信號通路指標測定
1.6.1NO和cGMP含量測定、iNOS活性測定 新生大鼠DRG神經元培養 72 h,建立SNP模型及用含藥血清處理后,提取總蛋白,使用Bradford蛋白濃度測定試劑盒測定蛋白質濃度。采用分光光度計法測定NO含量和iNOS活性,具體操作步驟按試劑盒說明書進行。采用放射免疫法測定cGMP含量,數據由Gamma放射免疫測定儀(UstcZonkia GC-1500)記錄。
1.6.2RT-PCR測定iNOSmRNA,PKGIAαmRNA和PKGIβmRNA 使用TRIzol試劑從培養DRG細胞提取總RNA及純度鑒定,引物設計如下表所示:

GenePrimerSequence(5'-3')BasepairiNOSForwardAGAGAAGGGCGCGTTGTGGTAGTT506bpReverseTGTCAGATGGCAAGGGTTCAGGTGPKGIαForwardCTTCTTCGCCAACCTG369bpReverseGGCAAACGCTTCTACCAPKGIβForwardGGGCTCATTCCGATTT363bpReverseTCATGGCCTTTGTTCAGβ-actinForwardATGCCATCCTGCGTCTGGACCTGGC606bpReverseAGCATTTGCGGTGCACGATGGAGGG
兩步法進行cDNA合成,具體操作步驟按試劑盒說明書進行,分別取上述cDNA 10 μL與iNOS等或β-actin引物進行PCR反應,按試劑盒說明書操作步驟進行。
使用瓊脂糖凝膠電泳對PCR混合物進行分析,并通過凝膠記錄系統(Biosens SC810,中國上海)對圖像進行采集。產物相對含量用電泳條帶信號灰度值與β-actin電泳條帶信號灰度值之比表示。
1.7 DRG神經元熒光染色及胞漿游離Ca2+濃度測定Fluo-3/AM儲備液(5 μmol fluo-3,AM, 0.005% Pluronic F-127, 0.1% DMSO),-80 ℃避光保存,使用前解凍。培養皿滴入0.2 mL Fluo-3,AM預知液,正常培養箱孵育1 h。去除染液,緩沖液沖洗。培養皿置于激光共聚焦顯微鏡(Leica TCS SP5,德國萊卡公司)載物臺上,記錄連續動態掃描的細胞內熒光強度(FT)變化。Fluo-3,AM在波長488 nm處激發,發射波長526 nm,采樣頻率為488 HZ,每皿選3~5個視野,以FT變化反映細胞內游離鈣濃度的變化。
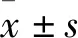
2 結果
2.1 新生大鼠DRG神經元細胞的培養,純度測定及染色鑒定剛接種的DRG細胞呈圓形,明亮且分散(Fig 1A),4~6 h后開始貼壁。接種24 h后,大部分貼壁細胞開始長出突起,并可觀察到突起末端的生長錐。孵育3~5 d后,細胞之間開始形成網絡(Fig 1B)。用NSE抗體對新生小鼠原代培養DRG神經元進行免疫染色,NSE 主要在胞質中表達,陽性細胞數量居多,呈深棕色,細胞形態呈圓形、橢圓形以及多邊形等,偶爾可觀察到突起伸出(Fig 1C,1D)。鑒定結果顯示,培養的DRG神經元細胞純度達0.9以上。
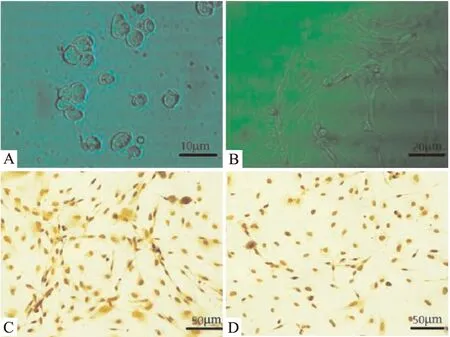
Fig 1 Culture and identification of DRG neuronsA.DRG neurons cultured for 1 h (×1 000); B. DRG neurons cultured for 24 h (×200); C and D. DRG neurons identified by NSE immunohistochemistry (DAB×400)
2.2 SNP 對DRG神經元的損傷作用及IGPS含藥血清的調節與對照組相比,SNP模型組DRG細胞的存活率為 57.73%,顯示 SNP處理對DRG神經元造成了損傷(P<0.01)。而與 SNP模型組相比,IGPS 含藥血清(140、280 mg·kg-1)組大鼠 DRG 神經元存活率呈現明顯升高趨勢(P<0.05,P<0.01),Tab 1。

Tab 1 Effect of IGPS-containing serum on survival in
2.3 SNP誘導DRG神經元NO/cGMP/PKG信號通路變化及IGPS含藥血清的調節作用與對照組相比,用NO供體SNP預處理30 min可以明顯增加亞硝酸鹽水平并增強iNOS酶活性,而IGPS含藥血清(280、140、70 mg·kg-1)的干預呈濃度依賴性地抑制亞硝酸鹽水平以及iNOS活性的升高(Fig 2A)。cGMP定量顯示了一致的結果,200 μmol·L-1終濃度的SNP溶液可以明顯升高cGMP含量,而IGPS含藥血清可以明顯下調cGMP含量(Fig 2B)。
Fig 2 NO production modulated by IGPSA: NO production and iNOS activity; B: cGMP level. ##P<0.01, vs control. *P<0.05, **P<0.01 vs SNP.
2.4 SNP對DRG神經元iNOS,PKGIα和PKGIβ mRNA的表達的影響及IGPS含藥血清的調節作用Fig 3A,B結果顯示,與對照組相比,SNP促進了DRG神經元iNOS mRNA,PKGIα和PKGIβ mRNA的表達。與模型組相比,IGPS含藥血清可明顯下調受損DGR神經元iNOS mRNA(P<0.01,P<0.05),PKGIα mRNA(P<0.05,P<0.05)和PKGIβ mRNA(P<0.01,P<0.05)的過度表達。
2.5 SNP對DGR神經元細胞內Ca2+水平的影響及IGPS含藥血清的調節作用與對照組相比,SNP作用DRG 神經元Ca2+濃度在15 s處有明顯上升。對照組DRG 神經元Ca2+水平在55 s 內幾乎沒有變化(Fig 4A)。與對照組相比,SNP誘導DRG神經元的Fluo-3,AM熒光強度(103.936±16.945)遠高于對照組神經元(20.896±9.471),差異有顯著性(P<0.01)。 與SNP模型組相比,DRG神經元升高的Ca2+水平IGPS含藥血清可以明顯下調,差異有顯著性(P<0.01,P<0.05)(Fig 4B)。
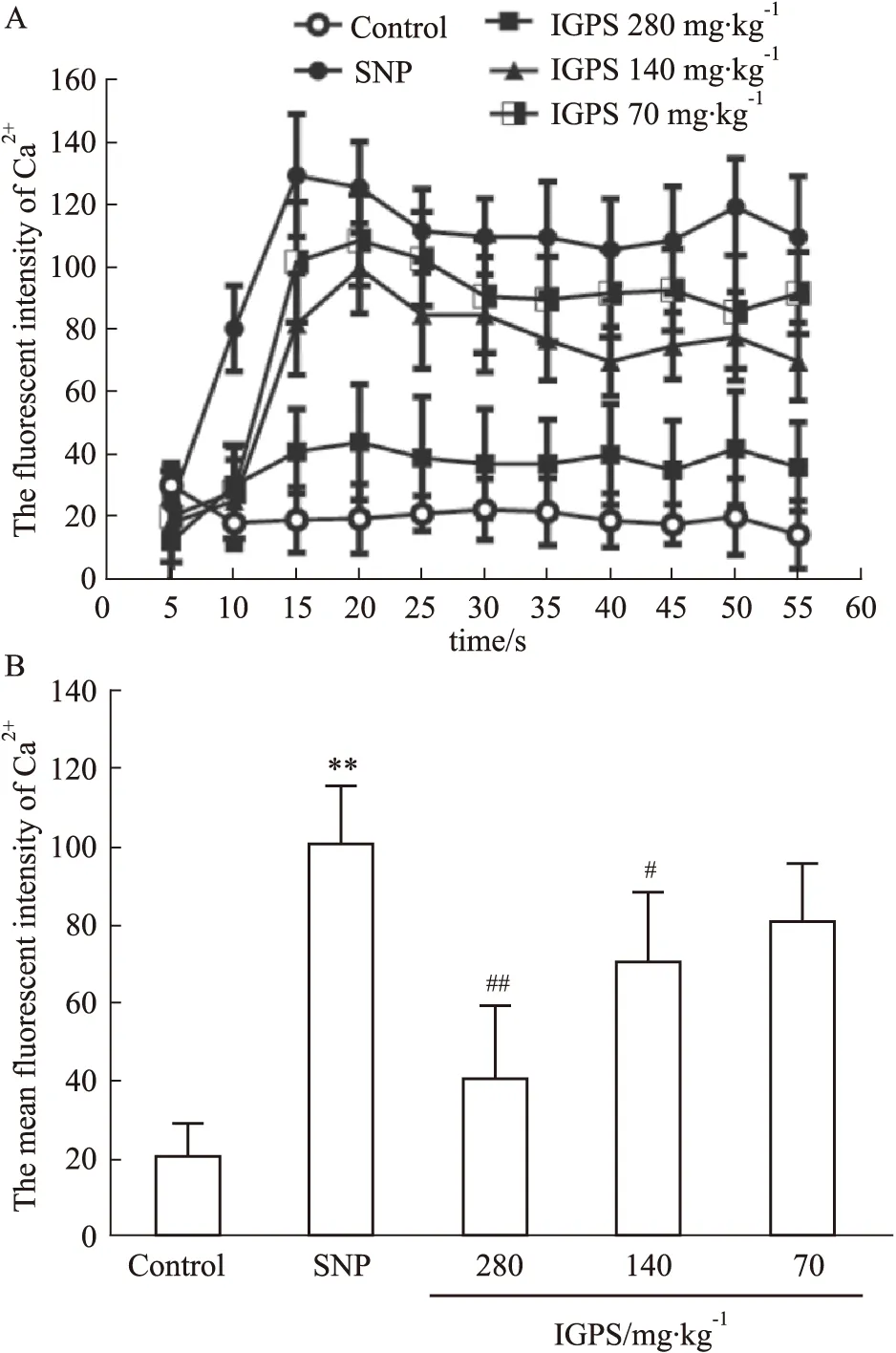
Fig 4 Intracellular Ca2+ variations in DRG neurons regulated by IGPSA: Effect of IGPS containing serum on time course of Ca2+ formation; B: The mean intensity of intracellular Ca2+concentration. Data represents mean±SEM of at least eight individual experiments. ##P<0.01 vs control, *P<0.05, **P<0.01 vs SNP
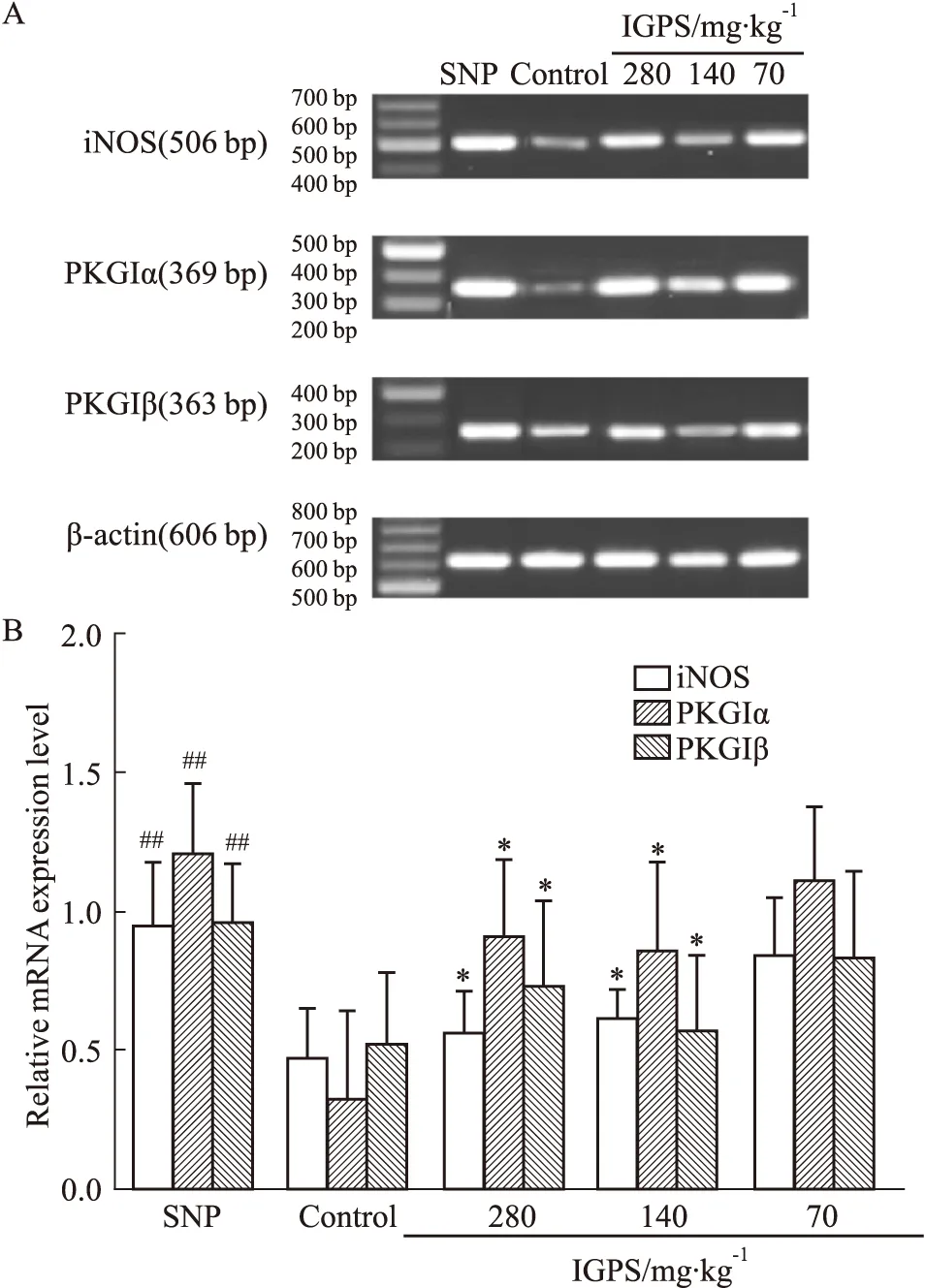
Fig 3 mRNA expression of iNOS, PKGΙα and PKGIβ decreased by IGPSA: Representative RT-PCR image of mRNA expressions of iNOS, PKGΙ (α, β); B: Relative ratios of iNOS, PKGΙ (α, β) to β-actin, respectively. ##P<0.01, vs control, *P<0.05, **P<0.01 vs SNP
3 討論
NO作為信息傳遞分子參與體內多種生理病理過程,研究證實,過量NO可對神經元細胞產生毒性,本實驗通過采用SNP作為NO供體提高DRG細胞內NO濃度,結果顯示SNP在200 μmol·L-1濃度時,細胞存活率在50%左右,選擇此濃度為造模濃度最適合。IGPS為中藥提取物,采取中藥血清藥理學的實驗方法,從細胞水平探討中藥的作用機理。實驗結果顯示,IGPS含藥血清可明顯提高NO損傷后神經元的存活率,提示IGPS含藥血清對SNP損傷DRG細胞具有一定的保護作用。
研究證實,cGMP依賴性的PKG酶參與了脊髓的疼痛傳遞,當外周神經受損出現炎癥可引起外周PKGI激活并逆向轉運至DRG神經元中,致使脊髓PKGI表達量增加[11]。我們進一步研究發現,IGPS的鎮痛作用可能與NO介導的信號轉導通路有關。IGPS含藥血清可明顯抑制DRG神經元細胞NO和cGMP含量, 可明顯下調PKGI(α,β)mRNA表達,即IGPS可通過抑制PKG介導的NO/cGMP信號通路的磷酸化發揮鎮痛作用。N型和L型電壓門控的Ca2+通道阻滯劑可有效緩解與神經性疼痛相關的痛覺過敏和異常性疼痛,不影響正常痛覺。我們實驗結果表明,IGPS可以明顯降低由外源NO引起的鈣離子濃度升高,這表明誘導炎癥性和神經性疼痛可能需要鈣依賴的突觸后機制。
綜上,研究結果表明,IGPS含藥血清可通過抑制NO誘導的cGMP/PKG 信號通路及升高細胞內鈣離子濃度,有效降低SNP損傷DRG神經元的死亡率而產生保護作用。

