體外誘導(dǎo)小鼠胚胎干細(xì)胞產(chǎn)生T譜系潛能造血祖細(xì)胞的關(guān)鍵步驟
于波,洪平山,胡房曉,夏成祥,蘭雨
暨南大學(xué) 基礎(chǔ)醫(yī)學(xué)院,廣東 廣州 510632
利用T淋巴細(xì)胞構(gòu)建的嵌合抗原受體T細(xì)胞(chimeric antigen receptor T-Cell,CAR-T)和基因修飾的T細(xì)胞受體T細(xì)胞(T cell receptor T-cell,TCR-T)是臨床腫瘤免疫療法的重點方向。胚胎干細(xì)胞(embryonic stem cell,ESC)及誘導(dǎo)性多能干細(xì)胞(induced pluripotent stem cell,iPSC)具有無限增殖和分化為成體所有類型細(xì)胞的能力,其來源廣泛,可操作性強。利用ESC和iPSC分化產(chǎn)生功能性T細(xì)胞,是解決目前臨床治療中所面臨的T細(xì)胞來源緊缺難題的理想途徑。
近年來,隨著人們對造血發(fā)育過程中的細(xì)胞和分子事件的認(rèn)識不斷深入,越來越多的研究團(tuán)隊運用形態(tài)發(fā)生素介導(dǎo)的定向分化、轉(zhuǎn)錄因子介導(dǎo)的細(xì)胞表型轉(zhuǎn)變、畸胎瘤模型等一種或多種相結(jié)合的方法,分別從人和小鼠胚胎干細(xì)胞中誘導(dǎo)分化出具有定向譜系潛能的造血祖細(xì)胞[1-5],并且從體外分化7~9 d的生血內(nèi)皮細(xì)胞(hemogenic endothelial cell,HEC)中以Notch依賴的方式從人iPSC和ESC產(chǎn)生了T細(xì)胞[3,6-7],但其在可重復(fù)性、移植效率、細(xì)胞功能性和自我更新能力等方面仍有待提高。
轉(zhuǎn)錄因子Runx1和Hoxa9可以促進(jìn)生血內(nèi)皮細(xì)胞生成,本課題組[8]在小鼠胚胎干細(xì)胞體外誘導(dǎo)造血分化的過程中,在內(nèi)皮向造血細(xì)胞誘導(dǎo)階段同時過表達(dá)Runx1和Hoxa9,構(gòu)建iR9-mESC重組細(xì)胞,體外誘導(dǎo)分化為iHEC。iHEC與發(fā)育中的胚胎D11主動脈-性腺-中腎區(qū)內(nèi)皮細(xì)胞和造血干細(xì)胞前體具有相似的分子表型[9],并能產(chǎn)生具有T譜系潛能的誘導(dǎo)性造血祖細(xì)胞,重要的是,移植到體內(nèi)產(chǎn)生具有豐富的TCRαβ重排的功能性誘導(dǎo)T細(xì)胞。為了進(jìn)一步提高試驗成功率和誘導(dǎo)T細(xì)胞的得率,本研究對ESC培養(yǎng)、擬胚體(embryoid body,EB)形成、HEC誘導(dǎo)分化及分選、細(xì)胞移植等關(guān)鍵步驟的條件參數(shù)進(jìn)行比較分析,明確該誘導(dǎo)分化過程的操作技巧和關(guān)鍵注意事項,以促進(jìn)該誘導(dǎo)體系的推廣及應(yīng)用。
1 材料和方法
1.1 材料
CD45.1+B-NDG小鼠購于百奧賽圖公司[動物質(zhì)量合格證號:SCXK(蘇)2016-0004],在中國科學(xué)院生物醫(yī)藥與健康研究院無特異性病原(SPF)級動物房飼養(yǎng)[實驗動物飼養(yǎng)設(shè)施合格證號:SYXK(粵)2015-0063];小鼠ESC購于百奧賽公司;AFT024基質(zhì)細(xì)胞來源于美國模式培養(yǎng)物集存庫(ATCC)。
DMEM高糖培養(yǎng)基、α-MEM購自美國通用電器公司;IMDM、胎牛血清、非必需氨基酸、Gluta-Max、丙酮酸鈉、β巰基乙醇、青鏈霉素、潮霉素B、嘌呤霉素等購自美國英杰生命技術(shù)有限公司;PD0325901、Chir99021、白血病抑制因子購自美國Selleck生物科技有限公司;鐵飽和轉(zhuǎn)鐵蛋白、單硫甘油、抗壞血酸、強力霉素(doxycycline,dox)等購自 美 國 Sigma公司 ;CD31、CD41、CD45、Kit、CD201、CD2、CD3、CD4、CD8、Gr1、Ter119、CD19、NK1.1、TCRγδ、DAPI等購 自 美 國 eBioscience公司;BMP4、VEGF購自美國Peprotech公司;胰酶替代物購自美國熱電公司;細(xì)胞核轉(zhuǎn)染儀(德國Lonza公司);BDfortessa流式細(xì)胞分析儀(美國BD公司);倒置熒光顯微鏡(日本奧林巴斯公司);RS2000 X線輻照儀(美國Rad Source公司)。
胚胎干細(xì)胞培養(yǎng)基:胎牛血清(15%),非必需氨基酸(1%),GlutaMax(1%),丙酮酸鈉(1%),β巰基乙醇(0.1 mmol/L),PD0325901(1 μmol/L),Chir99021(3 μmol/L),白血病抑制因子(1000 U/mL),DMEM高糖培養(yǎng)基。
小鼠胚胎成纖維細(xì)胞培養(yǎng)基:胎牛血清(10%),非必需氨基酸(1%),DMEM高糖培養(yǎng)基。
OP9-DL1培養(yǎng)基:胎牛血清(20%),α-MEM。
AFT024細(xì)胞系培養(yǎng)基:胎牛血清(10%),β巰基乙醇(0.1 mmol/L),丙酮酸鈉(1%),DMEM高糖培養(yǎng)基。
基礎(chǔ)分化培養(yǎng)基(basic differentiation medium,BDM):胎牛血清(15%),鐵飽和轉(zhuǎn)鐵蛋白(200 μg/mL),單硫甘油(0.45 mmol/L),GlutaMax(1%),抗壞血酸(50 μg/mL),青鏈霉素(1%),IMDM。
BDM+B培養(yǎng)基:在BDM培養(yǎng)基基礎(chǔ)上加5 ng/mL BMP4。
BDM+BV培養(yǎng)基:在BDM培養(yǎng)基基礎(chǔ)上加5 ng/mL BMP4和5 ng/mL VEGF。
BDM+CM+dox培養(yǎng)基:在BDM培養(yǎng)基基礎(chǔ)上加 AFT024-mIL3、AFT024-mIL6、AFT024-mSCF、AFT024-hFlt3L的培養(yǎng)液上清各2%及1 μg/mL dox。
EM培養(yǎng)基:在BDM+CM+dox培養(yǎng)基基礎(chǔ)上去掉AFT024-mIL6培養(yǎng)液上清,并將IMDM換成α-MEM。
1.2 mESC體外誘導(dǎo)分化步驟
復(fù)蘇重組了Runx1和Hoxa9基因的iR9-mESC并傳代2~3次,待細(xì)胞長至約80%培養(yǎng)皿時收集細(xì)胞,以1×105/mL的細(xì)胞密度,每20 μL為1滴,接種至15 cm培養(yǎng)皿蓋中,顛倒皿蓋,在培養(yǎng)皿底部加適量無菌水保持濕潤的培養(yǎng)環(huán)境,于37℃、5% CO2培養(yǎng)箱中用BDM+B培養(yǎng)基培養(yǎng)2.5 d誘導(dǎo)形成EB,收集EB接種至6或12孔培養(yǎng)板(6孔板 20~30個/孔,12孔板 15~20個/孔),用BDM+BV培養(yǎng)基繼續(xù)培養(yǎng)至第6 d,換為BDM+CM+dox培養(yǎng)基誘導(dǎo)基因表達(dá),11 d時收集細(xì)胞,流式分選 iHEC(CD31+CD41lowCD45-Kit+CD201high),以 5×103/孔接種至鋪有 2×104/孔的 OP9-DL1 培養(yǎng)皿,EM培養(yǎng)基中培養(yǎng)10 d誘導(dǎo)分化為特定祖細(xì)胞,移植入CD45.1+B-NDG小鼠,4周后檢測T譜系分布和T細(xì)胞表型(圖1)。
1.3 流式細(xì)胞術(shù)分析體外不同培養(yǎng)條件下誘導(dǎo)性生血內(nèi)皮細(xì)胞的含量
以往研究證明具備淋巴譜系分化潛能的造血祖細(xì)胞,其發(fā)育潛能在生血內(nèi)皮細(xì)胞階段就已經(jīng)決定,因此在多能干細(xì)胞分化產(chǎn)生淋系細(xì)胞的過程中,誘導(dǎo)生成具有淋巴譜系分化潛能的iHEC尤為關(guān)鍵。體外不同條件下誘導(dǎo)培養(yǎng)的第11 d細(xì)胞用胰酶消化成單細(xì)胞懸液,用含2%胎牛血清的磷酸鹽緩沖液清洗,經(jīng)生物素標(biāo)記的CD31抗體冰上孵育15 min,抗生物素磁珠4℃避光孵育25 min富集(對照組未經(jīng)富集步驟),熒光偶聯(lián)流式抗體染色15 min,用含2%胎牛血清的磷酸鹽緩沖液清洗后,流式細(xì)胞儀分選目的細(xì)胞。
1.4 統(tǒng)計學(xué)分析
用GraphPad Prism 7軟件分析實驗組和對照組差異的統(tǒng)計學(xué)意義。用Flowjo 10.0.7和Adobe Illustrator CS 6軟件處理流式檢測數(shù)據(jù)。P<0.05示差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 提高mESC轉(zhuǎn)染效率及同源重組iR9-mESC得率技巧
在早期研究中,通過定點打靶方式將外源基因?qū)隦osa26位點。首先利用同源重組方法將CAG-Pr-rtTA-3×Stop-TRE-Runx1-p2a-Hoxa9-pAPGK Pr-HygroR誘導(dǎo)表達(dá)單元定點插入mESCs的Rosa26位點,然后通過在培養(yǎng)基中加入潮霉素B篩選出陽性克隆,構(gòu)建誘導(dǎo)型Runx1-p2a-Hoxa9小鼠胚胎干細(xì)胞株iR9-mESC。在篩選并挑取iR9-mESC克隆后,在培養(yǎng)基中加入dox,qPCR檢測外源性基因Runx1和Hoxa9在mESC內(nèi)是否可以被誘導(dǎo)表達(dá)(圖1)。
在構(gòu)建iR9-mESC過程中,每一個步驟都可能影響克隆株的成功獲取。我們對該過程中出現(xiàn)的影響因素進(jìn)行了探索分析,從而提高mESC的轉(zhuǎn)染效率及同源重組iR9-mESC的得率。
對于電轉(zhuǎn)時的質(zhì)粒和細(xì)胞濃度,由于同源重組效率低,因此選擇用于電轉(zhuǎn)的細(xì)胞要盡量多一些,以提高重組效率,而為了避免電轉(zhuǎn)后細(xì)胞培養(yǎng)過程中多個克隆長在一起影響胚胎干細(xì)胞單克隆的純度,用于電轉(zhuǎn)的細(xì)胞濃度要適宜;另外,線性化質(zhì)粒的使用量也會影響電轉(zhuǎn)結(jié)果。實驗證明,選擇形態(tài)較好、處于對數(shù)生長期的約1.2×106mESC作為電轉(zhuǎn)目標(biāo),加入核轉(zhuǎn)染試劑和2~4 μg線性化質(zhì)粒,電轉(zhuǎn)后在小鼠胚胎成纖維細(xì)胞上培養(yǎng)并經(jīng)潮霉素B藥篩后,能獲得數(shù)目較多且獨立存在的iR9-mESC克隆株。
在電轉(zhuǎn)后得到的iR9-mESC培養(yǎng)方面,電轉(zhuǎn)后的1.2×106mESC鋪在小鼠胚胎成纖維細(xì)胞上生長,24 h后加入終濃度為150 μg/mL的潮霉素B篩選陽性細(xì)胞克隆7~10 d。電轉(zhuǎn)后的細(xì)胞狀態(tài)較差會導(dǎo)致部分細(xì)胞貼壁能力差,以至于24 h后仍有一定量的可能成功構(gòu)建的iR9-mESC懸浮于細(xì)胞培養(yǎng)基中,因此換液時一定要收集上清,離心后重新放進(jìn)來繼續(xù)培養(yǎng),否則將會導(dǎo)致目的細(xì)胞的丟失。另外,為避免影響細(xì)胞生長狀態(tài),要減少換液次數(shù),而長時間不換液會導(dǎo)致白血病抑制因子失活,研究得出每2 d換1次培養(yǎng)液既能保證細(xì)胞良好生長狀態(tài)又能提供足夠營養(yǎng)。
對于培養(yǎng)iR9-mESC所用的介質(zhì)選擇,由于mESC只有在飼養(yǎng)層細(xì)胞或明膠上才能生長,電轉(zhuǎn)前的mESC若是培養(yǎng)在小鼠胚胎成纖維細(xì)胞上,則電轉(zhuǎn)前須用0.1%明膠去除小鼠胚胎成纖維細(xì)胞,導(dǎo)致處理步驟多,操作時間長,細(xì)胞活性不好,但細(xì)胞多能性維持較好;而如果將mESC直接培養(yǎng)在明膠上,電轉(zhuǎn)前不需要進(jìn)行去除成纖維細(xì)胞的步驟,一定程度上提高了細(xì)胞活性,但在明膠上生長的mESC容易分化,導(dǎo)致細(xì)胞多能性較差。綜合分析,得出電轉(zhuǎn)前mESC在小鼠胚胎成纖維細(xì)胞上培養(yǎng)比在明膠上培養(yǎng)更能保證細(xì)胞的多能性狀態(tài),有利于之后的誘導(dǎo)分化步驟。在提高iR9-mESC活性方面,獲得iR9-mESC之后,需要在小鼠胚胎成纖維細(xì)胞上傳代培養(yǎng)2~3次,得到大量對數(shù)生長期的細(xì)胞,進(jìn)行擬胚體誘導(dǎo)培養(yǎng)。而在iR9-mESC培養(yǎng)過程中,對于狀態(tài)不好的細(xì)胞可以通過類似去飼養(yǎng)層細(xì)胞的方式改善細(xì)胞生長狀態(tài):將含有小鼠胚胎成纖維細(xì)胞的iR9-mESC鋪在0.1%明膠上30~40 min(根據(jù)細(xì)胞黏附至明膠上的情況而定)后,大部分成纖維細(xì)胞和一些抓力強、活性好的iR9-mESC黏附在明膠上,此時可以收集貼壁細(xì)胞,離心后繼續(xù)培養(yǎng)即可活躍增殖。此方式雖然大大減少了iR9-mESC數(shù)目,但也去掉了很多生長狀態(tài)差的細(xì)胞,繼續(xù)培養(yǎng)時到達(dá)相同細(xì)胞數(shù)目和相同時期(對數(shù)期)所需的培養(yǎng)天數(shù)與未經(jīng)歷此步驟培養(yǎng)的iR9-mESC相比明顯縮短。另外,細(xì)胞克隆密度對細(xì)胞生長狀態(tài)也有一定的影響,iR9-mESC培養(yǎng)時要保證適當(dāng)?shù)募?xì)胞克隆的密度,密度過高會使得克隆之間連成一片導(dǎo)致分化現(xiàn)象。
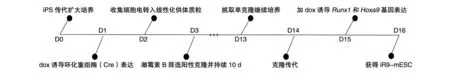
圖1 iR9-mESC細(xì)胞系構(gòu)建步驟
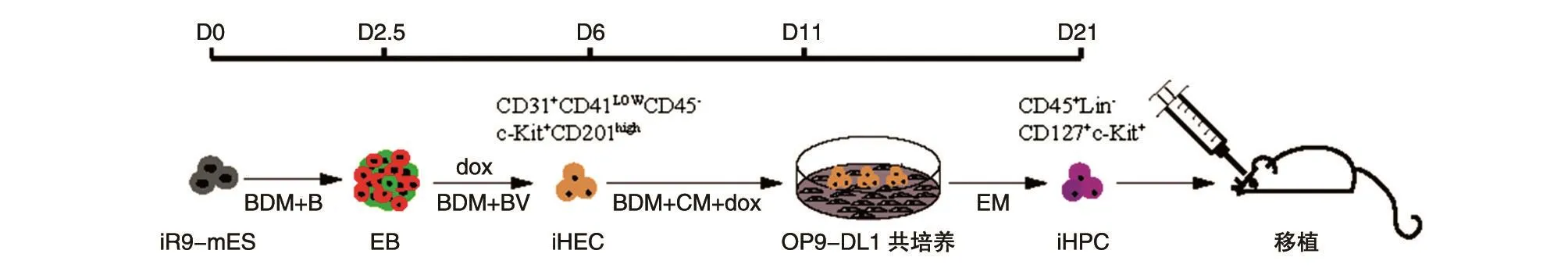
圖2 T譜系潛能造血祖細(xì)胞誘導(dǎo)流程圖
2.2 誘導(dǎo)EB生成過程中的關(guān)鍵因素和技巧
得到一定量的iR9-mESC之后,首先需要誘導(dǎo)成具有內(nèi)、中、外三胚層結(jié)構(gòu)的EB,在此基礎(chǔ)上繼續(xù)向造血方向誘導(dǎo)分化(圖2)。胰酶消化iR9-mESC,利用差速貼壁法將細(xì)胞加入0.1%明膠包被過的孔板中,40 min后收集上清中的細(xì)胞離心,即可去掉成纖維細(xì)胞,分離出iR9-mESC。離心后加入BDM+B培養(yǎng)基重懸細(xì)胞沉淀,并將細(xì)胞濃度調(diào)整為 1×105/mL,按照 20 μL/滴的細(xì)胞量將細(xì)胞懸液均勻滴在15 cm培養(yǎng)皿蓋的反面,然后顛倒皿蓋進(jìn)行懸浮培養(yǎng),此時記作第0 d(D0)。須在培養(yǎng)皿底部加一些無菌水保持濕度,于37℃、5% CO2培養(yǎng)箱中培養(yǎng)2.5 d后收集擬胚體離心,用BDM+BV培養(yǎng)基重懸即可為下一步分化做好準(zhǔn)備。
誘導(dǎo)過程中,用來誘導(dǎo)形成EB的單個液滴形狀和體積的精確性是關(guān)鍵。在懸EB時,液滴一定要呈圓形,垂直滴到培養(yǎng)皿中,液滴形狀不規(guī)則會影響D2.5時EB小球的形狀以及之后的誘導(dǎo)分化過程。并且懸EB時,若移液槍槍頭中有液體殘留,使得液滴體積小于20 μL,會導(dǎo)致得到的EB小球大小不均勻或較小,影響后續(xù)分化過程(圖3)。需要注意的是,在收集iR9-mESC進(jìn)行EB培養(yǎng)前,需要用DPBS洗滌iR9-mESC以去除iR9-mESC培養(yǎng)液中的小分子抑制劑(如PD、CHIR及Lif等),避免小分子抑制劑對EB后續(xù)分化的抑制。
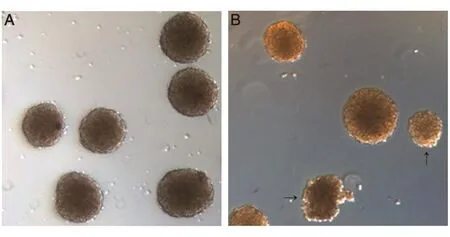
圖3 擬胚體形態(tài)(白光,5×物鏡)
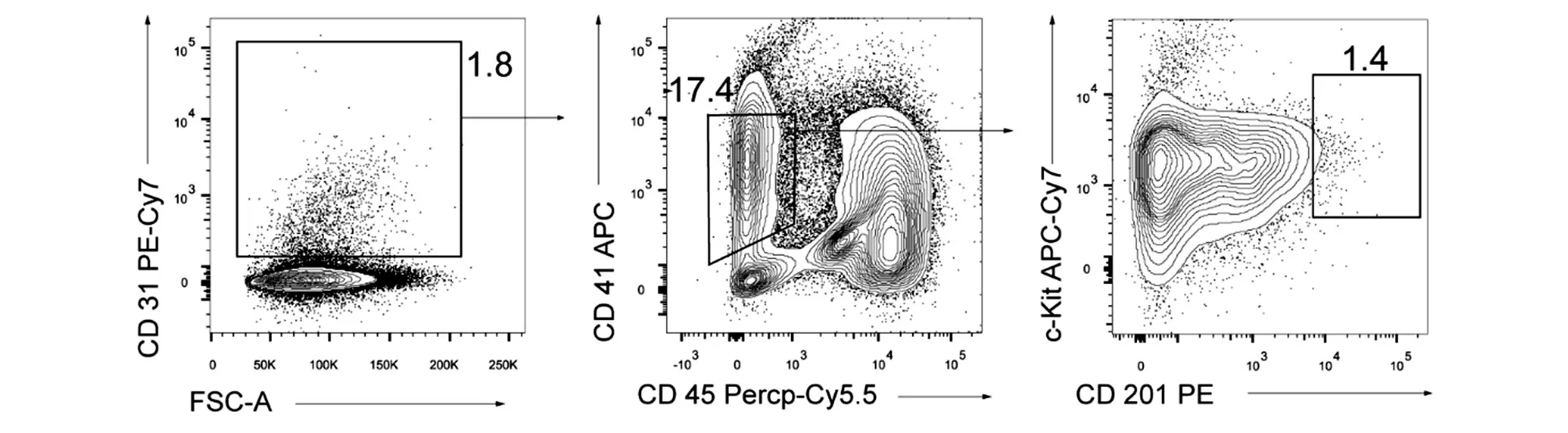
圖4 擬胚體破碎情況下體外誘導(dǎo)iR9-mESC分化第11 d的誘導(dǎo)性生血內(nèi)皮細(xì)胞分選流式圖
收集EB時,工具使用不當(dāng)及操作不當(dāng)也會大大降低之后iHEC的得率。由于得到的EB呈球形,體積較大且內(nèi)部結(jié)構(gòu)不是特別致密,因而需要使用孔徑較大的巴氏吸管收集EB,如用移液槍收集會導(dǎo)致EB破裂,最終極大地降低后續(xù)iHEC的比例(圖4、5A)。同時,收集EB時離心力要溫和,90×g或自然沉降均可。離心后棄上清過程中動作要輕柔,以免將EB棄掉。
2.3 EB誘導(dǎo)分化以及生血內(nèi)皮細(xì)胞分選過程的技巧
在誘導(dǎo)EB生成生血內(nèi)皮細(xì)胞及生血內(nèi)皮細(xì)胞收集和分選過程中,離心收集好的D2.5 EB須用BDM+BV培養(yǎng)基重懸,種在0.1%明膠包被過的6孔板中誘導(dǎo)分化,在EB培養(yǎng)的D6~D11期間用BDM+CM+dox培養(yǎng)基誘導(dǎo)外源基因Runx1和Hoxa9表達(dá)促進(jìn)生血內(nèi)皮細(xì)胞生成,其間每2 d換1次液。D11時,用0.05% Trypsin-EDTA膠原酶消化擬胚體,充分吹散后收集于50 mL離心管中,用美天旎免疫磁珠試劑盒富集CD31+細(xì)胞,染色后流式細(xì)胞儀分選iHEC(CD31+CD41lowCD45-Kit+CD201high)。此步操作過程中在以下幾個方面設(shè)置了對照實驗。
EB誘導(dǎo)分化過程中,未加dox會降低誘導(dǎo)分化效率,導(dǎo)致iHEC得率低。此步驟添加dox的作用是誘導(dǎo)Runx1和Hoxa9表達(dá),從而促進(jìn)產(chǎn)生T譜系潛能的iHEC。由于Runx1在產(chǎn)生生血內(nèi)皮細(xì)胞和EHT階段的促進(jìn)作用,所以Runx1不僅影響iHEC譜系特異性,也影響EB向iHEC的分化。該階段缺少Runx1表達(dá)會影響EB分化形成的iHEC得率(圖5)。另外,誘導(dǎo)分化生血內(nèi)皮細(xì)胞的EB鋪板密度要均勻適中,一個15 cm培養(yǎng)皿培養(yǎng)的約200個EB小球均勻鋪到1塊六孔板中即可,每孔20~30個擬胚體小球,12孔板則每孔10~15個,保證每個EB小球是獨立的,小球間距均勻。D2.5~D6期間對培養(yǎng)基進(jìn)行半換液或補液500 μL,注意不要大幅度晃動培養(yǎng)皿,否則會導(dǎo)致EB漂浮而停止分化。
收集生血內(nèi)皮細(xì)胞時,0.05%Trypsin-EDTA膠原酶消化時間和操作過程直接影響其得率。消化培養(yǎng)D11的EB時,Trypsin-EDTA膠原酶的作用時間和收集時的耗時是關(guān)鍵。酶消化時間過長會導(dǎo)致細(xì)胞狀態(tài)變差,收集時反復(fù)吹打細(xì)胞次數(shù)過多雖然可以減少未吹散細(xì)胞團(tuán)塊而導(dǎo)致的細(xì)胞的損失,但吹打產(chǎn)生的氣泡會損失大量細(xì)胞,并且處理時間過長也會在很大程度上降低細(xì)胞活性,最終降低生血內(nèi)皮細(xì)胞分選時的得率,從正常情況下的16.1%降低至0.1%(圖6、5A)。實驗得出,在收集胰酶消化后的產(chǎn)物時,用移液槍吹打8~10下可較好地實現(xiàn)二者的平衡。另外,收集消化好的細(xì)胞離心前需要來回劇烈顛倒離心管,以分散誘導(dǎo)培養(yǎng)過程中產(chǎn)生的黏稠狀的細(xì)胞分泌物團(tuán)塊,利于之后進(jìn)一步過濾,在后續(xù)用免疫磁珠富集時避免堵塞柱子。
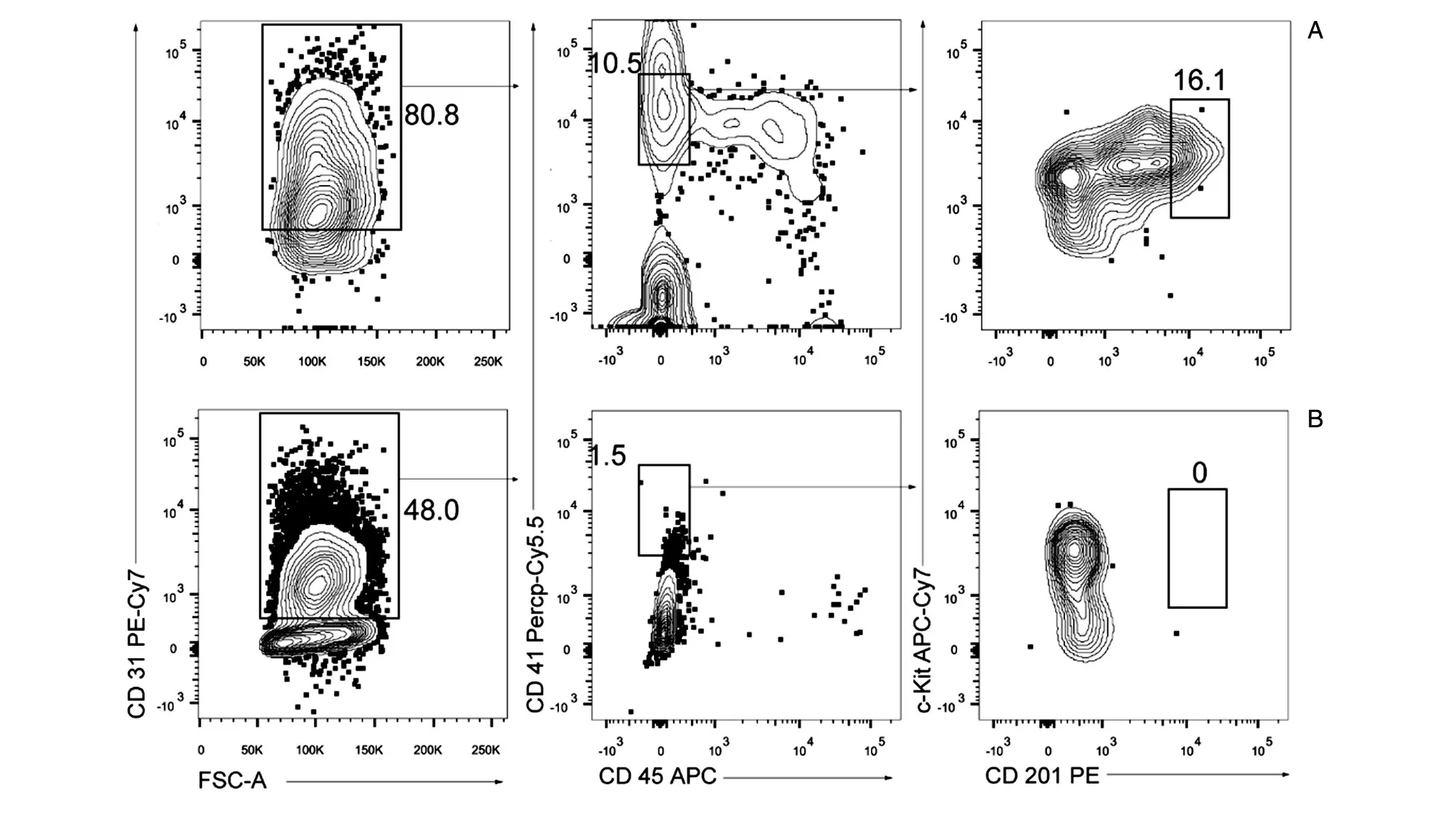
圖5 正常條件下和未加dox條件下體外分化獲得誘導(dǎo)性生血內(nèi)皮細(xì)胞比例的流式圖

圖6 細(xì)胞消化過度情況下體外誘導(dǎo)iR9-mESC分化第11 d分選的誘導(dǎo)性生血內(nèi)皮細(xì)胞流式圖
正確的免疫磁珠富集方法可增加生血內(nèi)皮細(xì)胞得率。為了滿足移植所需的造血祖細(xì)胞數(shù)量,通常會準(zhǔn)備盡可能多的細(xì)胞用于產(chǎn)生EB,進(jìn)而能夠分選得到較多的iHEC,因而D11收集用來分選的細(xì)胞量一般較大。在分選前,先進(jìn)行生物素標(biāo)記的CD31抗體和抗生物素的磁珠對細(xì)胞進(jìn)行富集,可以避免分選時間過長導(dǎo)致的細(xì)胞活性降低,又能減少流式儀器上機成本。需要注意的是,在用微珠之前,須在渦旋器上振蕩混勻,以免使用時微珠濃度和數(shù)量不準(zhǔn)確影響吸附效果。并且由于微珠較重,使用時須加大細(xì)胞濃度,控制反應(yīng)液的量,否則會導(dǎo)致微珠沉在底部而不能充分標(biāo)記細(xì)胞。同時,在細(xì)胞與微珠孵育過程中,定時多次混勻可增加二者的接觸,其目的是提高富集效果,從而增加生血內(nèi)皮細(xì)胞得率。實驗得出,采用富集后再分選的方式,分選耗時少且細(xì)胞活性好,富集后CD31+內(nèi)皮細(xì)胞比例顯著高于未富集時,分別為70.5%和13.2%(圖7)。分選時間過長會導(dǎo)致細(xì)胞活性差且與OP9-DL1共培養(yǎng)后細(xì)胞增殖較慢,并且流式分選上機成本高。上述不同的培養(yǎng)和操作條件下,iHEC的比例與對照組相比的統(tǒng)計學(xué)分析如圖8所示。
2.4 共培養(yǎng)誘導(dǎo)T譜系潛能造血祖細(xì)胞的技巧
共培養(yǎng)誘導(dǎo)T譜系潛能造血祖細(xì)胞時,細(xì)胞密度及與基質(zhì)細(xì)胞的比例是關(guān)鍵。分選出的D11的誘導(dǎo)性生血內(nèi)皮細(xì)胞需要與OP9-DL1細(xì)胞共培養(yǎng),從而誘導(dǎo)產(chǎn)生具有譜系特異性的造血祖細(xì)胞。共培養(yǎng)過程中需要注意,至少提前1 d(D10時)復(fù)蘇OP9-DL1細(xì)胞,細(xì)胞計數(shù)后,以12孔板的每孔種板2×104OP9-DL1細(xì)胞為佳,由于分選出的細(xì)胞存在狀態(tài)稍差以及分選時錯讀的可能性,實驗發(fā)現(xiàn)培養(yǎng)時將分選出的誘導(dǎo)性生血內(nèi)皮細(xì)胞與OP9-DL1細(xì)胞以1∶10的比例在EM培養(yǎng)基中共培養(yǎng),可保證目的細(xì)胞營養(yǎng)獲取充足又有足夠的基質(zhì)細(xì)胞提供分化所需的相關(guān)因子,10 d后可獲得較多的造血祖細(xì)胞。

圖7 CD31生物素標(biāo)簽富集前后內(nèi)皮細(xì)胞的比例
2.5 細(xì)胞移植方法選擇
體外誘導(dǎo)分化獲得免疫表型的造血祖細(xì)胞后須移植到重度免疫缺陷小鼠(NOD-PrkdcscidIL2rgtm1/Bcgen,CD45.1+,B-NDG)體內(nèi),于無特異性病原(specefic pathogen free,SPF)環(huán)境中飼養(yǎng)4~8周,流式分析檢測受體胸腺、淋巴結(jié)、血液等免疫器官中誘導(dǎo)性T細(xì)胞(CD4+/CD8+)的生成情況。該實驗過程中細(xì)胞移植是產(chǎn)生有功能的誘導(dǎo)性T細(xì)胞成敗的關(guān)鍵。其中,在細(xì)胞移植方法上一般有尾靜脈移植和眼眶靜脈移植2種選擇。眼眶靜脈移植時,由于操作經(jīng)驗不同,對注射針頭進(jìn)入位置和角度把握不準(zhǔn)確,以及實驗過程中小鼠受刺激后劇烈運動等突發(fā)情況,會導(dǎo)致部分已注射至眼眶靜脈的珍貴的目的細(xì)胞從眼角滲出,降低移植成功率和移植細(xì)胞數(shù)目的準(zhǔn)確性,并且由于經(jīng)驗和針頭進(jìn)入的深度不同,會導(dǎo)致小鼠眼睛不同程度的損傷而逐步失明,極大地影響小鼠身體健康、運動狀態(tài)及移植后受體小鼠的存活率。而通過尾靜脈注射移植時,因尾靜脈易明顯觀察,方便進(jìn)行準(zhǔn)確注射,并且可看到注射后細(xì)胞的流向,很少出現(xiàn)大量供體細(xì)胞液從尾靜脈流出的現(xiàn)象,增加了移植成功率和移植細(xì)胞數(shù)目的準(zhǔn)確性,并且對操作難度和經(jīng)驗性要求較低。
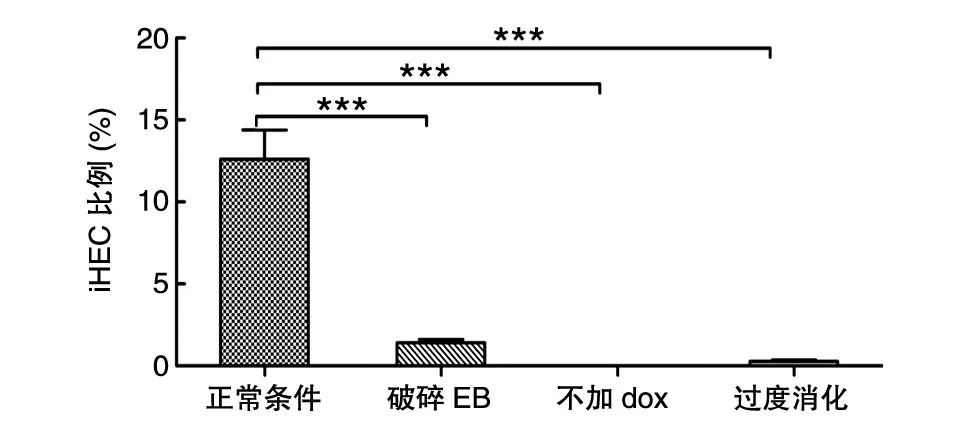
圖8 不同培養(yǎng)條件下實驗組和對照組數(shù)據(jù)差異的統(tǒng)計學(xué)分析
3 討論
造血發(fā)育系統(tǒng)內(nèi)皮起源和中胚層起源學(xué)說的興起,體外誘導(dǎo)多能干細(xì)胞產(chǎn)生定向譜系的造血干祖細(xì)胞大多通過誘導(dǎo)生成具有內(nèi)、中、外三胚層結(jié)構(gòu)的擬胚體,經(jīng)歷內(nèi)皮樣中間體階段,再利用共培養(yǎng)的方法定向誘導(dǎo)馴化為譜系特異的造血干祖細(xì)胞,最后通過移植到體內(nèi)或在體外鑒定代表集落形成能力的集落形成單位,最終確定形成的成熟血液細(xì)胞種類及其功能[3,8,10-13]。
研究顯示,生血內(nèi)皮細(xì)胞具有異質(zhì)性,并且紅-髓祖細(xì)胞和造血干細(xì)胞來源于不同的生血內(nèi)皮群體,重要的是,造血譜系潛能在生血內(nèi)皮細(xì)胞階段就已經(jīng)預(yù)先確定[14-15]。最近的研究通過建立胚胎發(fā)育過程中主動脈-性腺-中腎區(qū)從內(nèi)皮細(xì)胞到造血干細(xì)胞整個過程的單細(xì)胞轉(zhuǎn)錄組圖譜,追蹤第一波造血干細(xì)胞的生成,并鑒定捕獲了具有造血干祖細(xì)胞命運和潛能的生血內(nèi)皮細(xì)胞群體[16-17],說明特定類型iHEC的產(chǎn)生是體外誘導(dǎo)多能干細(xì)胞產(chǎn)生造血祖細(xì)胞的關(guān)鍵,可通過體外誘導(dǎo)多能干細(xì)胞產(chǎn)生譜系特異的iHEC從而產(chǎn)生特定潛能的造血祖細(xì)胞。本研究中,我們以在誘導(dǎo)過程中細(xì)胞培養(yǎng)濃度、操作方法細(xì)節(jié)、工具的使用、分選時間、細(xì)胞移植等方面設(shè)置對照組的方法,分析了影響該誘導(dǎo)體系中mESC活性、iHEC和造血祖細(xì)胞的含量以及譜系特異性的關(guān)鍵因素,針對各分化步驟和時間節(jié)點精準(zhǔn)操作,從而提高實驗過程中iHEC的活性和得率,提高移植效率,最終增加誘導(dǎo)性T細(xì)胞的得率。這些針對功能性T細(xì)胞再生的策略研究最終將幫助減輕血液系統(tǒng)疾病患者細(xì)胞治療過程中T淋巴細(xì)胞再生的困難。
志謝:感謝中國科學(xué)院生物醫(yī)藥與健康研究院王金勇研究員及其團(tuán)隊給予本實驗的支持與幫助。

