昆蟲血細胞功能、形態及細胞免疫反應研究前沿
李 蕾,張 雷,李世廣
(安徽農業大學植物保護學院,合肥 230036)
在各類環境的脅迫下,昆蟲形成了獨特而高效的免疫機制。與同時具備先天免疫反應(innate immune response)和適應性免疫反應(adaptive immune response)的脊椎動物不同,昆蟲缺少B和T效應淋巴細胞,因此只具備先天免疫反應。昆蟲的先天免疫系統依賴于血細胞介導的細胞免疫和酚氧化酶原與Toll/Imd信號通路調節的體液免疫。細胞免疫應答是昆蟲先天免疫中不可或缺的重要反應,與體液免疫各司其職但又相互聯系、共同作用。本文對昆蟲細胞免疫相關研究進展進行了綜述,將有助于系統地了解昆蟲細胞免疫,為害蟲防治提供策略。
1 昆蟲細胞免疫反應研究的歷史
關于細胞免疫反應的研究,始于俄國科學家Metchnikoff于1884年首次在海星幼蟲中發現了體內吞噬現象的存在(Metchnikoff, 1989)。隨著對昆蟲血細胞的深入探究,20世紀60年代科學家在黑腹果蠅Drosophilamelanogaster體中發現了具備吞噬能力的循環血細胞,并探明了它們在防御微生物方面的作用(Rizki and Rizki, 1984)。在昆蟲血淋巴中發現的細胞,相當于脊椎動物的血細胞,表現出與哺乳動物巨噬細胞相似的特性,并以溫度和肌動蛋白依賴性方式有效地攝取顆粒和細菌(Gray and Botelho, 2017)。在過去的二十年中,血淋巴細胞中發揮吞噬作用的關鍵成分已經被確定,吞噬細胞已成為宿主防御中重要的中樞效應細胞。
2 昆蟲細胞免疫反應研究的進展
血淋巴中的血細胞是免疫系統的重要組成部分,具有免疫防御作用。昆蟲血細胞來源于中胚層衍生的干細胞,通過形態學、功能和分子標記可分化為特定的譜系(Lavin and Strand, 2002)。這些血細胞自由地漂浮于開放式的血腔中,或者附著于各種組織和器官上。血細胞參與多種生理功能,在昆蟲的新陳代謝、變態和先天免疫中起著至關重要的作用,具有吞噬作用和免疫性,能保護蟲體免受寄生物的危害(Zhangetal., 2018)。在限制外界病原物擴散并清除入侵體內寄生物的過程中,昆蟲血細胞所起到的免疫功能主要包括:吞噬作用(phagocytosis)、結節作用(nodulation)和包囊作用(encapsulation)(Arteagaetal., 2017)。當昆蟲受到病原真菌等外源物入侵時,發揮吞噬作用的血細胞將其吞噬或合成抗菌肽來清除,同樣也會伴隨黑化反應;當病原物體積更大時,如原生動物、線蟲、寄生物等,細胞不能將其吞噬,則須通過形成結節與包囊將之清除(Siddiqui and Al, 2014)。昆蟲吞噬和包囊反應的一個顯著表型是黑色素化。色素出現在病原體破壞表皮的角質層表面,也出現在侵入宿主血腔的生物體表面及其附近(Nappi and Christensen, 2005)。
2.1 昆蟲血細胞的類型及形態
2.1.1昆蟲血細胞類型
參與細胞免疫應答的血細胞通常包括:原血細胞(prohemocytes)、粒細胞(granulocytes)、漿細胞(plasmatocytes)、類絳色細胞(oenocytoids)、脂血細胞(adipohemocytes)、珠血細胞(spherulocytes)等(Majumderetal., 2017),前5種血細胞存在于多數昆蟲中,其中漿細胞與粒細胞是參與細胞免疫應答最重要的兩種優勢血細胞,幾乎存在于所有昆蟲的血腔中。原血細胞位于造血器官中,擁有干細胞的功能,在應對病原菌等其他外源物入侵時具有分化為其他血細胞的潛能(Zibaeeetal., 2011; 2012)。幼蟲期或若蟲期的昆蟲,其血細胞除了通過中胚層的造血器官中的干細胞分裂而來,還會通過血液循環中已有的血細胞繼續分裂而產生(Wuetal., 2016)。Nakahara等(2010)提出家蠶Bombyxmori造血器官中的原血細胞分化為漿細胞,漿細胞被釋放到血液循環中,循環中的漿細胞又可分化為粒細胞、珠血細胞和類絳色細胞。珠血細胞能運輸表皮成分。類絳色細胞中含有胞質酚氧化酶的前體物質,參與血淋巴的黑化作用、體液免疫與包囊反應,起到物質代謝和分泌作用(Lavin and Strand, 2002)。脂血細胞可能起到貯藏血淋巴脂肪的作用,血淋巴中儲存的脂肪可作為抗逆物質,從而增強昆蟲的抗逆性(Amaraletal., 2010)。鱗翅目昆蟲中的血細胞包括漿細胞、粒細胞、類絳色細胞與珠血細胞,且漿細胞和粒細胞在血淋巴中數量最豐富,其中粒細胞表現出了對大腸桿菌Escherichiacoli強大的吞噬能力(Wuetal., 2016)。小金蝠蛾Thitarodesxiaojinensis幼蟲的粒細胞在血淋巴中所占比例最高,比已報道的其他鱗翅目昆蟲高,在Nielsen等(2000)的研究中提到蝠蛾作為鱗翅目類群中進化最為原始的種系,推測其體內的粒細胞可能是最早出現在此類昆蟲細胞免疫中的血細胞類型,因此在細胞免疫應答方面起主要作用。上述血細胞也存在于雙翅目(黑腹果蠅除外)、直翅目、膜翅目等其他類群中。果蠅的血細胞在昆蟲綱中較為特殊,主要為三類:片狀細胞(lamellocytes)、晶體細胞(crystal cells)和漿細胞。片狀細胞與漿細胞特性相似,粘附在異物表面介導細胞防御反應,在果蠅幼蟲中由漿細胞分化產生的片狀細胞參與結節和包囊反應(Evansetal., 2003);晶體細胞是非黏附性血細胞,其中含有酚氧化酶前體(Jiravanichpaisaletal., 2006);在果蠅血淋巴中,漿細胞占成熟細胞的90%~95%,具有很強的粘附性,起到吞噬病原物和凋亡細胞的作用。
研究者對完全變態類型昆蟲(如黑腹果蠅和鱗翅目昆蟲)的免疫研究較為深入,而對不完全變態昆蟲的免疫研究卻相對較少,且多集中于半翅目的蝽類。蝽類常見的血細胞有7種,即:原血細胞、漿細胞、粒細胞、類絳色細胞、脂血細胞、囊血細胞(cystocytes)和巨細胞(gaint cells)。但不是每種蝽類都具有這7類血細胞,比如,在大錐蝽Panstrongylusmegistus和騷擾錐蝽Panstrongylusinfestans中沒有發現脂血細胞和類絳色細胞,在長紅獵蝽Rhodniusprolixus中沒有發現巨細胞(Azambujaetal., 1991),這些血細胞在消除入侵的病原真菌時大都發揮著吞噬、包囊和結節的作用。有研究表明,漿細胞是半翅目蝽類唯一參與吞噬外來顆粒的血細胞(Borgesetal., 2008)。研究發現哺乳動物體內的巨核細胞(megakaryocytes)同樣出現在意大利蝗Calliptamusitalicus體內,表明節肢動物與脊椎動物具有較相似的同源基因(何嵐等,2017)。
當昆蟲被病原物感染后,首先會出現血淋巴凝集現象(coagulation),凝集現象出現在體液免疫反應之前(Loofetal., 2011),該反應可以修復傷口、吸附侵入的病菌,并形成凝血細胞(coagulocytes),從而防止病原真菌在血液中進一步移動。昆蟲血細胞的數量及其功能會受到病原真菌的影響。例如棉鈴蟲Helicoverpaarmigera被萊氏野村菌Nomuraearileyi侵染后,其血細胞總數(total hemocyte count, THC)無變化,但血細胞介導的吞噬、結節和包囊反應卻受到損害(Zhongetal., 2017);金龜子綠僵菌Metarhiziumanisopliae侵染沙漠蝗Schistocercagregaria兩天后便定殖于宿主血淋巴中,沙漠蝗的血細胞不附著在真菌上,也不吞噬或結節,THC先增加,后減少(Gillespieetal., 2000);Zibaee等(2011)發現球孢白僵菌Beauveriabassiana破壞了麥扁盾蝽Eurygasterintegriceps的多種免疫機制,因真菌次生代謝產物抑制了麥扁盾蝽血細胞的吞噬活性,阻礙了結節的形成,使真菌得以克服血屏障并殺死宿主。
2.1.2昆蟲血細胞的形態
不同類群的昆蟲血細胞種類不同,同種昆蟲的不同類型血細胞在空間形態上又存在著明顯差異。漿細胞和粒細胞是參與吞噬作用的兩類重要血細胞,血涂片初期觀察兩者在形態上無明顯的區別,都表現為球形、卵圓形的形態特征,而經過1 h以上的孵育后則表現出明顯差異,粒細胞延展出片狀和絲狀偽足,并出現典型圓形的黑色顆粒內含物,細胞整體呈卵圓形(倪若堯等,2018);而漿細胞雖可延展出片狀和絲狀偽足,但細胞質形變為紡錘形或不規則形,粒細胞與漿細胞的空間形態在多數昆蟲中可見(Borgesetal., 2008; Zibaeeetal., 2011);在麥扁盾蝽、長紅獵蝽及其他昆蟲血淋巴中發現原血細胞是球形的小細胞,胞內細胞質稀薄,細胞核很大,位于中心位置,并填充細胞,使細胞質占據細胞核周圍的狹窄區域,原血細胞位于造血器官和幾種昆蟲的血淋巴中;在鱗翅目、直翅目、膜翅目、半翅目等多數昆蟲中類絳色細胞是體積最大的一類血細胞,在相差顯微鏡下觀測到其直徑大小約為25~30 μm,呈規則狀圓形,圓形細胞核小而偏離中心,細胞質均一,胞質顆粒和晶體內含物少而小(Amaraletal., 2010);果蠅晶體細胞在形態上與其他昆蟲的類絳色細胞相似;片狀細胞呈整體扁平薄狀,具偽足無胞質內含物(Ribeiro and Michel, 2006);脂血細胞是大小為25~27 μm的圓形細胞,其特征表現為脂質滴在細胞質中擴散并形成特定的細胞質(Zibaeeetal., 2011);珠血細胞在鱗翅目昆蟲中整體呈現出被內含物小球填充成不規則形(倪若堯等,2018)。
2.2 血細胞介導的細胞免疫應答
2.2.1吞噬作用
昆蟲血細胞能夠識別各種外來生物和非生物靶標,并通過由相應的配體激活細胞表面的受體做出免疫反應。在昆蟲中,吞噬作用是一種重要的由受體介導并對病原體和寄生蟲做出防御的先天免疫反應,能有效地清除凋亡細胞和入侵病原體(Stuart and Ezekowitz, 2008)。哺乳動物的吞噬作用主要由巨噬細胞(macrophages)、單核細胞(mononuclear phagocytes)和中性粒細胞(neutrophils)完成,而昆蟲的吞噬作用主要由漿細胞或粒細胞完成,其他血細胞,如類絳色細胞也可能吸附病原體(Silva, 2010; Limetal., 2017; Niedergang and Grinstein, 2018)。細胞從環境中吞噬大顆粒的過程對于宿主防御傳染性微生物和清除發育過程中產生的凋亡細胞至關重要(Borgesetal., 2008),這是吞噬作用去除的兩類主要靶標。Ling和Yu(2005)的研究表明煙草天蛾Manducasexta血淋巴中的漿細胞參與對“異己”微球珠的識別和吞噬,而粒細胞參與昆蟲自身凋亡細胞的吞噬,這些細胞表現出內化物質的能力,并且能夠吞噬大于其自身表面積的顆粒。血細胞對各種細菌的反應也是不同的。例如,在埃及伊蚊Aedesaegypti中,血細胞對大腸桿菌的反應是吞噬作用,而對滕黃微球菌Micrococcusluteus的反應是黑色素化,其中某些被黑化的滕黃微球菌被粒細胞吞噬(Marmaras and Lampropoulou, 2009)。此外,在不同細菌之間,吞噬作用的效率和速度存在差異。如在岡比亞按蚊Anophelesgambiae、果蠅細胞系以及分離的地中海實蠅Ceratitiscapitata血細胞中,大腸桿菌比金黃色葡萄球菌Staphylococcusaureus更容易被吞噬(Lamprouetal., 2007; Bryant and Michel, 2016)。
2.2.2吞噬過程
吞噬作用是識別顆粒,將顆粒結合到細胞表面并在吞噬物質周圍內化形成一種稱為“吞噬體”(phagosome)的細胞器的高度保守過程。吞噬體是吞噬過程發生的核心,在先天免疫與適應性免疫中起著關鍵作用(Kagan and Iwasaki, 2012; Gray and Botelho, 2017)。但是新形成的吞噬體會被某些病原體破壞,因此早期的吞噬體會與核內體或溶酶體融合變成成熟的吞噬溶酶體(phagolysosome),成熟吞噬體的高度水解和消化能力能夠限制細菌的繁殖,并且在許多情況下可以殺死內化的微生物(Peltieretal., 2017)。在吞噬作用期間,吞噬性細胞和其他細胞攝取顆粒大小超過約0.5 μm的配體,質膜發生明顯彎曲并形成吞噬杯,細胞中部突出延伸形成偽足以便包住并內化顆粒,細胞膜在吞噬杯的底部與延伸偽足的起點和尖端處明顯凹陷彎曲(圖1 A)。為了內化大顆粒或眾多顆粒,吞噬細胞必須從細胞內吸收其他細胞器的膜,如核內體和內質網(圖1 B),在這個過程中,外囊(一種與果蠅吞噬體相關的八聚體復合物)將吸收的核內體束縛到吞噬杯的底部(圖1 C)。內化形成的早期吞噬體通過裂變并與溶酶體或核內體融合而成熟,以提供特殊的酸性和水解環境,最終降解被吞噬的顆粒(Stuart and Ezekowitz, 2008; Flannaganetal., 2012)(圖1D-F)。
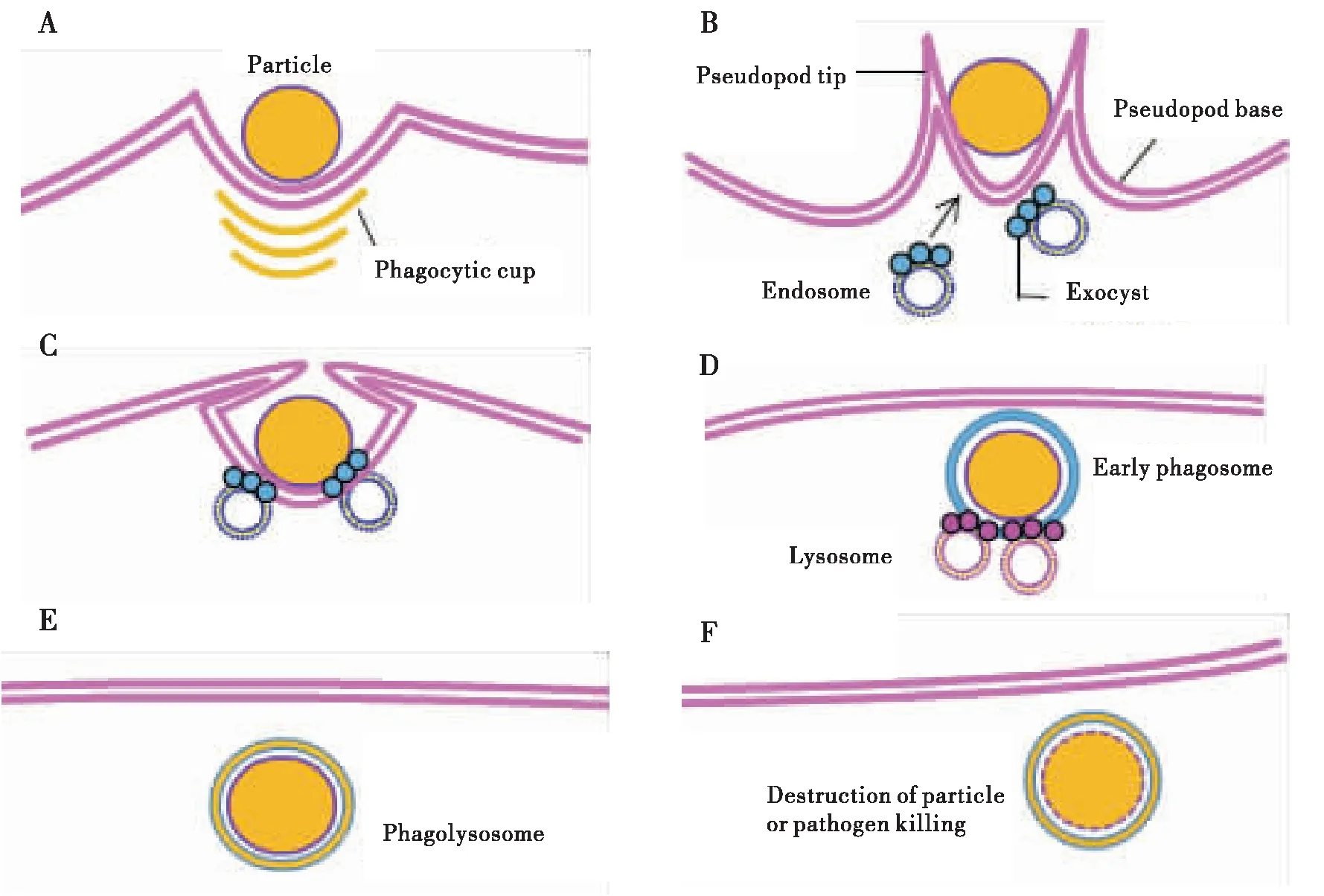
圖1 吞噬過程示意圖Fig.1 Sketch map of phagocytosis注:A,Particle,病原體顆粒物;Phyagocytic cup,吞噬杯。B,Pseudopod tip,偽足;Pseudopod base,偽足基部;Endosome,核內體;Exocyst,外囊。D,Lysosome,溶酶體;Early phagosome,未成熟吞噬體。E,Phagolysosome,吞噬溶酶體。F,Destruction of particle or pathogen killing,破壞顆粒或殺死病原體。
2.2.3吞噬受體分子
吞噬作用是由細胞表面受體的連接而引發的,當吞噬細胞表面受體被靶細胞激活時,受體與相應的配體結合,吞噬作用被激活,病原體被吞噬。以黑腹果蠅為例,在其細胞中已鑒定出四類主要的細胞表面吞噬受體分子(表1),分別為:①補體樣調理素(complement-like opsonins):即含硫酯的蛋白質(thioester-containing proteins,TEPs),TEPs是一類分泌效應蛋白的超家族。TEPs家族成員中的巨球蛋白相關蛋白(macroglobulin-related protein, MCR;即TEPVI)結合并增強對白色念珠菌Candidaalbicans的吞噬作用(Annaetal., 2017; Upasana and Ioannis, 2017)。其他TEP如:TEPII和TEPIII分別結合大腸桿菌和金黃色葡萄球菌并增強吞噬作用(Annaetal., 2017; Shokaletal., 2017)。②清道夫受體(scavenger receptors, SR):是結構上不相關的多配體受體,結合聚陰離子配體,并在許多物種中成為重要的模式識別受體(pattern recognition receptors, PRRs)(Gordon and Neyen, 2016; Kimetal., 2017)。在那些缺乏適應性免疫的物種中,清道夫受體家族得到了擴展,這證實了它們在宿主防御中的重要性。例如,人類只有3個CD36樣蛋白(CD36-like protein)的清道夫受體,而黑腹果蠅卻有10個。這種擴增很可能是由這些受體結合病原體的能力所驅動,這種能力增強了受體對細菌的識別,并保持果蠅自身的生存優勢。B類清道夫受體SR-B: CD36樣蛋白中的Croquemort在果蠅中介導凋亡細胞的吞噬;另一類B類清道夫受體SR-B: Peste是黑腹果蠅中細菌的受體,結合偶然分枝桿菌Mycobacteriumfortuitum(Philips, 2005; Cantonetal., 2013);C類清道夫受體SR-C: SR-CI是I型膜蛋白,含有與補體控制蛋白和粘蛋白相關的結構域,并結合革蘭氏陽性和陰性細菌(Rametetal., 2001)。SR-CI中存在高水平的天然多態性,這與不同程度的細菌感染抗性相關(Marmaras and Lampropoulou, 2009)。③新興表皮生長因子樣重復受體家族(epidermal growth factor (EGF)-like-repeat-containing receptors):一種黑腹果蠅I型膜蛋白Eater,是第一個被證明參與微生物識別的EGF樣重復受體,在漿細胞中表達,并廣泛識別病原體(Bretscheretal., 2015)。RNAi篩選發現Eater是對細菌起吞噬作用的GATA轉錄因子,在果蠅S2細胞中,Eater的表達若受到抑制會降低受體對細菌的結合與吸收,缺乏Eater的果蠅巨噬細胞吞噬細菌的能力會受損,最終受到單核細胞增生李斯特菌Listeriamonocytogenes的感染(Kocksetal., 2005; Chung and Kocks, 2011);Nimrod C1是黑腹果蠅中10個Nimrod基因簇的一部分,在蠶蛾中也發現了類似的蛋白清除細菌(Jánosetal., 2013; Melcarneetal., 2019);Drape是秀麗隱桿線蟲Caenorhabditiselegans凋亡細胞受體CED-1中的基因,與黑腹果蠅基因具同源性,其在神經膠質細胞和黑腹果蠅巨噬細胞表面上表達,負責吞噬果蠅凋亡細胞、修剪軸突以及去除切斷的軸突(Macdonaldetal., 2006; Kuraishietal., 2009)。已發現Draper的兩個配體分子是Pretaporter和Calreticulin(Kuraishietal., 2007; Fujitaetal., 2012)。④高度變異的受體和調理素:唐氏綜合癥細胞粘附分子(Down syndrome cell-adhesion molecule, DSCAM),免疫球蛋白超家族成員DSCAM在宿主防御中彌補了果蠅缺乏適應性免疫的缺陷來抵御新出現的病原體,DSCAM結合大腸桿菌并且可能充當吞噬細胞受體和調理素(Watson, 2005; Peu?etal., 2016)。在岡比亞按蚊細胞中DSCAM的缺少會減少對大腸桿菌和金黃色葡萄球菌的吞噬作用(Yuemeietal., 2006; Smithetal., 2011)。除了以上四類細胞表面吞噬受體之外,黑腹果蠅還表達其他受體,如肽聚糖識別蛋白(peptidoglycan recognition protein, PGRP)家族中的PGRP-LC,它參與吞噬革蘭氏陰性細菌,而不吞噬革蘭氏陽性細菌(Kurata, 2010);在黑腹果蠅中,PGRP-SA是PGRP家族吞噬革蘭氏陽性細菌的受體蛋白(Liuetal., 2018)。已鑒定出的這幾類果蠅同源吞噬受體除了DSCAM、Nimrod、PGRP-LC在岡比亞按蚊中表達,在其它實蠅類和鱗翅目昆蟲中暫未發現(Marmaras and Lampropoulou, 2009; Sigle and Hillyer, 2018)。
2.2.4結節作用與包囊作用
結節是昆蟲主要的細胞防御機制,能夠粘附大量細菌的多個血細胞聚集體,形成黑色或未黑色的結節(Marmaras and Lampropoulou, 2009)。結節的形成不同于吞噬作用將病原體吸收內化,而是受到微生物感染后迅速發生血細胞微聚集的復雜多步驟過程,由血細胞捕獲大量微生物,這些微聚集體通過粘附額外的血細胞而增大。最后,該過程以黑化為黑色結節而結束,這些結節附著在體壁或各種內部器官上(Stuart and Ezekowitz, 2008; Shietal., 2014)。到目前為止,類花生酸(eicosanoids)是能介導許多昆蟲物種結節的重要化學物質(Kimetal., 2017),而酚氧化酶原(prophenoloxidase, PPO)和多巴脫羧酶(dopa decarboxylase, Ddc)是參與果蠅血紅細胞結節的重要酶(Siderietal., 2008; Chenetal., 2018)。Satyavathi等(2014)提出昆蟲在感染病原微生物后,血細胞數量會大幅度減少并逐漸被脂肪體捕獲以形成結節,在此過程中脂肪體參與結節形成,同樣結節的發生也是昆蟲受到真菌及代謝物侵染后細胞數量減少的原因。

表1 黑腹果蠅參與吞噬作用的識別受體與相應的結合體
結節和包囊的產生均因為外源物太大而不能被吞噬。包囊作用是指血細胞與寄生蟲、原生動物和線蟲等更大的靶標結合(Grizanovaetal., 2018)。自然界常見的包囊現象如當寄生蜂將卵產在果蠅幼蟲體內時,可觀察到包囊(Marmaras and Lampropoulou, 2009)。血細胞結合靶標后,在其周圍形成多層囊,將病原物包裹在囊內,通過局部產生帶有細胞毒性的自由基活性氧ROS和活性氮RNS或通過窒息將其殺死,最終伴有黑色素化,該囊的形成需要漿細胞與粒細胞的參與(Siddiqui and Al, 2014)。在包囊過程中血細胞數量明顯減少,是由于血細胞被用于細胞粘附而生成黑色素即形成黑色素包囊。所以由此可見,在結節形成和包囊作用中,細胞免疫反應中也涉及到體液免疫反應的參與,兩種免疫反應不可分割。
3 不完全變態昆蟲免疫和蚜蟲共生體
一直以來,全變態昆蟲在昆蟲先天免疫研究中都占據優勢,不完全變態昆蟲的免疫機制雖有研究,但多局限在直翅目蝗科和半翅目蝽類之中。2010年,隨著首個完成全基因測序的不完全變態昆蟲—豌豆蚜Acyrthosiphonpisum基因組注釋的完成,不完全變態昆蟲的先天免疫機制受到的關注度日漸提高。不同于全變態昆蟲完整的免疫機制,豌豆蚜基因組中缺失了其它物種保守的免疫成分和途徑,如肽聚糖識別蛋白、C型溶菌酶、抗菌肽中的Defensins、IMD信號通路中的Dredd、Relish和dFADD(Gerardoetal., 2010)。此外,豌豆蚜的血細胞類型也已被鑒定,包括原血細胞、漿細胞、粒細胞、珠血細胞和蠟細胞(wax cells),這些血細胞類型不同于全變態昆蟲的細胞類型,其功能有待于深入研究(Anton inetal., 2012)。對豌豆蚜免疫系統的不斷探索,必將豐富我們對不完全變態昆蟲免疫機制的認識。
近年來隨著分子生物學和基因組學技術的不斷發展,蚜蟲共生體和昆蟲免疫之間的互作成為研究熱點。在蚜蟲中已經鑒定出許多共生體(symbiont),包括初級共生體(如Buchneraaphidicola)和次級共生體(如Serratiasymbiotica、Hamiltonelladefensa、Regiellainsecticola、Rickettsia、Wolbachia、Spiroplasma、Arsenophonus和SML型共生菌SitobionmiscanthiL. symbiont)。初級共生體通過提供限制其生長和繁殖的營養物質而使宿主受益;次級共生體賦予其宿主適應性優勢,例如保護昆蟲宿主免受病原體和天敵的侵害、增強對殺蟲劑的抗性、介導昆蟲的新陳代謝和生物合成(Benoitetal., 2017; Lietal., 2018)。而宿主會識別病原物相關模式分子(pathgon-associated molecular patterns, PAMPs),這也包括了共生體(Chu and Mazmanian, 2013)。這種親密的相互作用往往導致宿主生理和表型的根本變化,其中一方面就是宿主免疫反應的改變(Zhengetal., 2011)。蚜蟲共生體在血淋巴中可觀察到,蚜蟲的免疫細胞是共生體相互作用的主要場地,漿細胞和粒細胞在血淋巴中活躍地吞噬初級和次級共生體;在次級共生菌H.defensa中發現了吞噬溶酶體樣結構但尚未發現明顯的吞噬現象,推測共生菌吞噬了吞噬溶酶體并有將其內化降解的可能(Anton inetal., 2012)。在Laughton等(2015)的研究中發現豌豆蚜次級共生體H.defensa、R.insecticola的存在改變了血細胞數量和包囊反應,對酚氧化酶活性無顯著影響,盡管次級共生體的種類會影響測定結果,但當宿主遺傳背景保持恒定時,包囊反應僅隨R.insecticola的存在而增加,血細胞數僅隨H.defensa的存在而增加。在豌豆蚜中,一些次級共生體參與了對真菌病原體和擬寄生蜂的防御,但其機制尚不完全清楚(Lietal., 2018)。免疫系統如何對共生體的存在作出反應,以及共生體以何種方式影響蚜蟲的免疫反應,這都需進一步研究。
共生體選擇性地改變宿主免疫,而降低或下調宿主免疫系統可能有助于為共生種群提供穩定的生存環境。所以研究昆蟲體內共生體與宿主互作可為開發新型殺蟲劑提供依據。
4 結語
昆蟲所處的生境中存在著多種多樣的病原物,如昆蟲病原真菌、細菌、病毒、線蟲和寄生蜂等。因此,昆蟲的成功繁衍也必須歸功于自身抵御病原體入侵的能力。脊椎動物的適應性免疫應答能夠通過效應淋巴細胞的克隆擴增、抗原受體細胞突變以及種系重組而建立免疫記憶(Hauton and Smith, 2010),而昆蟲不具備B和T淋巴細胞,因此缺乏適應性免疫反應,但擁有高效的先天免疫系統,能使其應對來自所處生境大多數病原物的威脅。相信隨著對昆蟲先天免疫反應相關分子機制更深入地研究,將會為我們提供更加豐富的昆蟲免疫知識并更廣泛地運用到實際中。

