交替呼吸途徑在油菜素內酯調控本氏煙響應高溫脅迫中的作用研究
張瑞平 楊峰 陳樂章 鄧星光 張大偉
(1. 四川大學生命科學學院,成都 610064;2. 四川省煙草公司攀枝花市公司,攀枝花 617099;3. 四川惠泰農業科技有限公司,成都 610200)
植物在生長和發育的過程中面臨著多種環境脅迫。植物為了在環境中生存,進化出一系列復雜的網絡調控機制來感受環境變化的信號并調整自身適應環境刺激。其中,植物激素對調節植物對逆境的響應起到至關重要的作用。此外,有研究證明線粒體交替呼吸途徑也參與植物對逆境的響應[1-2]。
油菜素內酯(Brassinosteroids,BRs)是一類重要的甾醇類植物激素,它廣泛參與調控植物的生長、細胞伸長、光形態建成、根與氣孔發育等多個過程[3-4]。目前BR在植物中的信號轉導途徑已經研究得比較清楚。BR首先被定位于細胞膜上的受體激酶BRI1所感知[5]。另一個膜受體激酶BAK1,能夠與BRI1結合,并起到增強BR信號的作用[6]。BR被感知后通過一系列級聯磷酸化反應最終激活BES1/BZR1家族轉錄因子的活性,從而調節成千上萬靶基因的表達[7]。BR除了調控植物生長發育過程之外,也參與調控植物對環境脅迫的響應如抗冷、抗鹽、抗干旱、抗重金屬毒害等[4,8-9]。
線粒體呼吸是植物產生ATP的主要來源。植物線粒體中除細胞色素呼吸途徑外,還具有一條對氰化物不敏感的電子傳遞途徑,即抗氰呼吸途徑,也叫交替呼吸途徑[2]。交替氧化酶(Alternative oxidase,AOX)是交替呼吸電子傳遞鏈中的末端氧化酶,對植物抗氰呼吸起到了主要的調控作用[10],是植物調控抗逆網絡的重要成員。目前研究發現AOX參與調控植物對干旱脅迫[11]、鹽脅迫[12]、冷脅迫[13]以及病原物的抗性[14]。盡管如此,有關交替呼吸途徑調控植物抗逆的作用機制仍不清楚。
高溫是限制植物生長發育的重要環境因子。隨著全球氣候的變暖,高溫導致的熱脅迫嚴重制約作物的生長、發育和產量,極端的高溫甚至造成植被的死亡[15]。因此,研究植物響應高溫脅迫的分子機制具有重要的意義。有研究發現BR可以在高溫下促進植物下胚軸的伸長[16],然而其如何調控植物對高溫脅迫的響應還不清楚。本研究以本氏煙草為材料,探究交替呼吸途徑在BR調控植物響應高溫逆境中的作用機制,旨為培育高產抗逆遺傳改良作物提供理論依據。
1 材料與方法
1.1 材料
本試驗所用植物材料為野生型本氏煙草(Nicotiana benthamiana)。
1.2 方法
1.2.1 化學試劑處理 BL(最具活性的BR)購自Wako Pure Chemical Industries公司(日本)。交替途徑抑制劑水楊基異羥肟酸(Salicylhydroxamic acid,SHAM)購自Sigma公司(美國)。所有的藥劑溶于含0.02%吐溫20的超純水中。各試劑濃度如下:BL,0.1 μmol/L;SHAM,1 mmol/L。對照為含0.02%吐溫20的超純水。
1.2.2 高溫脅迫處理 實驗所用植株在溫室內生長,溫度為25℃。光照強度為100 μmol/m-2·s。光照條件為每天16 h光照,8 h黑暗。將正常條件下生長3周的幼苗轉移至37℃熱脅迫環境下處理3 d。
1.2.3 病毒誘導的基因沉默 本實驗所用基因沉默方法為煙草脆裂病毒(Tobacco rattle virus,TRV)介導的植物沉默方法(VIGS)。NbAOX1編碼區片段 用 引 物F:GGAGGATGGATCAAAGCAC & R:ATGGCAATAGCAGGAGCAG擴 增 所 得,片 段 純化后定向插入至pCRTM8/GW/TOPOTMTA Cloning Kit(Invitrogen,美國)質粒,通過GatewayTMLR ClonaseTMII Enzyme Mix試劑盒(Invitrogen)經LR反應后交換至pTRV2質粒。將構建好的質粒轉化至農桿菌GV3101株系。搖菌過夜后離心,用瞬時表達緩沖液(10 mmol/L MgCl2,10 mmol/L MES,和200 μmol/L乙酰丁香酮)重懸后靜置3 h。將含pTRV1的農桿菌重懸液和帶有目的片段的pTRV2農桿菌重懸液按照1∶1的比例混合,通過無菌針管注射至本氏煙葉片。
1.2.4 呼吸檢測方法 植物呼吸測定用Clark型氧電極(英國),取50 mg葉片并將其剪成碎片,懸浮于20 mmol/L的磷酸鉀緩沖液中(pH 6.8),等待15 min后進行呼吸測定,以避免機械損傷誘導呼吸。不加呼吸抑制劑時測得的數值為總呼吸Vt;同時加入細胞色素途徑抑制劑KCN(終濃度為1 mmol/L)和交替途徑抑制劑n-丙基沒食子酸(終濃度為0.5 mmol/L)測得剩余呼吸Vr;僅加入1 mmol/L KCN時測得的呼吸活性為V0。細胞色素呼吸值Vcyt=Vt-V0;交替呼吸值Valt=V0-Vr。上述呼吸量均以μmol O2·mg-1FW min-1表示。每個樣品重復測定6次,取平均值。
1.2.5 RNA提取及RT-PCR 葉片總RNA提取用了全式金公司(中國)植物總RNA提取試劑盒,提取方法參照說明書。反轉錄采用Invitrogen公司(美國)SuperScript III Reverse Transcriptase試劑盒。熒光定量PCR擴增實驗使用TaKaRa公司(日本)的SYBR Premix Ex Taq試劑盒進行,NbAOX1(序列號:KF367455)基因表達檢測引物序列為F:TGAATGATAAGCAGCACGAT & R:TGACGGTCCAATAAGCAAA,內參基因NbACTIN(序列號:AY179605)擴增引物序列為F:ACTGATGAAGATACTCACA & R:CAGGATACGGGGAGCTAAT。每組實驗重復3次。
1.2.6 葉綠素熒光參數分析 葉綠素熒光參數測定采用飽和脈沖分析方法,數據采集通過葉綠素熒光成像系統IMAG-MINI(德國)。植物首先暗處理30 min,打開測量光,記錄暗處理后初始熒光值Fo;打開飽和脈沖并持續0.8 s,測得暗處理后最大熒光值Fm;關閉飽和脈沖,打開光化光,記錄葉綠素熒光從黑暗到光照的響應過程,等熒光曲線趨于穩定時關閉光化光,打開飽和脈沖0.7秒,此時測得葉綠素熒光峰值Fm'。光系統II的最大光效率Fv/Fm=(Fm-Fo)/Fm;非光化學淬滅值NPQ=(Fm/Fm')- 1。
1.2.7 抗氧化系統活力測定 取500 mg葉片于5 mL提取液[含25 mmol/L PBS,0.2 mmol/L EDTA,2 mmol/L抗壞血酸和2%聚乙烯吡咯烷酮(PVP)pH7.8]中研磨。12 000 r/min低溫離心20 min,取上清液用來檢測抗氧化酶活性。超氧化物歧化酶(Superoxide dismutase,SOD)、過氧化氫酶(Catalase,CAT)、愈創木酚過氧化物酶(Guaiacol peroxidase,GPX)和抗壞血酸過氧化物酶(Ascorbate peroxidase,APX)活性檢測方法參照Xu等[17]的文章。
1.2.8 植物氧化損傷分析 超氧化物用0.5 mg/mL硝基氯化四氮唑藍(Nitro blue tetrazolium,NBT)染色2 h。過氧化氫用2 mg/mL 3,3'-二氨基聯苯胺(3,3'-diaminobenzidine,DAB)染色8 h。
葉片相對含水量RWC=(Fw-Dw)/(Tw-Dw)×100%。其中Fw代表葉片濕重;Dw代表葉片干重;Tw代表葉片飽和吸水重量。
電導率(Electrolyte leakage,EL)表示植物細胞質膜的透性,檢測方法如下:取0.5 g新鮮葉片,洗凈后用剪刀將其剪碎,加入5 mL超純水后真空抽濾20 min,在室溫下靜置1 h,用電導率儀器測試電導率Ri。然后沸水浴中煮5 min,冷卻到室溫然后再測定電導率Rt,相對電導率Ro=Ri/Rt。
丙二醛(Malondialdehyde,MDA)含量可以用來表示細胞脂質過氧化情況,其定量方法參考Deng等[9]文章。
2 結果
2.1 高溫脅迫下BR激活交替呼吸途徑
為了探索高溫逆境下BR與交替呼吸途徑之間的關系,首先檢測了BR處理后本氏煙交替呼吸的變化情況。結果顯示在正常生長條件下,與對照組(水處理)相比植株在噴施BL后交替呼吸強度顯著上調,NbAOX1表達量也表現出明顯上升。在化學試劑處理 12 h后,將植株移至37℃生長條件下,并連續檢測了其交替呼吸及AOX1表達量隨時間的變化。如圖1所示,高溫逆境條件下生長的植物,其抗氰呼吸、AOX1基因表達水平高于正常生長條件下的植株;這種趨勢在BL處理后更為顯著。這些結果說明BR能夠誘導植物AOX途徑以響應高溫逆境。
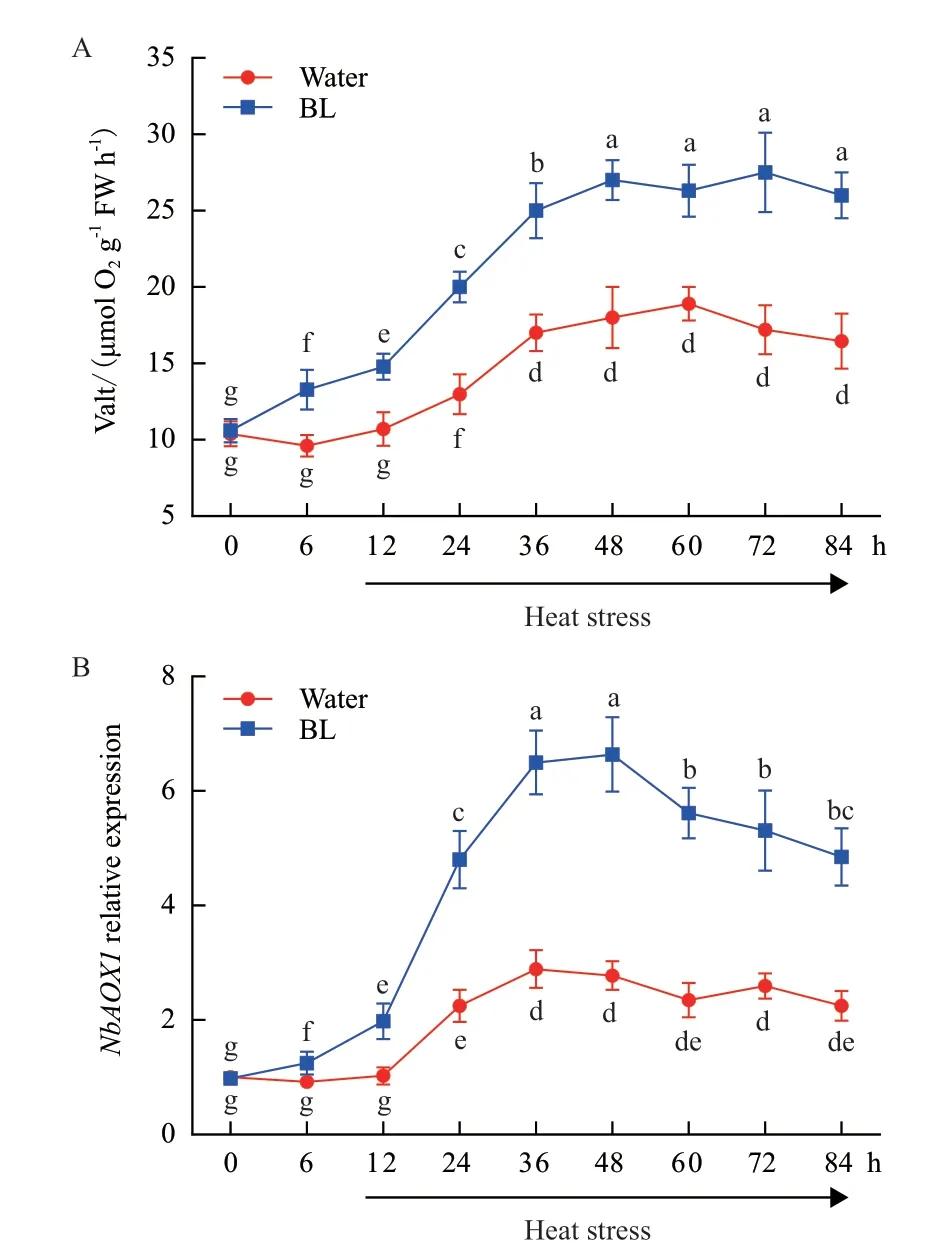
圖1 BR誘導交替呼吸Valt及NbAOX1表達量隨時間的變化
2.2 BR誘導的交替途徑減高溫緩脅迫對光系統的損傷
為了進一步分析交替呼吸途徑在BR介導的植物抗高溫中的功能,我們通過葉綠素熒光成像系統分析了熱脅迫下植物光系統II的功能。如圖2所示,正常生長條件下,對照組與處理組植株光系統II參數無明顯差別。在高溫脅迫下,噴施BL的植株其光系統II的最大光效率Fv/Fm比水處理植株高(圖2-A-B)。相反,BL處理植株非光化學淬滅值NPQ比水處理植株低(圖2-C-D)。然而,BL處理對植物光系統的保護作用在交替途徑抑制劑SHAM存在時會受到抑制。為了進一步分析AOX1對BR誘導植物抗逆的影響,用VIGS技術沉默了NbAOX1基因。與SHAM共處理相似,在高溫處理下,NbAOX1沉默植株中噴施BR不能夠明顯上調Fv/Fm及下調NPQ(圖2)。這些結果證明BR誘導的交替途徑能夠在逆境中保護植物光系統。
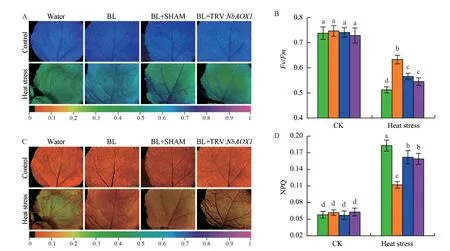
圖2 交替呼吸途徑參與BR緩解植物在逆境中的光系統損傷
2.3 高溫逆境下BR誘導的交替途徑減輕ROS的積累
植物在響應逆境脅迫時往往會伴隨著ROS的積累。本研究用NBT及DAB染色法檢測了植株中超氧化物及過氧化氫的含量。這兩種方法都檢測到脅迫條件下ROS積累明顯變多,而BR處理會在一定程度上降低ROS的積累。然而在SHAM預處理或NbAOX1沉默植株中,BR緩解ROS積累的情況受到顯著抑制(圖3-A-B)。
組織的電導率(EL)、MDA及相對含水量(RWC)這些生理指標被常用來表現植物在逆境中受到氧化損傷的情況。與ROS積累相似,高溫脅迫能夠導致植株EL及MDA含量上升。與水處理植株相比,BL處理植株表現出更低水平的細胞死亡、EL及MDA含量(圖3-C-D)。植物在逆境中RWC會明顯降低,而在相同條件下,BL處理后的植株中RWC明顯高于水處理植株(圖3-E)。然而,熱脅迫處理后BR對以上3個生理參數的調控作用在SHAM共處理或NbAOX1沉默植株中會受到抑制。
2.4 高溫逆境下交替呼吸途徑對BR激活本氏煙抗氧化系統的影響
植物中抗氧化系統能夠減緩植物在逆境下所受的氧化損傷。本研究也檢測了4種抗氧化酶活性的變化情況,包括:超氧化物歧化酶SOD、過氧化氫酶CAT、抗壞血酸過氧化物酶APX和愈創木酚過氧化物酶GPX。如圖4所示,在正常生長條件下,對照組與處理組植株抗氧化酶活性無明顯差別。在熱脅迫處理后,抗氧化酶活性明顯上調,而這些上調在噴施BL植株中要強于噴施水的植株。有趣的是,SHAM處理或沉默NbAOX1基因能夠抑制BR激活這4種抗氧化酶的活性。
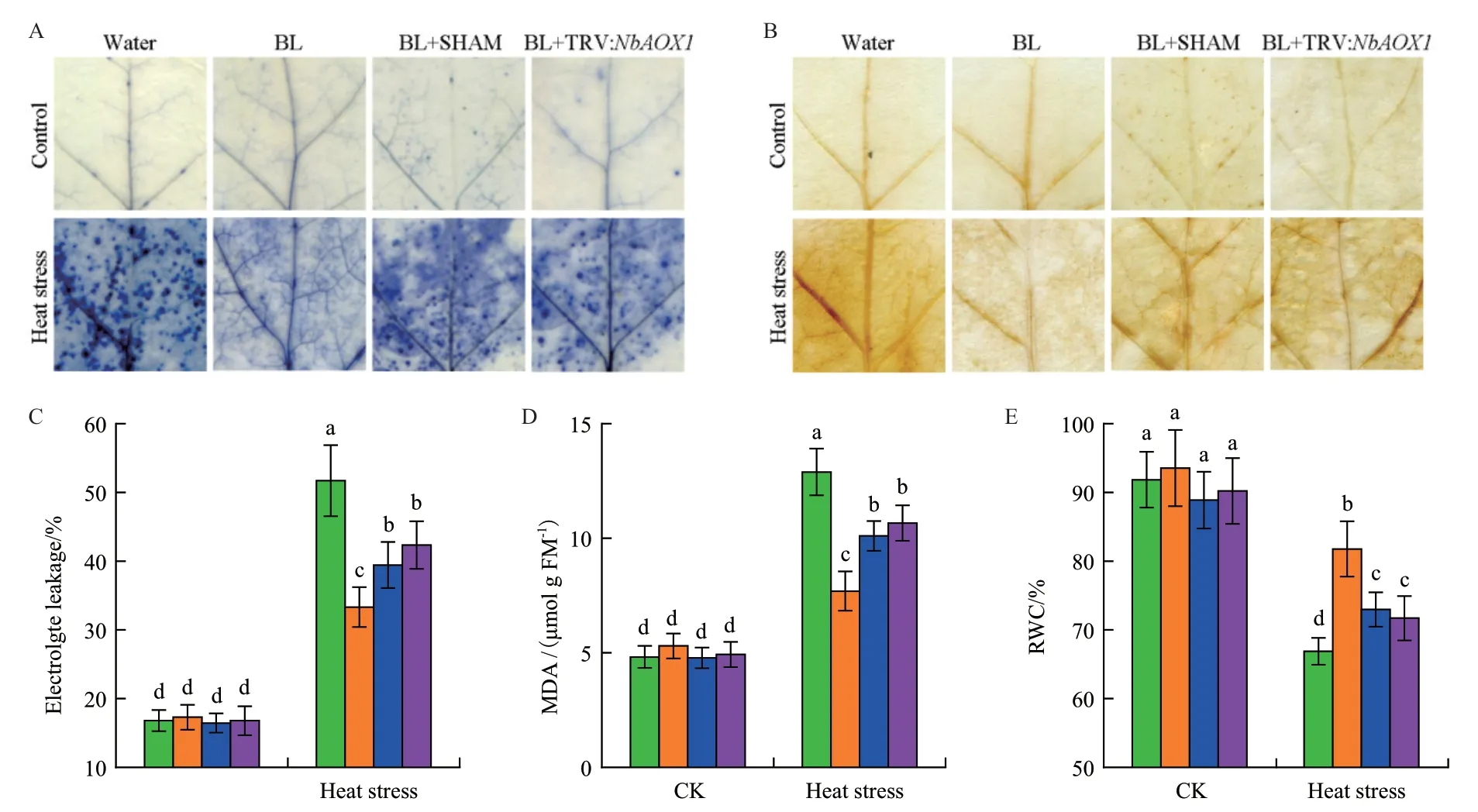
圖3 交替呼吸途徑參與BR緩解高溫逆境對植物造成的氧化損傷
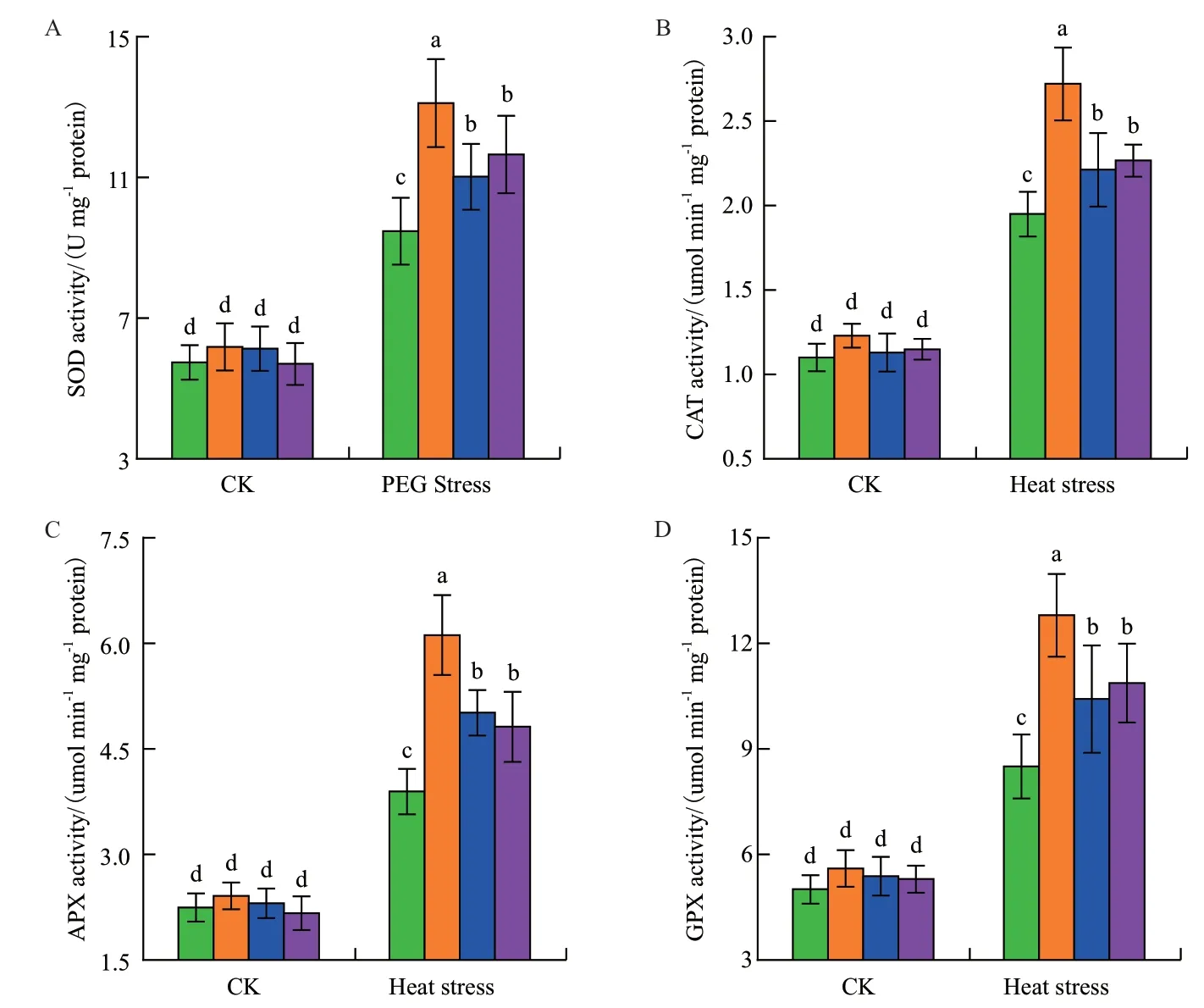
圖4 高溫逆境下交替呼吸途徑參與BR激活本氏煙抗氧化酶活性
3 討論
有關交替呼吸途徑在植物響應逆境方面調控的研究越來越多,在過去十幾年內,人們發現AOX可能是線粒體調控植物抗逆的重要成員之一。許多逆境脅迫如冷脅迫、干旱脅迫、鹽脅迫等都能誘導植物抗氰呼吸、AOX轉錄及蛋白水平上調[11,17-18]。有研究報道植物激素能夠誘導交替呼吸途徑。在煙草中,低濃度的水楊酸能夠誘導AOX基因表達及抗氰呼吸[19]。植物響應逆境時乙烯信號常常與交替呼吸途徑存在多重交叉影響[12,17]。這些研究都說明植物中交替途徑與植物激素間存在一定聯系。本研究證明了在本氏煙草中BR也能夠誘導交替途徑,外施BR能夠誘導植物抗氰呼吸及NbAOX1基因轉錄水平,這些結果為BR與交替呼吸途徑之間存在關聯提供了證據。有意思的是,BR對交替呼吸途徑的誘導作用在高溫逆境下尤為顯著,這暗示了交替途徑可能參與BR調控植物響應高溫逆境的過程。事實上,實驗結果也證明了交替呼吸途徑在BR誘導植物對熱脅迫抗性的過程中發揮了重要作用。無論是通過化學試劑處理還是基因沉默方法抑制交替呼吸途徑后,高溫逆境下BR處理對煙草光合系統的保護能力受到了一定程度的抑制。
BR誘導的交替呼吸途徑很可能在某種程度上緩解了高溫逆境下ROS的過量積累。一般來說,AOX能夠通過降低植物線粒體內泛醌的含量從而抑制ROS的合成[20-21]。已有研究報道了過表達AOX基因能夠降低植物中ROS的含量[22-23],植物缺失AOX基因后在逆境下會遭受更大程度的傷害[24]。在本研究中,抑制交替途徑后BR處理植株在熱脅迫條件下仍能積累大量ROS。逆境下抗氧化系統能夠清除過多的ROS從而保護植物免受氧化傷害。在本實驗中,抑制交替途徑對BR在抗氧化酶活性調控方面起到了負面的影響。同樣,脅迫損傷指標檢測發現在抑制交替途徑的植株中,BR處理不能有效地減緩植物遭受的逆境損傷。這些結論都說明在高溫逆境下,交替呼吸途徑能夠幫助BR激活植物抗氧化系統來緩解植物的氧化損傷。
4 結論
在高溫逆境下,交替呼吸途徑能夠被BR信號激活,被激活的交替途徑能夠抑制植物在逆境中ROS的過量積累及保護光系統。本研究證實了交替呼吸途徑參與BR調控植物響應逆境信號,同時也為BR信號在調控植物抗逆方面的研究提供了新的證據。

