臨床株鮑曼不動桿菌gyrA和parC突變與氟喹諾酮的耐藥性及其突變風險因素分析
劉 輝 陳小東 黃浩南 邱群鳳
1 福建醫科大學附屬龍巖第一醫院檢驗科,福建省龍巖市 364000; 2 福建省龍巖市疾病預防控制中心檢驗科
鮑曼不動桿菌(AB)是一類機會性致病菌,廣泛存在于自然界和人體皮膚表面,通常引起醫院感染,主要包括呼吸機相關性肺炎、導管相關性菌血癥、尿路感染、腦膜炎和軟組織感染等。它通常在危重癥病人中具有較高的發病率和死亡率[1-3]。目前,多重耐藥鮑曼不動桿菌正通過全球各地的醫院迅速感染和傳播,其最常在重癥監護病房爆發流行[4-5],因鮑曼不動桿菌具備多種天然耐藥和強大的獲得耐藥及克隆傳播的能力,以及其可以生物膜的形式存活在外部環境,使其能有效抵抗消毒劑、紫外線和宿主免疫的殺傷,并在醫院環境下長期生存,對鮑曼不動桿菌感染的預防及治療已是臨床上的棘手問題[6]。
由于良好的抗菌活性和安全性,氟喹諾酮類藥物廣泛應用于各類革蘭桿菌感染的治療,并作為常見碳青霉烯耐藥革蘭陰性桿菌(Carbapenem-resistant Organism,CRO)首選推薦藥物之一[7],但隨著氟喹諾酮類藥物使用的增加導致院內臨床株鮑曼不動桿菌對這些抗生素的耐藥性快速上升。然而,對氟喹諾酮類藥物的耐藥性通常是由靶酶的改變引起的(DNA回轉酶和拓撲異構酶Ⅳ)[8-9],其次是外排泵的改變和質粒介導Qnr蛋白的產生,有報道,Qnr蛋白可以保護喹諾酮類藥物不受抑制,但Qnr本身只產生低水平的耐藥性,同時Qnr蛋白的存在卻一定程度上促進了高水平耐藥性突變的選擇。DNA gyrase的亞基分別是gyrA基因編碼的97-kDa蛋白gyrA和90-kDa蛋白gyrB。拓撲異構酶Ⅳ的相應亞基為parC(75kDa),gyrA (Ser83Leu)和ParC(Ser80Leu)單氨基酸的替換鮑曼不動桿菌對喹諾酮類藥物的高水平耐藥有關,耐藥性的程度因生物和地理區域而異[10]。為了解臨床株鮑曼不動桿菌gyrA和parC基因的普遍突變與耐藥性的關系,及gyrA和parC突變的風險因素;本研究擬對臨床分離株鮑曼不動桿菌gyrA和parC基因突變進行檢測,詳細分析如下。
1 材料與方法
1.1 菌株來源 收集2017年9月—2018年12月福建醫科大學附屬龍巖第一醫院發生下呼吸道AB感染的住院病人39例,非重復分離其痰液標本AB菌,下呼吸道AB感染診斷標準同相關文獻[11-12],采用美國BD公司Phoenix100全自動微生物鑒定儀及配套試劑鑒定菌種。銅綠假單胞菌ATCC27853、大腸埃希菌ATCC25922購自英國Oxoid公司。
1.2 主要試劑及儀器 LB培養液和PBS緩沖液(上海榕柏公司);PCR試劑盒(大連寶生物公司);DNA Ladder(北京天根公司);Phoenix100全自動細菌鑒定藥敏系統(美國BD公司);PCR擴增儀(Bio-rad公司);DYY-10C電泳儀、WD-9413B凝膠成像分析儀(北京六一儀器廠);5424臺式高速離心機(德國Eppendorf公司);PCR引物由上海生工公司合成。
1.3 藥敏實驗 采用Phoenix100全自動細菌鑒定藥敏系統及配套試劑測定菌株對藥物的最低抑菌濃度(MIC),并根據美國CLSI 2018判斷標準進行藥物敏感性判斷。其中對頭孢菌素類、碳青霉烯類、β-內酰胺酶抑制劑的復合制劑、氟喹諾酮類和氨基糖苷類5類抗生素中≥3類耐藥者判為多重耐藥;對除了多黏菌素外的所有藥物耐藥者判為泛耐藥。
1.4 基因檢測 采用煮沸法提取菌株DNA,挑取新鮮菌落至100μl 去離子H2O煮沸10min,3 000r/min,10min,吸取上清液置于-20℃備用。PCR法檢測gyrA和parC基因,靶基因引物序列見表1,基因擴增體系為25μl:上、下游引物(10μmol/L)各1μl,PCR Taq酶(5U/μl)0.125μl,10×PCR Buffer 2.5μl,dNTP(2.5mmol/L)2μl,MgCl22μl,H2O 13.875μl,DNA模板2.5μl。gyrA及parC基因PCR循環參數為:94℃ 1min;98℃ 10s,60℃ 1min,35個循環;72℃ 10min。產物經15g/L瓊脂糖凝膠電泳觀察,分子量與產物預期分子量相當的判為陽性。擴增產物純化后送公司測序。

表1 靶基因PCR引物序列和產物長度
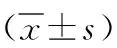
2 結果
2.1 39株臨床株AB菌中,gyrA和parC雙基因突變率為56.4%,gyrA單基因突變率為7.7%,parC單基因突變率為5.1%。見表2。

表2 鮑曼不動桿菌中gyrA及parC基因的突變情況
2.2 gyrA和parC雙基因突變株左氧氟沙星MIC≥64,環丙沙星MIC≥16,gyrA或parC單基因突變左氧氟沙星MIC≥8,環丙沙星MIC≥2。見表3。具體基因測序圖詳見圖1~3。
2.3 攜帶gyrA和parC突變AB菌組病人較攜帶無突變組病人住院時間長(P<0.05);且呼吸機、氣管插管、血液制品及抗生素的使用率更高(P<0.05)。見表4。
2.4 抗生素的使用是gyrA和parC突變獨立風險因素(P<0.05)。見表5。
3 討論
鮑曼不動桿菌作為我國醫療系統院內感染的主要病原體之一,它對紫外線、濕熱和化學消毒劑有較強的抵抗力,在自然界、醫院環境、各類醫療器材上定植率都非常高。氟喹諾酮類藥物作為常見碳青霉烯耐藥革蘭陰性桿菌首選推薦藥物之一,對其耐藥是全球抗感染領域面臨的嚴重威脅[9],主動開展對氟喹諾酮類藥物及其他多重耐藥鮑曼不動桿菌的感染及定植監測,并進行耐藥分析和流行株的突變分析,掌握本機構內耐藥菌株的流行動態,可有效指導臨床抗感染治療和院感防控。

表3 鮑曼不動桿菌中gyrA及parC基因的突變與左氧氟沙星及環丙沙星的MIC

A敏感株 B耐藥株


A敏感株 B耐藥株
研究表明,gyrA和parC的基因突變導致的氨基酸置換在革蘭氏陰性桿菌對奎諾酮的耐藥中起著重要作用[10],但gyrA和parC氨基酸的替換在不同革蘭氏陰性桿菌發生的奎諾酮類耐藥作用不同,在銅綠假單胞菌中,對喹諾酮類藥物的耐藥性主要是由于gyrA基因的突變[13],gyrA和parC雙基因突變是鮑曼不動桿菌對奎諾酮類藥物高水平耐藥的主要原因[14-15],而gyrA和parC基因的三或四種基因位點的突變常導致鮑曼不動桿菌對環丙沙星的高水平耐藥。筆者比較臨床株鮑曼不動桿菌gyrA和parC基因的檢測情況后發現,本研究中尚無同時發生三種及以上基因位點突變的菌株,其中本機構內氟喹諾酮類藥物耐藥的主要流行株是gyrA和parC雙基因位點突變株,其分別是gyrA基因第83位堿基TCA-TTA的點突變和parC基因第80堿基TCG-TTG的點突變,而gyrA(Ser83Leu)和parC(Ser80Leu)的雙突變菌株環丙沙星MIC均≥16,左氧氟沙星MIC均≥64,這與其他研究報道耐藥機制相似。此外,筆者還發現少數parC基因第84堿基GAA-AAA的點突變即parC(Glu84Lys)突變,以及gyrA(Ser83Leu)和parC(Ser80Leu)的單一突變,單一突變環丙沙星MIC≥2,左氧氟沙星MIC≥8。其中,gyrA和parC雙突變的菌株環丙沙星及左氧氟沙星的MIC均高于單一突變菌株(P<0.05)。比較分別感染無gyrA和parC突變和gyrA和parC突變的AB菌病人的臨床資料后發現,感染gyrA和parC突變AB菌組病人住院時間、呼吸機使用率、氣管插管率、血液制品的輸注及抗生素的使用率均高于感染無gyrA和parC突變組病人(P<0.05),其中,抗生素的使用率是AB菌gyrA和parC突變的獨立風險因素(P<0.05),但本文僅初步探討AB菌gyrA和parC突變可能存在的風險因素,研究樣本量較小,數據可能不能完全分析各類抗生素的使用等其他臨床因素對AB菌gyrA和parC突變的影響;此外,AB菌的耐藥與病人本身的免疫水平有很大關系,免疫壓力和藥物壓力可誘導AB菌發生耐藥,病情嚴重的患者往往合并有較多的基礎性疾病,也更有可能接受更多種抗生素的治療,本研究沒有對這些因素調整后進行分析,因此,需大規模、前瞻性的研究來證實各臨床因素可能成為AB菌gyrA和parC突變的風險因素。

表4 患者基線資料

表5 gyrA及parC基因突變的風險因素分析
綜上所述,gyrA(Ser83Leu)和parC(Ser80Leu)的雙突變菌株是本機構AB菌對環丙沙星和左氧氟沙星耐藥的主要流行菌株,也是其對環丙沙星和左氧氟沙星高濃度耐藥的主要原因,而抗生素的使用是AB菌gyrA和parC突變的獨立風險因素。但本研究菌株及病例數較少,尚需擴大樣本量分析AB菌gyrA和parC突變可能存在的其他風險因素。

