高濃度EDTA-Co(Ⅲ)廢水處理工藝探索研究
韓 笑
(浙江華友鈷業股份有限公司, 浙江 桐鄉 314500)
0 前言
某特殊鈷冶金生產過程中,需加入高濃度的EDTA(乙二胺四乙酸),導致其合成尾液中含有大量EDTA,廢水中Co與CODCr都較高,需要經過后續處理才能達標排放(《銅、鎳、鈷工業污染物排放標準》排放標準Co≤1 mg/L、CODCr≤300 mg/L)。
氫氧化鈷廢水主要由硫酸鈉、硫酸鈷及鈷絡合物組成。由生產工藝所決定,廢水中Co大部分以+3價存在,而Co(Ⅲ)與EDTA的絡合物在所有EDTA金屬絡合物中穩定性最高(穩定常數Kf(Co(EDTA)-)=1.0×1036),造成此類廢水使用常見方法處理困難。
EDTA-Co(Ⅲ)廢水處理未見相關報道,而處理EDTA廢水方法主要有化學法、物理法、生化法等,經過相關實驗研究發現:物理吸附法[1]處理絡合Co廢水時吸附不夠完全、吸附容量小,不能滿足廢水處理需求;納濾法[2-4]由于廢水中含有合成過濾后生成的大量納米級氫氧化鈷(Ⅲ)而導致膜容易堵塞,普通酸無法溶解,導致納濾法無法正常使用;廢水中硫酸鈉含量高,會對微生物的生化活性產生抑制,導致該廢水無法應用生化法[5]進行處理;微電解法[6]無法將EDTA分解完全,且微電解法中Fe與Co的活性相近,Fe2+與Co(Ⅲ)相互作用較弱,又由于EDTA-Co(Ⅲ)的穩定性影響,導致Co與CODCr處理效果均不夠理想;同時通過探索,其它方法如:O3氧化法、電解法等也無法將EDTA-Co(Ⅲ)廢水一次性處理達標。
芬頓氧化法是一種高級氧化法,產生的羥基自由基氧化電位高,本研究采用常規沉淀去除重金屬Co、Fenton氧化法降解CODCr。
1 實驗部分
1.1 實驗儀器及試劑
六聯異步攪拌水浴鍋、四聯電磁攪拌機、電感耦合等離子體光譜儀(ICP);EDTANa2、CaO、NaOH、Na2CO3、H2O2、FeSO4·7H2O、K2Cr2O6、H2O2等分析純試劑。
1.2 實驗過程
1.2.1 廢水來源及水質情況
本次實驗全過程使用中試生產氫氧化鈷所產生廢水,其Co濃度為397.4 mg/L、CODCr為2 194.3 mg/L、Na2SO4濃度約為184 g/L、pH為8.5~9.0、EDTA約0.01 mol/L。
1.2.2 EDTA標準CODCr曲線
由于準確測定EDTA較困難,本實驗通過測定CODCr值來表征EDTA濃度情況,繪制CODCr與EDTA濃度標準曲線。
配置EDTA濃度分別為0.005 mol/L、0.01 mol/L、0.015 mol/L、0.02 mol/L標準溶液各100 mL,并進行CODCr的檢測,繪制EDTA與CODCr標準曲線如圖1所示。
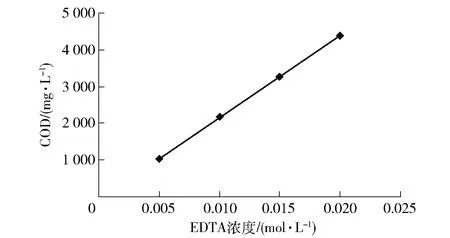
圖1 CODCr與EDTA標準曲線
1.2.3 實驗條件
為避免Co對CODCr影響,本次實驗先進行沉鈷實驗,后以沉鈷后液進行Fenton氧化降解CODCr實驗,最后進行沉鈷與氧化順序實驗。
1.2.4 主要測試項目及方法
CODCr:重鉻酸鉀法(HJ 828—2017);Co:ICP。
2 結果與討論
2.1 沉鈷實驗
2.1.1 沉淀劑的選擇
分別加入8倍理論量的CaO、Ca(OH)2、NaOH、Na2CO3于70 ℃反應4 h沉淀Co。
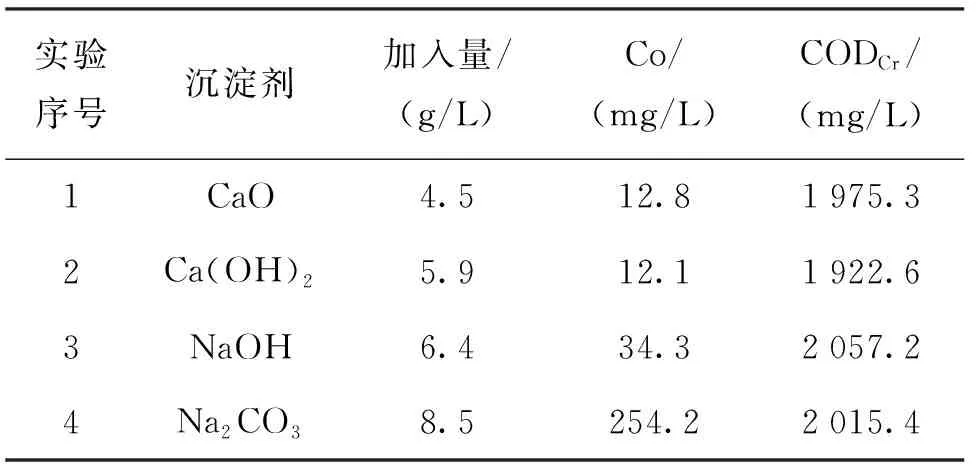
表1 沉淀劑選擇實驗
由于Ca2+可以與EDTA發生絡合,高含量的Ca可以與Co進行置換,故含Ca沉淀劑沉淀效果明顯較好,同時,由于CaO和Ca(OH)2溶解度小,故仍存在大量固體,對絡合Co具有一定的吸附作用,但從CODCr方面進行分析,沉Co的主要反應是置換。而CaO較Ca(OH)2雖然效果稍差,但CaO用量更小、價格更低,故沉鈷所用沉淀劑選用CaO。
2.1.2 溫度對沉鈷效果的影響
CaO加入量為10 g/L、反應6 h時,由圖2可知,溫度越高對沉鈷越有利,但在70 ℃時已趨于平衡,繼續升高溫度效果不夠明顯,在70 ℃時沉鈷后液Co濃度為2.13 mg/L,Co去除率>99%,故實驗確定沉鈷溫度為70 ℃。
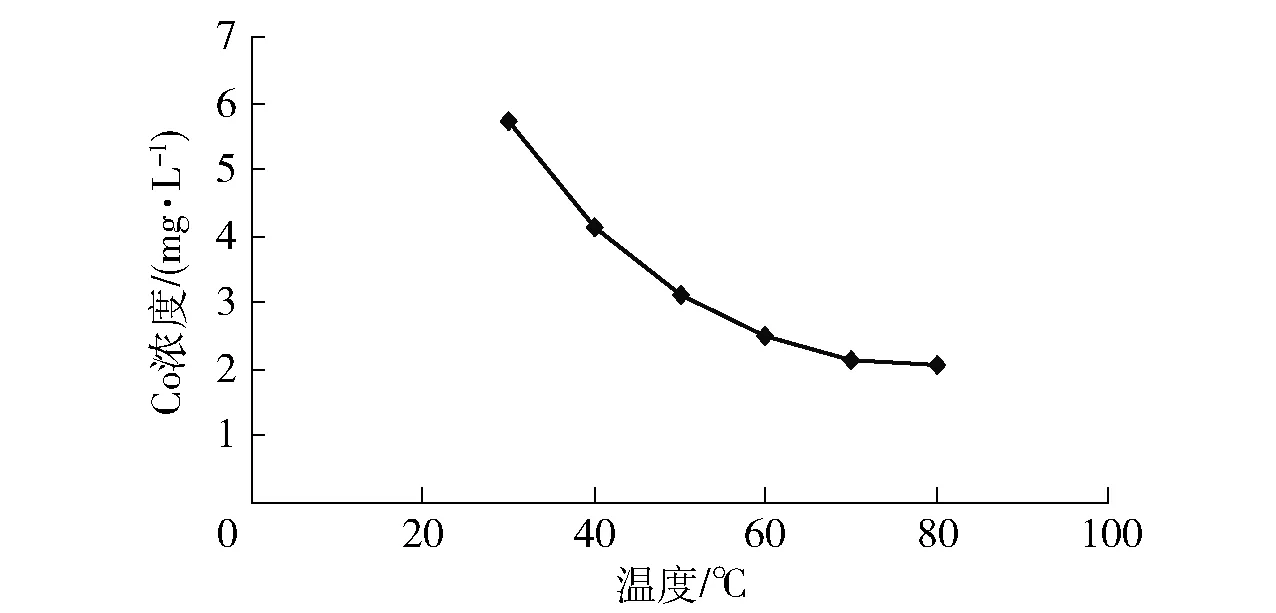
圖2 溫度對沉鈷效果的影響
2.1.3 反應時間對沉鈷效果的影響
CaO加入量為10 g/L、溫度為70 ℃時,由圖3可以看出,時間越長沉鈷效果越好,在4 h后沉鈷效果基本趨于穩定,沉鈷后液中Co濃度降低到2.24 mg/L左右,Co去除率>99%,故實驗確定沉鈷時間為4 h。
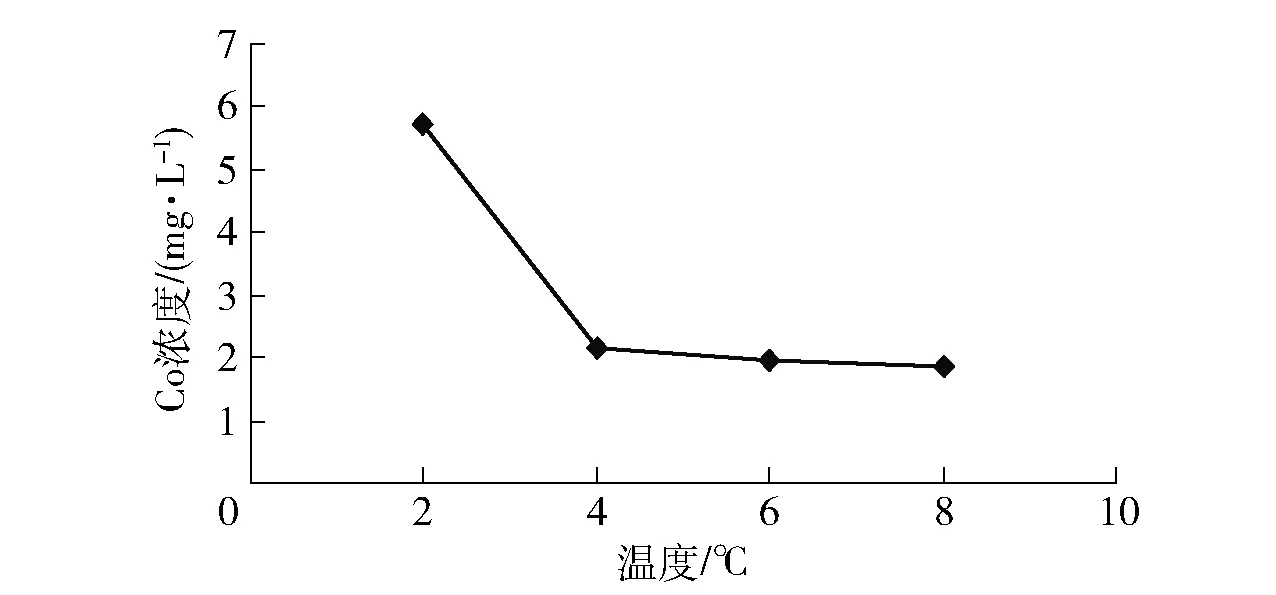
圖3 反應時間對沉鈷效果的影響
2.1.4 CaO加入量對沉鈷效果的影響
反應溫度為70 ℃、時間為4 h時,CaO加入量越大沉鈷效果越好,但在加入量達到10 g/L后沉鈷效果已基本穩定,其原因可能為硫酸體系中CaSO4為微溶物質,而絡合Co可被高濃度Ca進行置換,但Ca達到飽和后,繼續加大CaO加入量已無明顯作用,故實驗確定沉鈷CaO加入量選擇為10 g/L。
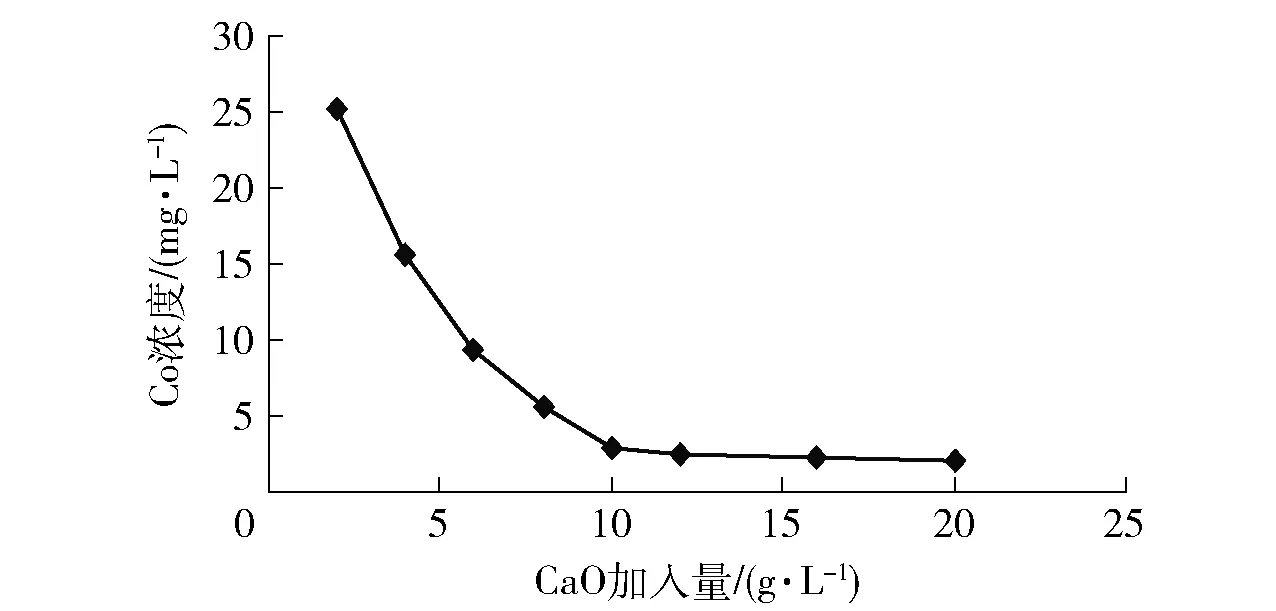
圖4 CaO加入量對沉鈷效果的影響
2.2 CODCr氧化降解實驗
CODCr降解實驗所用廢水為CaO加入量10 g/L時、進行4 h溫度為70 ℃的沉鈷后液,由于過濾后液溫度仍有約65 ℃,故Fenton反應不另行加溫,溫度定為65 ℃。
2.2.1 pH值對CODCr的影響
由圖5可知,不同pH值對CODCr去除率隨pH值的升高先增大后降低,在pH為2.5~3.5時CODCr去除率達到最高。其原因可能為[7~8]:Fenton反應在pH值<3時,Fe2+會形成[Fe(Ⅱ)H2O)5]2+水合物,使Fe2+與H2O2反應速度緩慢,而當pH值>3時,Fe離子會產生沉淀,溶解態的鐵離子減少,Fenton反應受抑制。
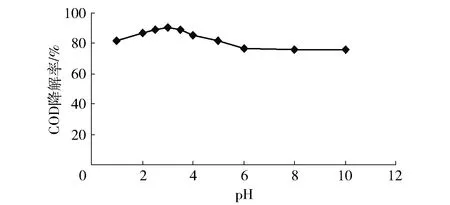
圖5 pH值對CODCr的影響
2.2.2 H2O2投加量對CODCr影響
由圖6可知,CODCr的去除效率隨H2O2投加量的增加而升高,但當H2O2投加量達到980 mmol/L時繼續投加H2O2反而會引起CODCr下降。其原因可能為,過量的H2O2會消耗體系中的·OH,體系的Fenton與類Fenton氧化作用受到限制,使EDTA的分解率下降[9]。實驗確定H2O2的最佳投加量為980 mmol/L。
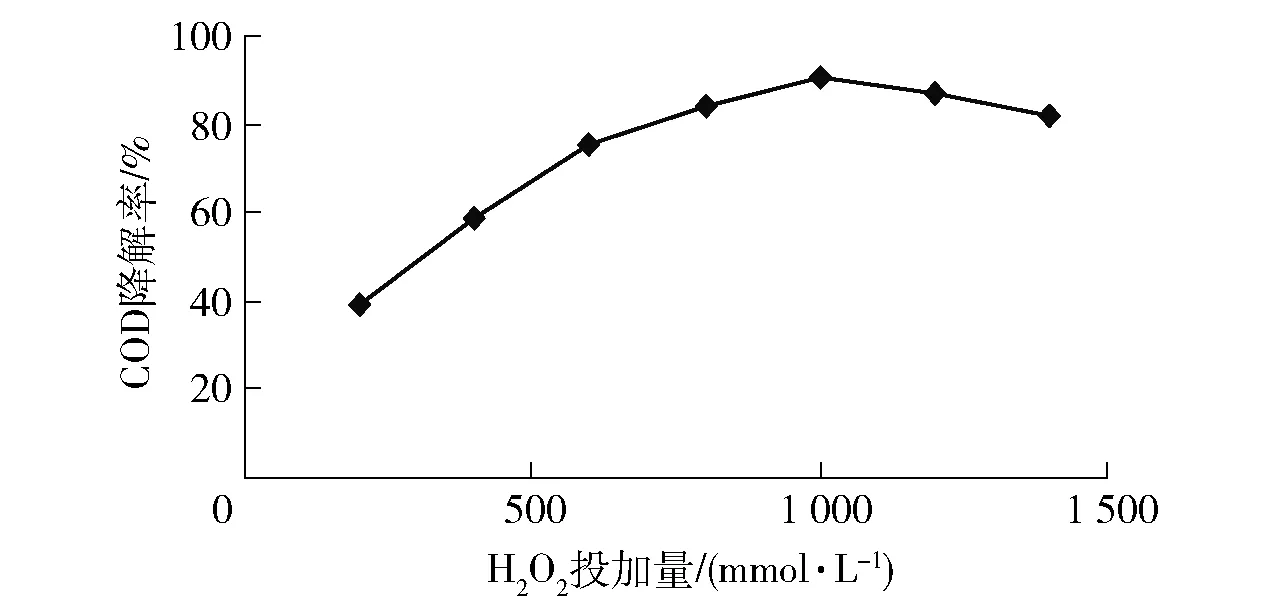
圖6 H2O2對CODCr影響
2.2.3 Fe2+投加量對CODCr的影響
隨著Fe2+投加量的增加,CODCr去除率升高,當Fe2+投加量為11 mmol/L,CODCr去除率達到最大值,繼續增加Fe2+投加量,CODCr去除率趨于穩定。實驗確定Fe2+的最佳投加量為11 mmol/L。
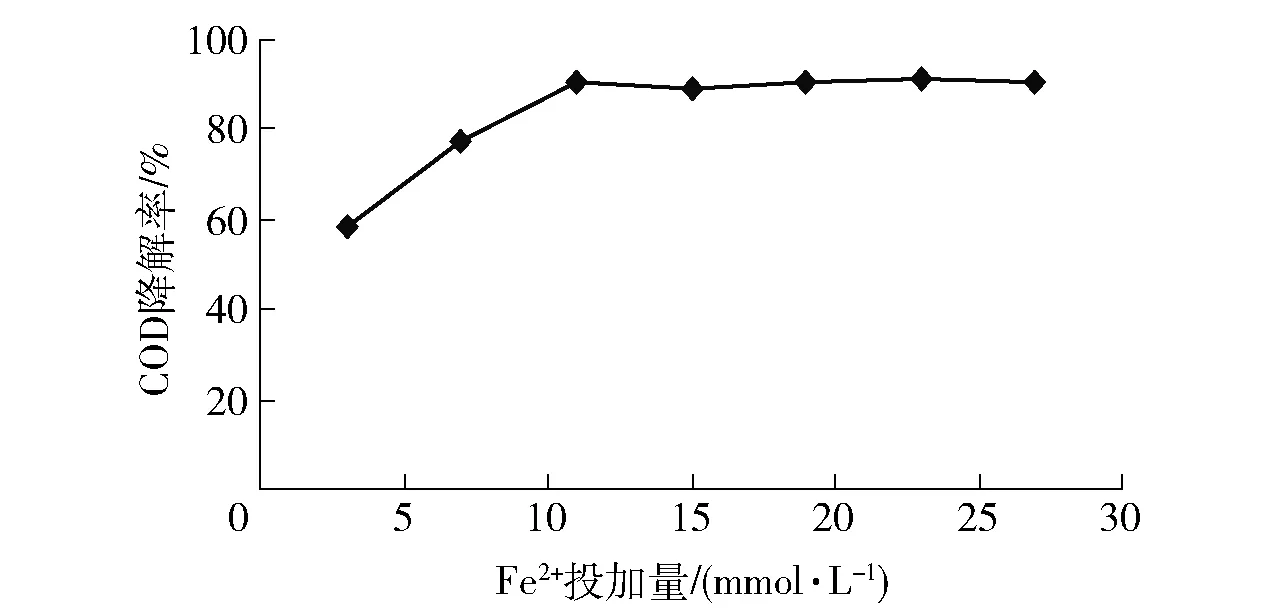
圖7 Fe2+對CODCr的影響
2.3 處理順序對沉鈷效果影響
通過對先沉淀鈷后Fenton氧化實驗與先Fenton氧化后沉淀鈷實驗進行對比,確定不同方案對Co與CODCr的影響,而反應過程中實驗條件根據2.2、2.3節確定,實驗結果如表2所示。
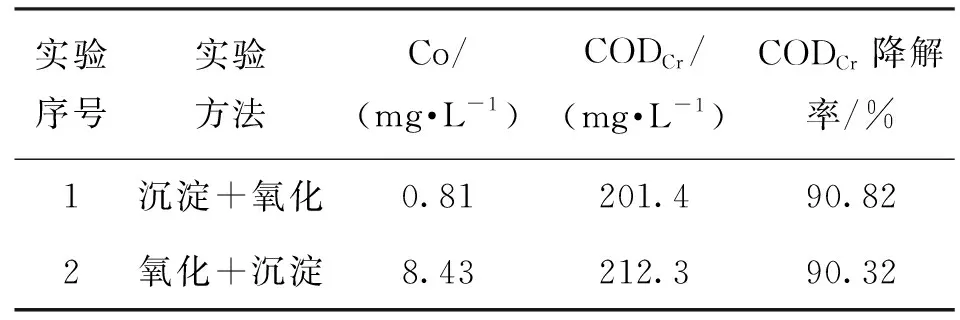
表2 處理順序實驗
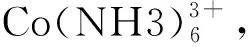
3 結論和展望
絡合廢水先經CaO沉淀除Co,后經Fenton氧化降解CODCr,可以將Co降低到1 mg/L以下、CODCr降低到300 mg/L以下,達到廢水國家二級排放標準。
工藝條件為:沉淀段:CaO加入量為10 g/L、溫度為70 ℃以上、反應時間為4 h、沉鈷完成后過濾;Fenton氧化絮凝段:過濾后液調節pH 2.5~3.5、H2O2加入量為980 mmol/L、Fe2+加入量為11 mmol/L、反應時間為30 min、反應后調節pH為7~9、絮凝沉淀除Fe3+、Co。
通過該方法,廢水可以處理達到國家二級排放標準,但該方法存在過程復雜,成本偏高的問題,有進一步改進的空間,如何提高Fenton試劑的利用率、簡化操作步驟將是后續探索的主要方向,可以考慮通過與微波、活性炭等處理方法聯用,降低Fenton試劑的加入量。

