弓形蟲免疫小鼠對新孢子蟲感染的交叉免疫保護作用
凌慧芳,潘德桐,許建海,李木子,劉 群,劉 晶
(中國農業大學動物醫學院 國家動物寄生原蟲實驗室,北京 海淀 100193)
新孢子蟲和弓形蟲是2種親緣關系非常近的頂復亞門原蟲,能夠感染多種溫血動物,都能夠造成孕畜流產和新生動物的發病和死亡。它們在形態學和基因組學上展現了很大程度的相似性[1],但也有關于系統發育樹、分子學和生物學的研究認為,它們各自遵循不同的進化路線,有不同的生活周期以及不同的宿主傾向性[1]。犬是新孢子蟲的終末宿主,新孢子蟲對牛的危害尤為嚴重,是造成牛流產的最重要的病原之一[2]。貓是弓形蟲的終末宿主,弓形蟲主要危害豬、綿羊、山羊和人類,是一種重要的人獸共患病病原[3]。這2種原蟲感染宿主范圍廣泛,臨床上發生混合感染的情況非常普遍。Dubey等人使用新孢子蟲Nc-1蟲株免疫小鼠,研究其對弓形蟲VEG蟲株的交叉免疫保護力,發現Nc-1免疫的小鼠能夠對弓形蟲弱毒株提供有效保護力,但不能有效保護弓形蟲強毒株的感染[4]。在實際生產中,弓形蟲通常以II型或III型弱毒株感染動物,弓形蟲弱毒株感染是否會對新孢子蟲的再感染產生一定的保護力呢?本研究將通過小鼠免疫弓形蟲弱毒株后再次感染新孢子蟲的試驗進行初步評價。
1 材料與方法
1.1 蟲株、細胞、實驗動物 新孢子蟲Nc-1株,經Dubey授權,本實驗室傳代及保存;弓形蟲RH株(Ⅰ型)、PRU株(Ⅱ型)、VEG株(Ⅲ型),本實驗室傳代及保存;Vero細胞,本實驗室傳代及保存;實驗動物:4~5周齡BALB/c小鼠,購自北京實驗動物研究中心。
1.2 主要材料試劑 弓形蟲陰陽性血清、新孢子蟲陰陽性血清,本實驗室制備保存;DNA提取試劑盒,購自北京艾德萊生物科技有限公司;TaKaRa熒光定量試劑盒,購自寶日醫生物技術(北京)有限公司。
1.3 主要儀器設備 ROCHE LightCycler?480Ⅱ實時熒光定量PCR儀;BIO-RAD酶標儀;FORMASCIENTIFIC CO2培養箱;COLE-PARMER Vibra-Cell 超聲波細胞破碎儀。
1.4 蟲株的培養和收集 取出保存于液氮中的弓形蟲和新孢子蟲蟲株,在37 ℃水浴鍋中迅速融化后,置于DMEM培養基中洗滌離心,用2%胎牛血清的DMEM培養基重懸接種于鋪滿Vero細胞的培養瓶內,于37 ℃ 5%CO2的培養箱中培養。待蟲體大量釋放時,用細胞刮刮落細胞,26G針頭的注射器反復吹打釋放蟲體,最后用5 μm的濾器濾過細胞碎片收集蟲體并計數。
1.5 小鼠的免疫及攻蟲試驗 分別用弓形蟲PRU和VEG蟲株對小鼠免疫。首免后2周進行二免,二免后1周采取腹腔注射新孢子蟲Nc-1速殖子的方式對小鼠攻蟲,試驗分組和接種劑量見表1。觀察臨床癥狀,記錄每組小鼠的死亡時間,繪制死亡曲線。每2天記錄1次小鼠的體重。攻蟲后30 d,采集試驗小鼠血液及腦組織。

表1 免疫程序及攻蟲試驗Table 1 Immune procedure and challenges
1.6 抗體水平檢測
1.6.1 新孢子蟲和弓形蟲速殖子全蟲抗原制備 分別取新孢子蟲與弓形蟲速殖子108個,加入200 μL的PBS,經過3次反復凍融后,用冰浴超聲裂解(工作時間1 min,工作2 s,間歇4 s,30%功率)30次。2 000 r/min 離心10 min,上清過濾后測定蛋白濃度,置-80 ℃凍存。
1.6.2 ELISA檢測 全蟲抗原蛋白包被96孔聚苯乙烯微量反應板,2 μg/mL,每孔100 μL,4 ℃過夜;次日用磷酸鹽緩沖液洗滌4遍;5%脫脂乳封閉1 h;洗滌(同上);用抗體稀釋液將小鼠血清進行1∶100倍稀釋,同時設置陰、陽性血清對照,37 ℃ 孵育1 h;洗滌(同上);加入羊抗鼠HRP-IgG (1∶5 000),37 ℃孵育1 h;洗滌(同上);將顯色液A液和B液1∶1混合均勻,每孔100 μL,避光顯色10 min;加入終止液50 μL/孔終止顯色;酶標儀讀取OD450值。
1.7 腦荷蟲量檢測 提取107個新孢子蟲速殖子的DNA,進行10倍倍比稀釋,設置5個梯度;提取BALB/c小鼠腦組織DNA,測定濃度并進行10倍倍比稀釋,共5個梯度,根據小鼠的28S基因和新孢子蟲Nc5基因序列設計特異性Real-time PCR引物。記錄不同稀釋度樣品的Ct值,繪制標準曲線,檢測小鼠腦荷蟲量。
1.8 統計方法 采用SPSS22.0統計軟件One Way ANOVA分析,以P<0.05作為顯著性標準,以P<0.01作為極顯著標準,統計數據結果以“平均值±標準差”表示。
2 結果
2.1 小鼠臨床表現 各組小鼠在免疫后及攻蟲后均未出現明顯的臨床癥狀,被毛光滑有光澤,精神狀態良好,活潑好動,對環境有好奇感,采食積極,采食量及飲水量均正常。攻蟲后VEG免疫組和PRU免疫組與PBS空白對照組體重變化無明顯差異,見圖1。

圖1 小鼠體重變化Fig.1 Changes in body weight of mice
2.2 小鼠血清抗體檢測 各免疫組的小鼠在免疫階段受到弓形蟲免疫后,又經新孢子蟲Nc-1攻蟲,其血清中同時存在針對Nc-1以及弓形蟲RH的抗體,但是各組的抗體水平較空白對照組無明顯差別(P=0.128,0.543>0.05),見表2。PBS空白對照組小鼠在免疫階段未受到弓形蟲免疫,經新孢子蟲Nc-1感染后,其血清能與弓形蟲全蟲抗原產生交叉反應且抗體水平較高,表明新孢子蟲與弓形蟲之間交叉抗原的存在。

表2 小鼠血清抗體水平Table 2 Serum antibody level of mice
2.3 小鼠腦荷蟲量檢測 小鼠腹腔接種新孢子蟲Nc-1株5×106/只,30 d后提取小鼠的腦組織DNA,Real-time PCR 檢測小鼠腦組織中新孢子蟲的荷蟲量。PRU和VEG免疫組與未免疫組相比,小鼠腦荷蟲量更低,且具有統計學差異(P=0.013,0.003<0.05,差異顯著),見圖2。說明弓形蟲PRU和VEG蟲株感染后產生的免疫力,對新孢子蟲Nc-1的再感染具有明顯的保護效果。
3 討論
本研究發現,經PRU和VEG免疫的小鼠經新孢子蟲Nc-1攻蟲后,其血清中可以產生高滴度的抗體,能被弓形蟲RH蟲株全蟲抗原識別,說明弓形蟲PRU蟲株、VEG蟲株和弓形蟲強毒株RH蟲株之間存在交叉抗原。空白對照組盡管未免疫弓形蟲,但在新孢子蟲Nc-1感染后弓形蟲血清抗體也是陽性,說明新孢子蟲和弓形蟲之間也存在交叉抗原。以往有研究證明,弓形蟲或新孢子蟲的特異性抗體在酶聯免疫吸附試驗(ELISA)和間接免疫熒光抗體試驗(IFAT)中均存在交叉反應[5-6],Nishikawa Y等人發現鼠源和貓源的弓形蟲陽性血清均與新孢子蟲可溶性抗原有交叉反應,表明新孢子蟲與弓形蟲存在交叉抗原[7],弓形蟲和新孢子蟲保守的蛋白質和基因序列同樣也證明了它們之間交叉反應表位存在的可能性[8]。
免疫組小鼠的腦荷蟲量較空白組顯著降低,說
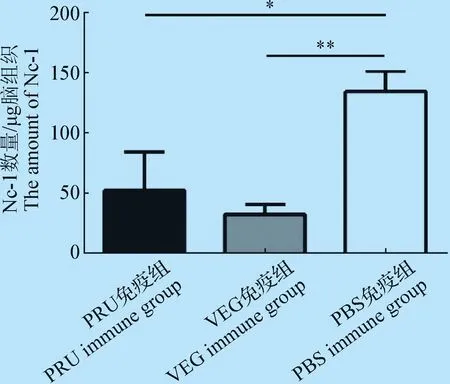
圖2 小鼠腦荷蟲量檢測Fig.2 Detection of parasite load in brain of mice*:P<0.05,兩組之間差異顯著;**:P<0.01,兩組之間差異極顯著*:P<0.05,the difference between the two groups is significant;**:P<0.01,the difference between the two groups is extremely significant
明經過PRU、VEG免疫的小鼠對新孢子蟲的再感染具有一定的抵抗作用,其機制可能是由于弓形蟲和新孢子蟲之間交叉抗原誘導產生交叉抗體的結果,交叉抗原在寄生蟲誘導機體產生免疫反應過程中充當著重要的角色,使宿主應對弓形蟲和新孢子蟲的感染產生相似的免疫應答反應[9],弓形蟲的預先免疫產生的免疫反應可以有效對新孢子蟲的再次感染產生交叉保護力。有學者通過構建弓形蟲微線體蛋白1(MIC1)、微線體蛋白3(MIC3)敲除減毒蟲株對小鼠進行免疫,免疫后再用新孢子蟲大劑量感染,免疫組小鼠存活率為80%,而空白對照組的小鼠存活率僅為30%,表明弓形蟲減毒株的免疫對新孢子蟲感染有保護作用,2種蟲株之間有明顯的交叉免疫保護作用[10]。
交叉免疫保護力的研究與感染模型的選擇、免疫劑量、攻蟲劑量和蟲株毒力高低有著密切的關系,且免疫所產生的交叉免疫保護力是有限的。在本研究中弓形蟲PRU、VEG蟲株對Nc-1再次感染產生了一定的保護力,免疫組小鼠腦荷蟲量與對照組相比顯著降低,但產生的交叉免疫保護力并沒有完全抑制新孢子蟲形成腦包囊。我們也嘗試評估新孢子蟲Nc-1免疫小鼠對弓形蟲強毒株RH的抵抗力,攻蟲小鼠在12 d內全部死亡,表明新孢子蟲的免疫對于弓形蟲強毒株的感染沒有產生有效的交叉免疫保護力。
對弓形蟲和新孢子蟲交叉免疫保護力的評估,基于2種蟲株之間交叉抗原的存在,隨著各種新興技術的發展,交叉抗原的篩選方法也越發多樣。應用蛋白組學的方法使用免疫印跡技術和基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS)技術,可發現存在于弓形蟲和新孢子蟲之間的多種交叉反應抗原[11],通過大量制備抗新孢子蟲的單克隆抗體,同樣也可以篩選得到多種新孢子蟲和弓形蟲的交叉抗原[12]。其中,一種42 kDa弓形蟲棒狀體蛋白、核苷三磷酸水解酶(NTPase)、緩殖子特異性蛋白(BAG5)、蛋白質二硫鍵異構酶(PDI)、核糖體蛋白(RP1),熱休克蛋白(HSP70)已被證實與新孢子蟲有交叉免疫反應活性[12-15]。本實驗室也發現,抗弓形蟲MIC3的抗體能夠與新孢子蟲MIC3發生交叉反應,TgMIC3重組蛋白的免疫小鼠對弓形蟲和新孢子蟲的感染均有一定的保護作用,且小鼠感染弓形蟲后的存活時間延長,新孢子蟲腦荷蟲量也顯著降低[16]。
弓形蟲和新孢子蟲之間存在大量的交叉抗原,這些交叉抗原能夠在免疫反應中產生一定程度的交叉識別。交叉抗原的發現為我們對這2種病原交叉保護力的研究提供了理論依據,同時這種交叉免疫保護力也可能成為開發疫苗的候選策略。

