同時檢測豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜和伊維菌素UPLC-MS/MS方法的建立
王宏磊,劉義明,徐 飛,陳孝杰,張志博,華偉毅,蔣玲玉,李秀波
(中國農業科學院飼料研究所 國家飼料藥物基準實驗室,北京 海淀 100081)
動物寄生蟲病是危害養殖業發展的一種重大疾病,能夠使患病動物表現為生產緩慢、抵抗力低下,嚴重時致動物死亡,給養殖業帶來嚴重的經濟損失。傳統的動物抗寄生蟲藥毒性大、殘留高、效力低,在動物養殖業的使用過程中受到了一定的限制[1-2]。芬苯達唑是人工合成的芳香雜環化合物,屬于苯并咪唑類藥物。奧吩達唑和芬苯達唑砜是芬苯達唑在動物體內的主要代謝物[3]。芬苯達唑的化學名稱為苯硫咪胺甲酯,為白色或類白色粉末,無臭,無味,能溶解于冰醋酸、二甲基亞砜,微溶于甲醇,不溶于水[4]。其驅蟲譜廣泛、毒性小、安全范圍大,是國內首選的動物驅蟲藥[5]。伊維菌素是阿維菌素類藥物的一種,由鏈霉菌發酵產生的一種大環內酯類抗生素驅蟲藥[6],為白色結晶粉末、無味,能溶于甲醇、乙腈、丙酮,幾乎不溶于水,微有引濕性。其作用機理是干擾寄生蟲的神經活動,導致寄生蟲出現麻痹死亡[7-8],抗蟲譜廣、高效、安全[9-10]。芬苯達唑和伊維菌素主要用于豬、馬、牛、羊、犬、貓、野生動物等的驅蟲。二者聯合用藥,擴大了驅蟲譜,提高了一次性驅蟲效果,減輕了人們多次給藥的麻煩,也減輕了多次給藥對動物機體的應激刺激,并且兩者不同的殺蟲機制使其具有協同作用,降低耐藥蟲株的產生。目前沒有同時測定血漿中芬苯達唑、奧芬達唑、芬苯達唑砜和伊維菌素的方法,本文建立了同時測定豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜和伊維菌素的超高效液相色譜質譜聯用儀(UPLC-MS/MS)方法,該方法操作簡單、穩定性好,回收率高,定量限低,抗干擾能力強,適用于血漿中這4種藥物的同時檢測,為血漿中芬苯達唑、奧芬達唑、芬苯達唑砜和伊維菌素的藥物代動力學研究提供檢測方法。
1 材料與方法
1.1 儀器 超高效液相色譜儀(ACQUITY UPLC,美國 WATERS公司),質譜儀 (Xevo TQ-S Mass Detector 美國 WATERS公司),CPA4202S電子天平(德國 Sartorius公司),N-EVAP112氮氣濃縮儀(美國 Organomation公司),Biofuge stratos低溫離心機(美國 Thermo Fishers公司),Reference移液槍(美國 Eppendorf公司),KQ-30B0DE數控超聲波清洗器(中國 舒美公司),N-EVAP-24超純水系統(德國 Membrapure公司),G560E渦動議(美國 Scientific industry公司)。
1.2 試劑 芬苯達唑標準品(中國獸醫藥品監察所,批號:H0441108,含量:100.0%),奧芬達唑標準品(德國Dr.Ehrenstorfer公司,批號:112511,含量:98.0%),芬苯達唑砜標準品(加拿大多倫多研究化學公司,批號:#1-EQJ-10-1,含量:100%),伊維菌素標準品(中國獸醫藥品監察所,批號:K0191406,含量:91.0%)。甲醇、乙腈、甲酸銨為質譜純,均購自美國Fisher公司。固相萃取小柱:Bond Elut C18 500 mg/6 mL,購自美國Agilent公司。0.22 μm針筒式微孔濾膜,購自美國WATERS公司。2 mL醫用注射器,購自中國康壽公司。
1.3 方法
1.3.1 色譜及質譜條件
1.3.1.1 色譜條件 色譜柱:Waters Acquity UPLC BEH C18(50 mm×2.1 mm,1.7 μm),柱溫35 ℃,流動相A:5 mmol/L甲酸銨溶液,流動相B:甲醇,流速:0.3 mL/min,進樣體積2 mL。梯度洗脫見表1。

表1 梯度洗脫條件Table 1 Gradient elution condition (%)
1.3.1.2 質譜條件 電噴霧離子源(ESI),正離子模式,電噴霧毛細管電壓和錐孔電壓分別為3.2 KV、30 V霧化溫度為800 ℃,去溶劑氣流速和錐孔反吹氣流量分別為500 L/Hr、150 L/Hr,二級碰撞氣為氬氣,檢測方式為多反應監測(MRM)。芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的母離子、子離子參數如表2所示。

表2 芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的質譜參數Table 2 Mass spectrum parameters of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin
1.3.2 儲備液的配制 芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素儲備液的配置:分別精密稱取芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素標準品50.00 mg、51.02 mg、50.00 mg、54.95 mg,然后加入到50 mL的容量瓶中。先向裝有芬苯達唑、奧芬達唑、芬苯達唑砜的50 mL的容量瓶中加入10 mL的冰醋酸,然后渦旋1 min、超聲10 min,使其完全溶解,最后加入甲醇定容至50 mL。向裝有伊維菌素的容量瓶中直接加入甲醇定容至50 mL,然后渦旋1 min、超聲10 min。得到濃度為1 000 μg/L的4種標準儲備液,將標準儲備液放置在-20 ℃的冰箱中備用。
1.3.3 樣品前處理
1.3.3.1 樣品提取 取1 mL血漿于10 mL的離心管中,加入2 mL乙腈,渦動1 min,在5 000 r/min、 10 ℃的條件下離心10 min,將提取液轉移到50 mL的離心管中。再向殘渣中加入1 mL的乙腈,按照上述條件進行2次離心,將提取液與第1次的合并,然后向合并的提取液中加入30 mL的水。
1.3.3.2 樣品的凈化 將SPE小柱固定在固相萃取真空裝置上,用5 mL的乙腈活化小柱,5 mL乙腈-水-三乙胺(V∶V∶V=40∶60∶0.1)平衡小柱,將上一步得到的提取液全部過柱。在提取液過柱的過程中,調節真空泵的壓力,使液體1滴/s勻速流下。最后用5 mL的甲醇-乙腈(V∶V=1∶1)進行洗脫,收集洗脫液于10 mL的離心管中。在40 ℃水域下用氮氣吹干。用1 mL 0.1%甲酸甲醇溶液復溶,過0.22 μm針筒式微孔濾膜,待上機檢測。
1.3.4 檢測限和定量限 用處理過的空白血漿提取液作為稀釋液,配置一系列不同濃度的芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素混合基質添加液,過0.22 μm針筒式微孔濾膜,然后上機檢測。以信噪比S/N≥3的最小濃度作為檢測限,以信噪比S/N≥10的最小濃度作為定量限。
1.3.5 準確度和精密度 準確度:將一定濃度的芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素混合標準溶液添加到空白血漿中,配成高、中、低3個濃度的樣品,每個濃度5個平行,計算回收率,衡量準確度。精密度:將一定濃度的芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素混合標準溶液添加到空白血漿中,配成高、中、低3個濃度的樣品,每個濃度5個平行,1 d內每個濃度測定5個樣品,每個濃度進行5 d的試驗。
1.3.6 工作曲線 用處理過的空白血漿提取液將芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素混合標準儲備液稀釋成濃度為100 μg/L、75 μg/L、50 μg/L、25 μg/L、10 μg/L和1 μg/L的樣品液。用已建立的檢測方法測定芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的峰面積,以芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的濃度對峰面積進行線性回歸分析。
1.4 動物給藥及采血 選擇(20±2) kg的健康豬2頭,按7.5 mg/(kg·bw)的劑量經胃管一次性給予復方芬苯達唑伊維菌素粉劑(規格:100 g含有芬苯達唑12 g、伊維菌素0.6 g,用法用量以芬苯達唑計),藥物用水沖服,再以適量的水沖洗胃管。在給藥后的1 h從豬的前腔靜脈采血10 mL,血樣采集后放入預先用肝素鈉處理過的離心管,在3 000 r/min離心10 min后吸取上清,置于-20 ℃保存備用。
1.5 血漿樣品檢測 按照1.3.3 樣品前處理方法處理采集的血漿樣品,按照1.3.1 色譜及質譜條件進行血漿樣品的檢測。
2 結果
2.1 檢測限和定量限 按照信噪比S/N≥3的最小濃度作為檢測限,信噪比S/N≥10的最小濃度作為定量限的要求,得出芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的檢測限分別為0.05 μg/L、0.05 μg/L、0.05 μg/L和0.01 μg/L,定量限分別為0.1 μg/L、0.1 μg/L、0.1 μg/L和0.2 μg/L。定量限的色譜圖見中插彩版圖1~4。
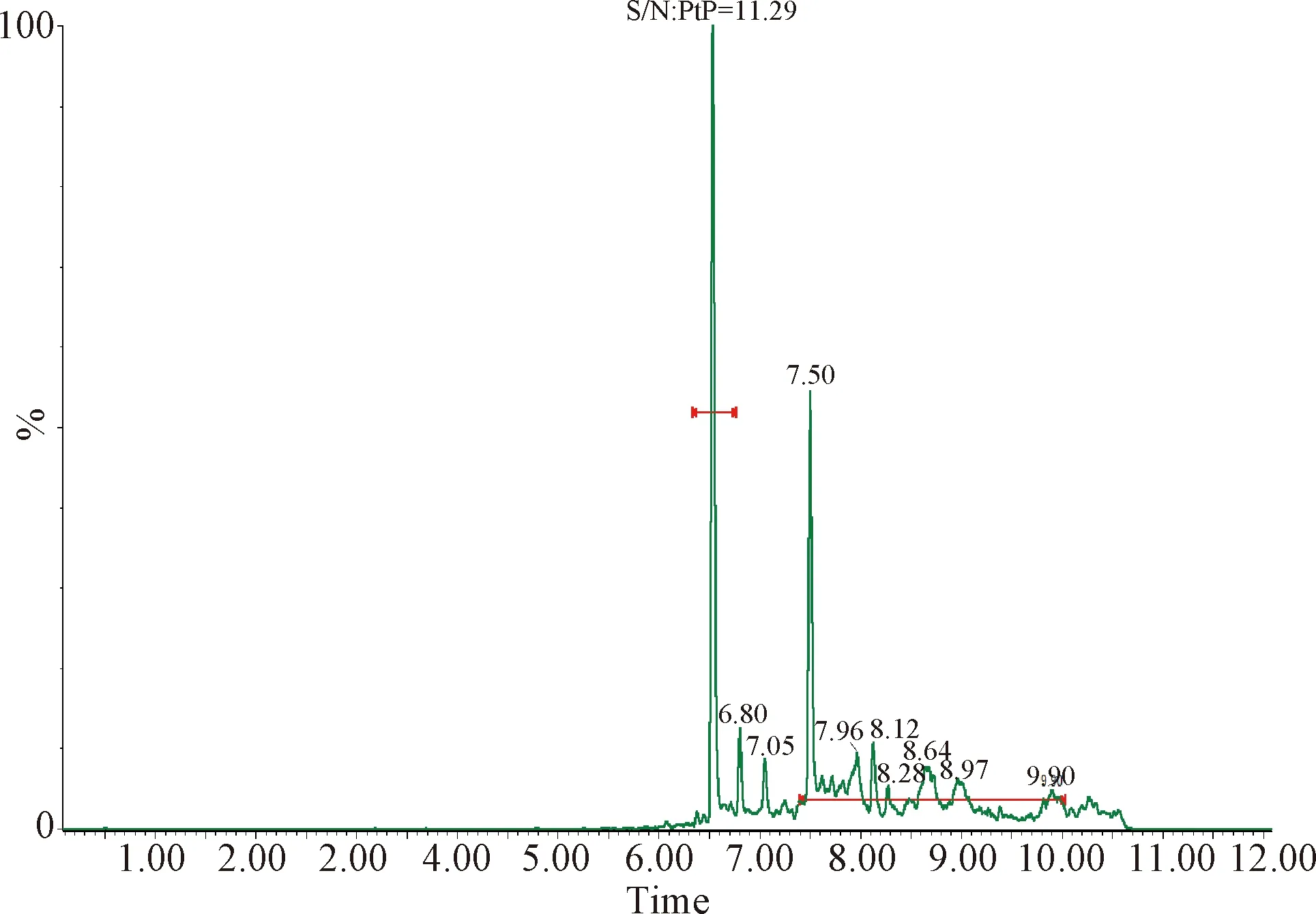
圖1 血漿中芬苯達唑的定量限Fig.1 Quantitative limit of fenbendazole in plasma
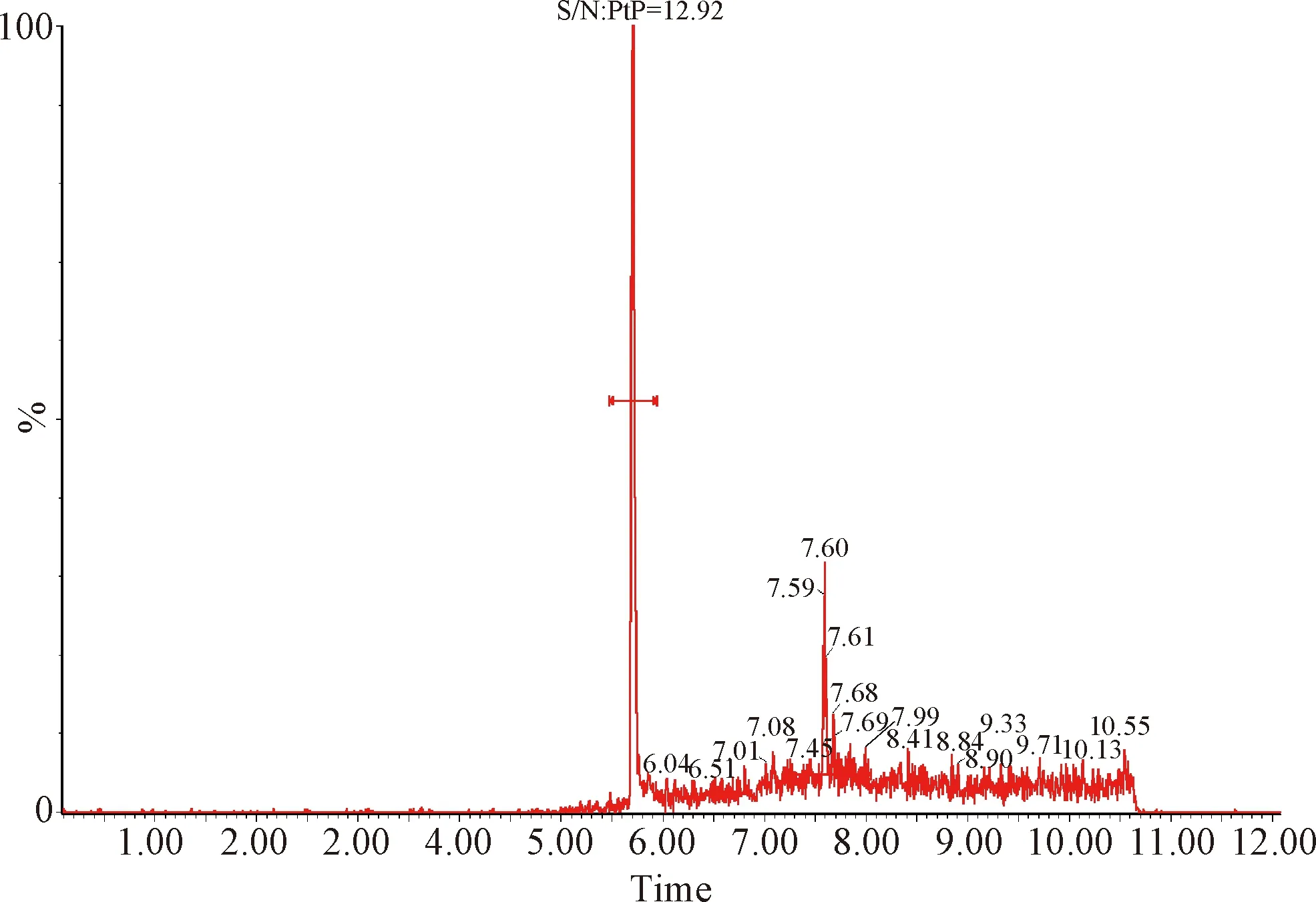
圖2 血漿中奧芬達唑的定量限Fig.2 Quantitative limit of oxfendazole in plasma

圖3 血漿中芬苯達唑砜的定量限Fig.3 Quantitative limit of fenbendazole sulfone in plasma
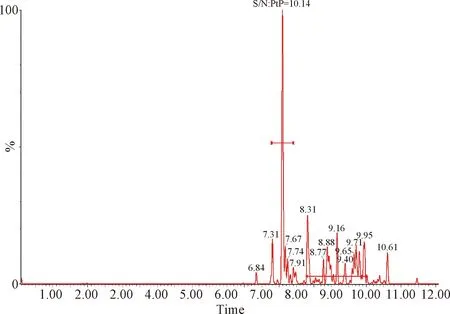
圖4 血漿中伊維菌素的定量限Fig.4 Quantitative limit of lvermectin in plasma
2.2 準確度和精密度 方法的準確度是指試驗中的測定值與準確值的接近程度,一般在樣品檢測時用樣品的添加回收率來體現方法的準確度。精密度表示方法的重復性,是指同一樣品的測定結果與平均值的偏離程度。方法的精密度通常用相對標準偏差表示,也稱變異系數,用RSD表示,能夠反映隨機誤差的大小。芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素在3個不同濃度的回收率范圍分別為89.42%~94.33%、79.05%~92.28%、86.19%~92.29%、82.09%~88.40%。批內變異系數的范圍分別為1.71%~7.11%、1.80%~12.99%、2.37%~17.90%、3.74%~13.70%。批間變異系數的范圍分別為4.43%~6.27%、5.05%~10.44%、5.73%~8.84%、5.74%~9.97%。如表3。
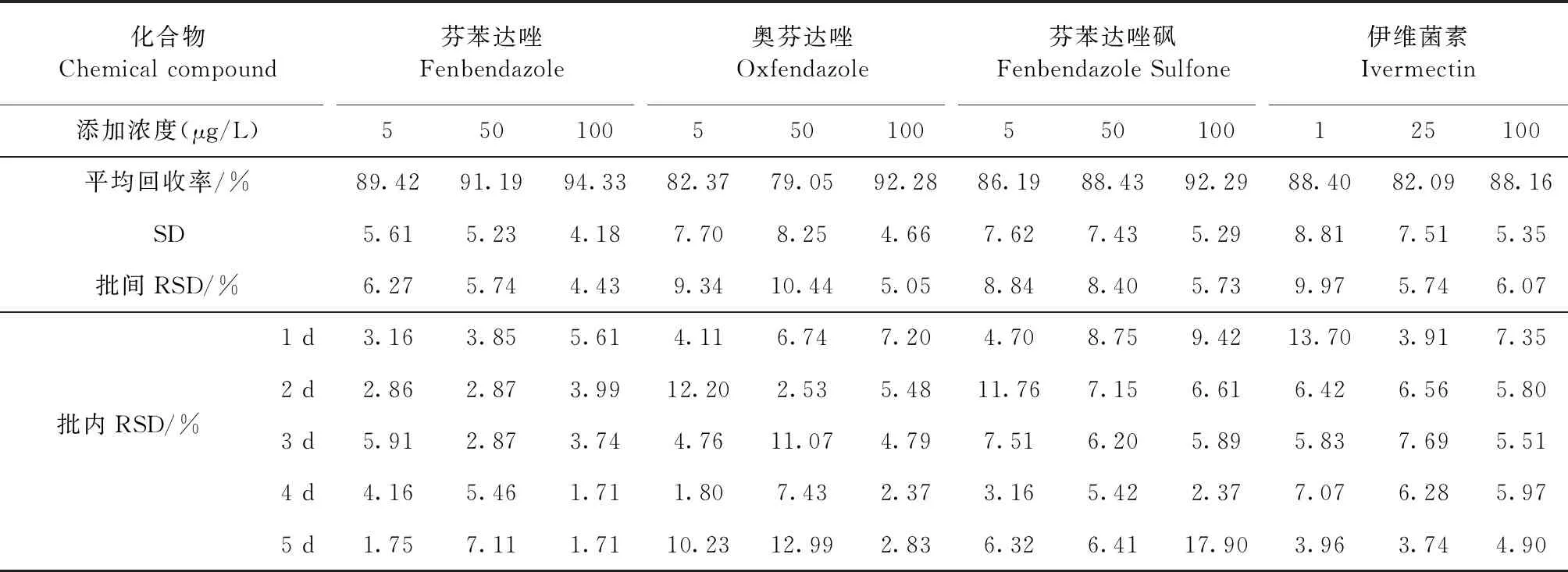
表3 血漿中芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的回收率及批間、批內變異系數Table 3 Recovery rate,inter and intra batch variation coefficient of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma
2.3 線性范圍 以色譜圖上的藥物峰面積為縱坐標y,以藥物的添加濃度為橫坐標x,用加權最小二乘法進行線性回歸分析后,得到的芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的線性回歸方程和相關系數,如表4。

表4 血漿中芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的回歸方程和相關系數rTable 4 Regression equation and correlation coefficient r of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma
2.4 血漿樣品檢測 給藥后1 h的2頭試驗豬血漿的檢測結果如下:1號豬芬苯達唑、奧芬達唑、芬苯達唑砜和伊維菌素的濃度分別為28.8 μg/L、37.3 μg/L、1.28 μg/L和4.04 μg/L;2號豬4種藥物的濃度分別為22.7 μg/L、29.9 μg/L、1.2 μg/L和3.9 μg/L。血漿色譜圖如圖5~8。

圖5 1號豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的總離子流圖Fig.5 Total ion flow diagram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 1 pig
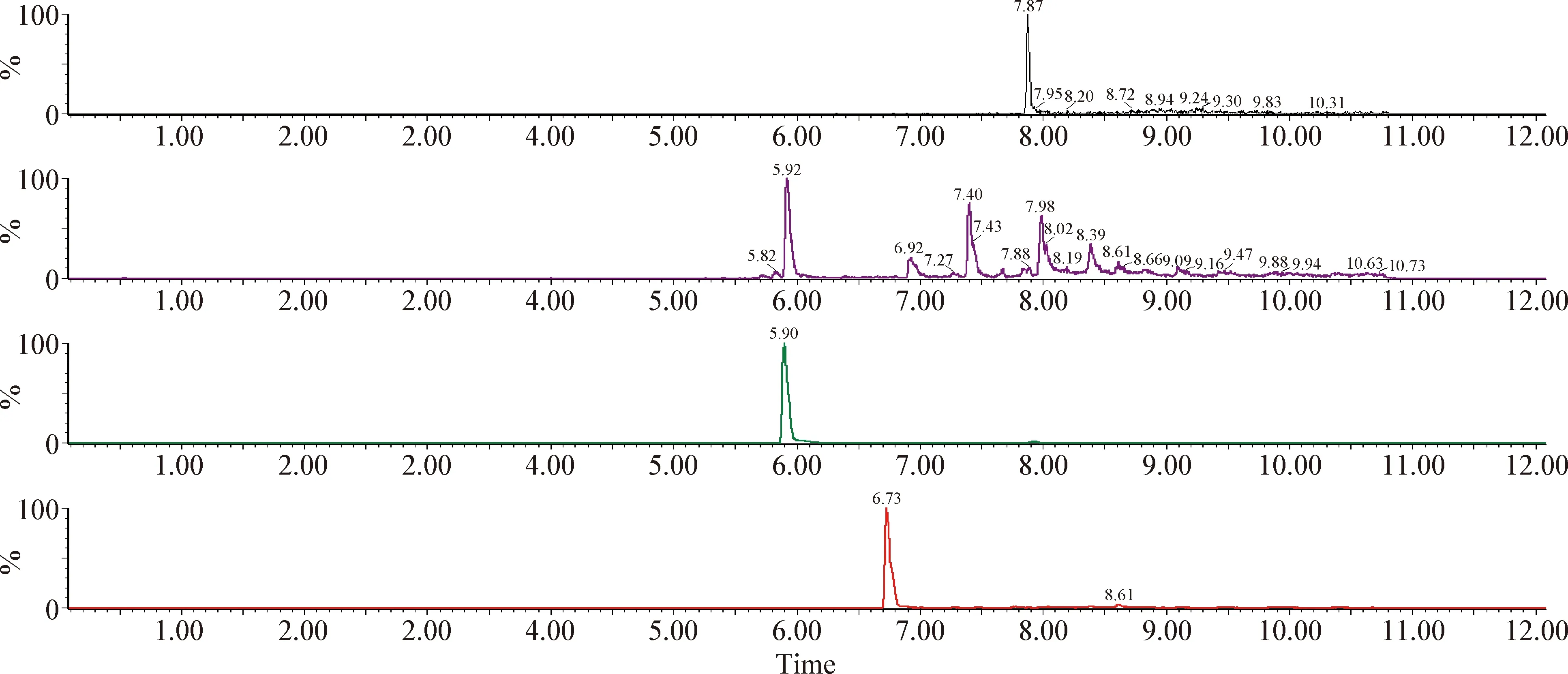
圖6 1號豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的色譜圖Fig.6 Chromatogram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 1 pig
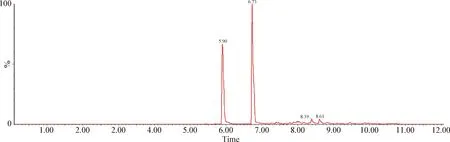
圖7 2號豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的總離子流圖Fig.7 Total ion flow diagram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 2 pig

圖8 2號豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的色譜圖Fig.8 Chromatogram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 2 pig
3 討論
3.2 提取劑的選擇 選擇合適的提取液來提取血漿或牛奶中的伊維菌素和芬苯達唑已經有大量的研究和報道。乙腈對糖、脂肪、蛋白質的溶解性較小,且可以沉淀血漿中的蛋白質,還可以與血漿中的水以任意比例混溶[13]。周鑫等[8]比較了用丙酮、二氯甲烷、乙腈和乙酸乙酯作為提取液提取牛奶中的伊維菌素,得出乙腈是理想的提取劑。邢麗紅等[14]比較了乙腈、甲醇和乙酸乙酯作為提取液提取鱸魚組織中的伊維菌素的提取效率,結果表明,乙腈的回收率高、乙酸乙酯和甲醇的回收率低。范盛先等[13]用乙腈提取豬牛羊可食性組織的阿苯達唑類藥物,得到的回收率都在75%以上。Fletouris D J等[15]用乙腈提取牛奶中的芬苯達唑,回收率接近100%。劉洪斌[16]用含5%乙酸的乙腈提取牛奶中12種苯并咪唑類藥物,平均回收率在70%以上。所以本試驗也選擇了提取能力強的乙腈作為提取液。結果表明,4種藥物的峰形好、雜質峰較少、基質干擾程度低。
3.3 固相萃取小柱的選擇 楊君宏等[17]和王亮[18]用堿性氧化鋁固相萃取小柱凈化牛肉組織中的伊維菌素,回收率在70%以上。本試驗開始選用的是堿性氧化鋁固相萃取小柱,但是凈化的效果不佳,芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的回收率都只有50%左右。對固相萃取小柱進行改進,參照王梅等[19]、岳虹等[20]和Moreno L等[21]采用C18固相萃取小柱凈化伊維菌素和芬苯達唑的方法,本試驗中4種藥物的回收率都達到了70%以上,并且藥物峰與雜質峰能夠分開。對凈化方法進一步優化,參考周德剛等[22]對兔排泄物中的伊維菌素的提取方法,在過柱之前向乙腈提取出的溶液中加入30 mL的水,將提取液稀釋成10%的乙腈溶液,然后再過固相萃取小柱,4種藥物的回收率可以達到80%以上。
3.4 色譜柱的選擇 李晶[23]對C8和C18色譜柱的分離效果進行了比較,C8柱比C18柱的出峰時間短,導致芬苯達唑、奧芬達唑、芬苯達唑砜難以和雜質干擾峰分離完全,故其選用了C18色譜柱。丁艷[24]測定復方芬苯達唑片中芬苯達唑和吡喹酮的含量和吳海港[4]測定豬血漿中的芬苯達唑選用的都是C18色譜柱,得到的芬苯達唑的色譜圖峰形好。故本試驗也選用了C18色譜柱,能夠得到峰形好、出峰時間早的4種藥物的色譜圖。
3.5 檢測限和定量限 郜進[5]測定狗血漿中芬苯達唑、奧芬達唑、芬苯達唑砜的檢測限為2 μg/L、定量限為5 μg/L,本試驗得到的豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜的檢測限為0.05 μg/L、定量限為0.1 μg/L,檢測限和定量限都更低。
3.6 回收率及標準曲線 本試驗得到的芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素的回收率都在80%以上,回收率比較高。4種藥物的線性方程都比較好,其相關系數r都在0.999 2以上,說明線性方程的擬合度高,滿足工作曲線的要求,可以用于血漿樣品中4種藥物的含量測定。
3.7 血漿樣品檢測 在2個試驗豬的血漿中均檢測到了芬苯達唑、奧芬達唑、芬苯達唑砜、伊維菌素。1號豬血漿中4種藥物的濃度分別為23.9 μg/L、207.3 μg/L、32.3 μg/L、15.2 μg/L;2號豬血漿中4種藥物的濃度分別為28.3 μg/L、236 μg/L、42 μg/L、12.0 μg/L。說明本試驗建立的檢測方法,能夠用于豬血漿中這4種藥物的同時檢測。
4 結論
本文建立了豬血漿中芬苯達唑、奧芬達唑、芬苯達唑砜和伊維菌素的UPLC-MS/MS同時檢測方法。該方法測得的血漿中4種藥物的定量限分別為0.1 μg/L、0.1 μg/L、0.1 μg/L和0.2 μg/L,靈敏度高;4種藥物的回收率都能在80%以上,回收率高,標準曲線的相關系數r都在0.999 2以上,滿足試驗要求。在2只試驗豬的血漿中檢測到了4種藥物,說明該方法可為4種藥物在豬血漿中的藥物代謝動力學研究提供檢測方法。

