氣相色譜-串聯質譜法考察茶湯中49種農藥的遷移規律
, , ,
(貴陽市疾病預防控制中心,貴陽 550003)
茶是一種世界范圍內廣受歡迎的飲品,深受人們的喜愛。茶中的茶多酚、茶氨酸、茶多糖不僅有抗氧化的作用,還可以幫助喝茶人控制體重、愉悅精神等[1]。茶樹在生長過程中需要噴灑農藥,既可以預防病蟲害,又可以提高產量。但是制茶過程中茶葉上的農藥和重金屬等有害物質會從新鮮茶樹葉中殘留在制好的茶葉上,隨著沖泡過程遷移到茶湯中,并被人體攝入[2]。目前,盡管各國均制定了茶葉中的農藥殘留最大限量(MRL),但是以茶湯農殘水平為依據制定茶葉MRL標準已經成為國際共識。
近年來,國內外研究茶湯中農藥殘留檢測方法的文章較為常見[1,3-5],然而國外的研究方向已經從檢測方法向茶葉到茶湯遷移情況深入。文獻[1]研究了綠茶中多農藥的轉化率,以及以水為溶劑加壓萃取時的提取效果。文獻[5]研究了檢測煮制茶湯中172種農藥的檢測方法,通過研究44份茶葉樣品發現農藥的物理性質會影響農藥在茶湯中的遷移情況。文獻[6]研究了8種農藥從綠茶到茶湯中的遷移率,并得出溶解度會影響農藥遷移率的結論。文獻[7]研究了花茶中擬除蟲菊酯類農藥的遷移情況以及影響遷移情況的因素。
由于農藥在泡茶過程中的遷移情況主要取決于農藥在水中溶解度和農藥的正辛醇-水分配系數(Log Kow)[8],本工作通過研究茶葉中的農藥在不同泡茶頻率時的遷移情況,考察多種農藥從茶葉到茶湯的遷移率同各農藥的物理性質(分配系數、溶解度)之間的關系。通過考察茶葉中農藥到茶湯的遷移率,可以為制定茶葉中MRL提供參考依據,同時推薦茶葉種植過程中使用遷移率低的農藥,對制定茶湯農殘限量提供參考依據,并對茶湯農殘健康風險評估及減少人體攝入具有重要意義。
1 試驗部分
1.1 儀器與試劑
7890B/7000D型氣相色譜-三重四極桿-質譜聯用儀;3-30KS型離心機;XW-80A型旋渦混合儀。
二氯甲烷、農藥標準品純度為99.2%以上;氯化鈉、無水硫酸納為分析純;乙腈、丙酮為色譜純;試驗用水為超純水。
1.2 儀器工作條件
1)色譜條件 HP-5MS色譜柱(30 m×250μm,0.25μm);進樣口溫度280 ℃;載氣為高純氦氣(純度為99.99%);流量為1 mL·min-1;脈沖不分流,脈沖壓力475.8 k Pa;進樣量為1μL;柱升溫程序:起始溫度為40 ℃,保持1 min;以40 ℃·min-1速率升溫至120 ℃;再以5 ℃·min-1速率升溫至240 ℃;以6 ℃·min-1速率升溫至300 ℃,保持6 min。
2)質譜條件 電子轟擊(EI)離子源;電子能量為70 e V;離子源溫度為230 ℃,輔助加熱器溫度為300 ℃;溶劑延遲時間為5 min。
1.3 試驗方法
1.3.1 陽性樣品制備
稱取空白茶葉樣品2.00 g,分別添加49種農藥標準品,添加濃度為高濃度80μg·kg-1和低濃度40μg·kg-1,每個濃度制備6個平行樣品,劇烈振蕩混勻后于-20 ℃下冰箱冷凍24 h(冷凍條件保存并及時檢測,既保證農藥的穩定性[9-10],又有利于農藥充分接觸茶葉),用于考察泡茶過程中茶葉上的農藥向茶湯中遷移的情況。
1.3.2 茶湯制備及前處理
根據國家標準GB/T 23776-2018茶葉感官評審方法中提供的泡茶方法制備茶湯。稱取2.00 g茶葉于200 mL燒杯中,加入100 mL沸水,靜置4 min泡茶并制取茶湯。將茶湯轉移至燒杯中,冷卻至室溫,簡稱第一湯。將煮沸的水(100 mL)重新注入上述茶葉殘渣中,然后收集第二次泡茶所得茶湯,簡稱第二湯。第一湯和第二湯分別用于檢測農藥的浸出情況。
將所得第一湯和第二湯分別全部轉移至含有氯化鈉10 g的分液漏斗中,使用100 mL二氯甲烷分3次萃取,萃取液過無水硫酸鈉收集于150 mL梨形瓶中,于42 ℃溫度下減壓濃縮至近干,用丙酮定容至5 mL,過0.22μm濾膜,采用氣相色譜-串聯質譜法(GC-MS/MS)檢測,分別計算得到農藥于第一湯和第二湯的遷移率。
1.3.3 基質加標系列標準曲線的制作
稱取一定量的各種農藥,使用乙腈分別溶解配制成質量濃度為200 mg·L-1的農藥單標儲備溶液,于-20 ℃冰箱中避光保存;分別移取農藥單標儲備溶液1.00 mL于同一個100 mL容量瓶中,用乙腈定容,配制成2 mg·L-1標準溶液。
按照1.3.2節處理空白茶葉樣品,濾液用氮吹至近干后,分別用5 mL質量濃度為31.25,62.5,125,250,500,1 000,2 000μg·L-1的標準溶液定容,得到質量濃度為31.25~2 000μg·L-1基質加標標準系列,以樣品質量濃度對質譜響應繪制標準曲線。
1.3.4 茶葉中農藥遷移率計算方法
茶葉中農藥遷移率計算方法見公式(1)[1-2]:

式中:R為茶葉中農殘向茶湯的遷移率,%;ρ為茶湯中農藥質量濃度,μg·L-1;V為茶湯體積,L;m為茶葉中農藥的含量,μg。
1.3.5 統計學分析
采用SPSS 22.0軟件對數據進行統計學分析,采用Pearson直線相關回歸分析方法,以P<0.05有統計學意義。
2 結果與討論
2.1 標準曲線和檢出限
通過方法線性,準確度、靈敏度和最低檢測濃度對方法學進行驗證:49種農藥在不同質量濃度范圍內與其對應的質譜響應值呈線性關系,其線性參數見表1。
以3倍信噪比計算檢出限(3S/N),以10倍信噪比計算測定下限(10S/N),結果見表1。

表1 線性參數、檢出限和測定下限Tab.1 Linear parameters,detection limits and lower lomits of determination

表1(續)
2.2 精密度和回收試驗
向100 mL茶湯中分別加入0.2,4.0μg標準物質,每個濃度制備6個平行樣品,按照試驗方法進行檢測,并進行方法驗證,結果見表2。
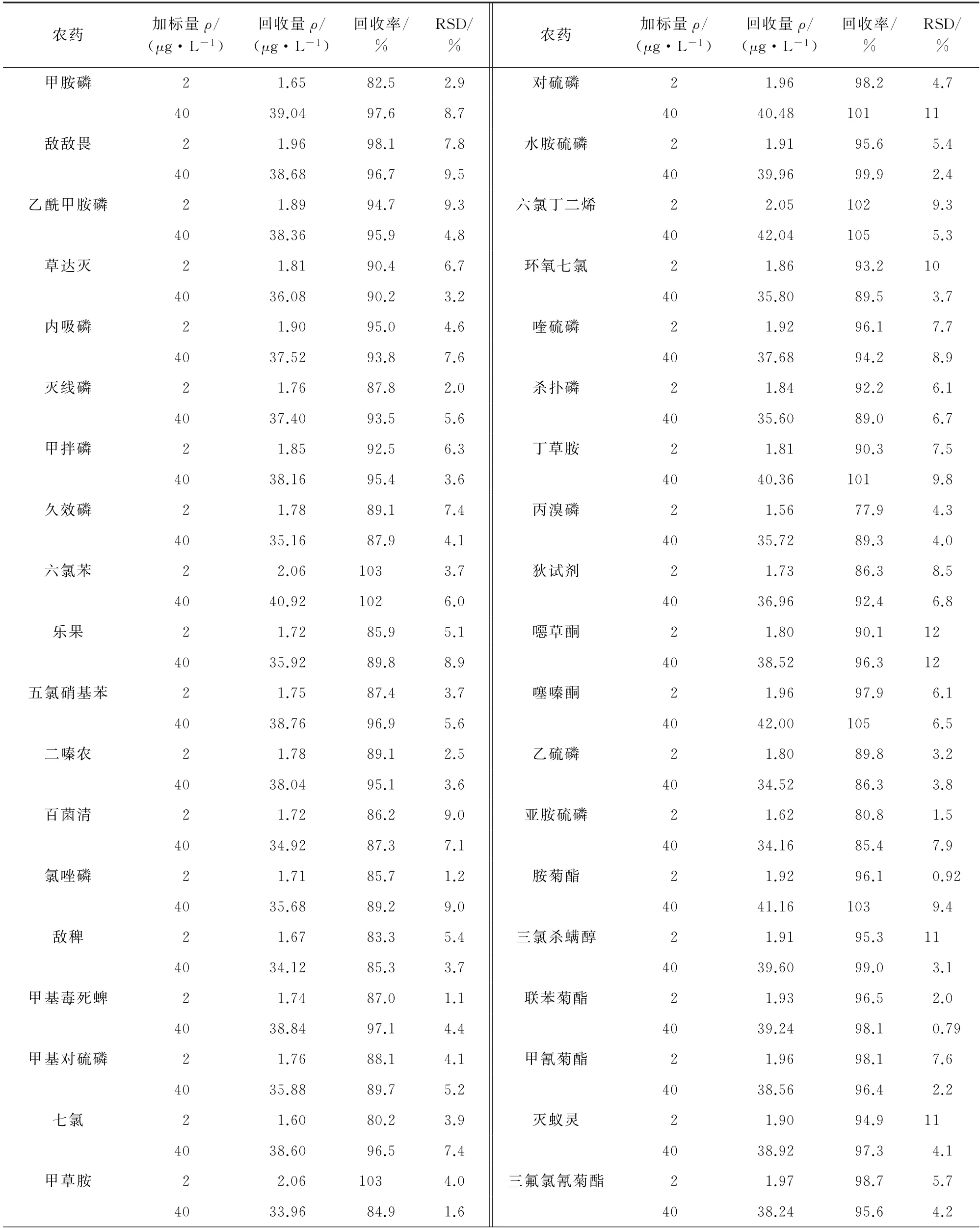
表2 精密度和回收試驗結果Tab.2 Results of tests for precision and recovery
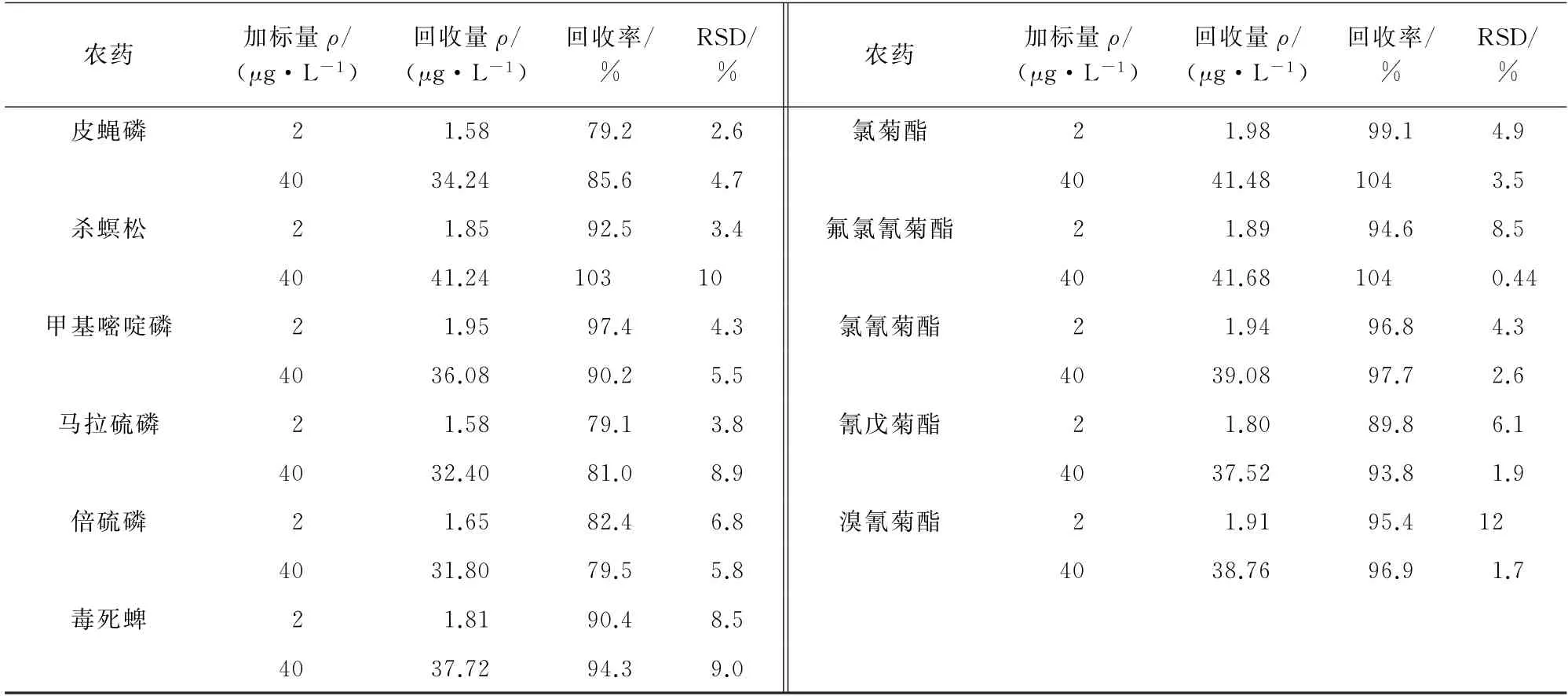
表2(續)
2.3 茶葉中農藥向茶湯中的遷移率
按照試驗方法制作12個陽性樣品,分別為高濃度80μg·kg-1和低濃度40μg·kg-1,按照試驗方法制備并檢測茶湯,分為第一湯和第二湯,根據1.3.4節計算農藥的遷移率,并計算兩次浸泡農藥遷移率之和,其中六氯苯、七氯、胺菊酯、聯苯菊酯、甲氰菊酯、滅蟻靈、三氟氯氰菊酯、氯菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯等12種農藥的遷移率均為零,其余37種農藥的遷移情況見表3。

表3 泡茶過程中37種農藥從茶葉向茶湯的遷移率(n=12)Tab.3 Migration rate of 37 pesticides from tea leaves to tea soup(n=12)
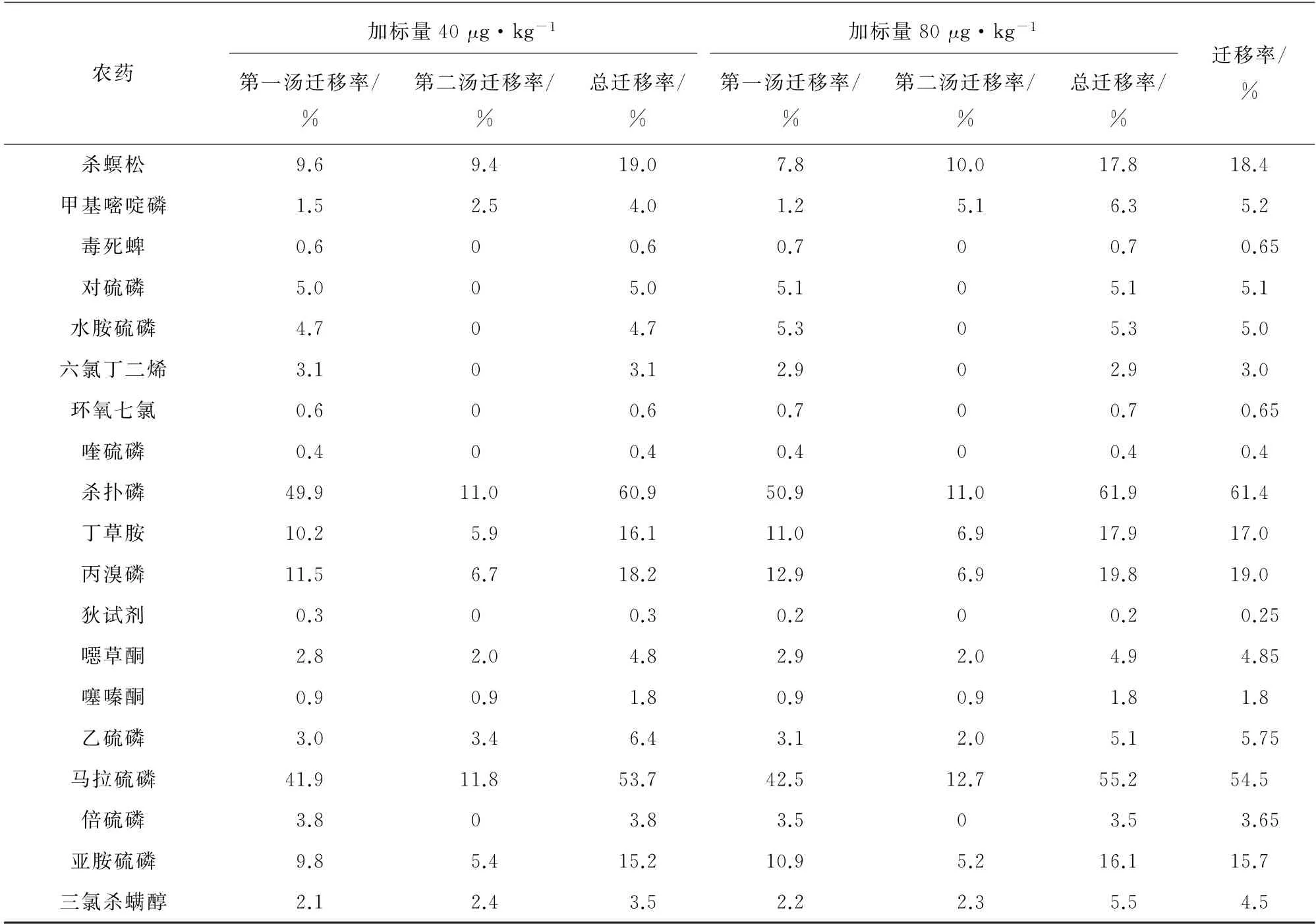
表3(續)
由表3可知:37種農藥中有16種農藥的遷移率超過20.0%,除甲草胺和草達滅外均為有機磷農藥;遷移率高于20%的農藥,第一湯遷移率與第二湯遷移率之比為3∶1~6∶1,遷移率介于10%~20%的農藥,第一湯遷移率與第二湯遷移率之比為1∶1~2∶1,遷移率小于10%的農藥,第一湯遷移率與第二湯遷移率幾乎相等;根據該研究結果建議棄掉頭次泡茶的茶湯,減少茶湯引起的農藥暴露。
2.4 遷移率和農藥理化性質之間的關系
2.4.1 遷移率與溶解度之間的關系
農藥的水溶性是影響農藥遷移率的主要原因之一,因為在泡茶過程中水是農藥的載體,49種農藥的溶解度[11]和遷移率之間的關系見表4。

表4 農藥的溶解度與遷移率Tab.4 Values of solubility and migration rate of pesticides

表4(續)
對農藥的遷移率與溶解度進行Pearson直線相關回歸分析,Pearson相關系數為0.743,P<0.01,差異有統計學意義,表明遷移率與溶解度呈正相關關系;溶解度低于20 mg·kg-1的農藥的遷移率低于10%,隨著農藥的溶解度從24.4 mg·kg-1(亞胺硫磷)增大到1.0×106mg·kg-1(久效磷),農藥的遷移率從15.7%(亞胺硫磷)提高到97.4%(久效磷)。而具有較高溶解度的農藥如內吸磷、皮蠅磷、殺螟松的溶解度分別為666,40,38 mg·kg-1,并沒有表現出更高的總遷移率,推測農藥的遷移率不僅受農藥溶解度影響,還受分配系數等因素影響。
2.4.2 遷移率與分配系數之間的關系
農藥在辛醇-水溶液中的分配系數[11]與農藥遷移率的關系見表5。
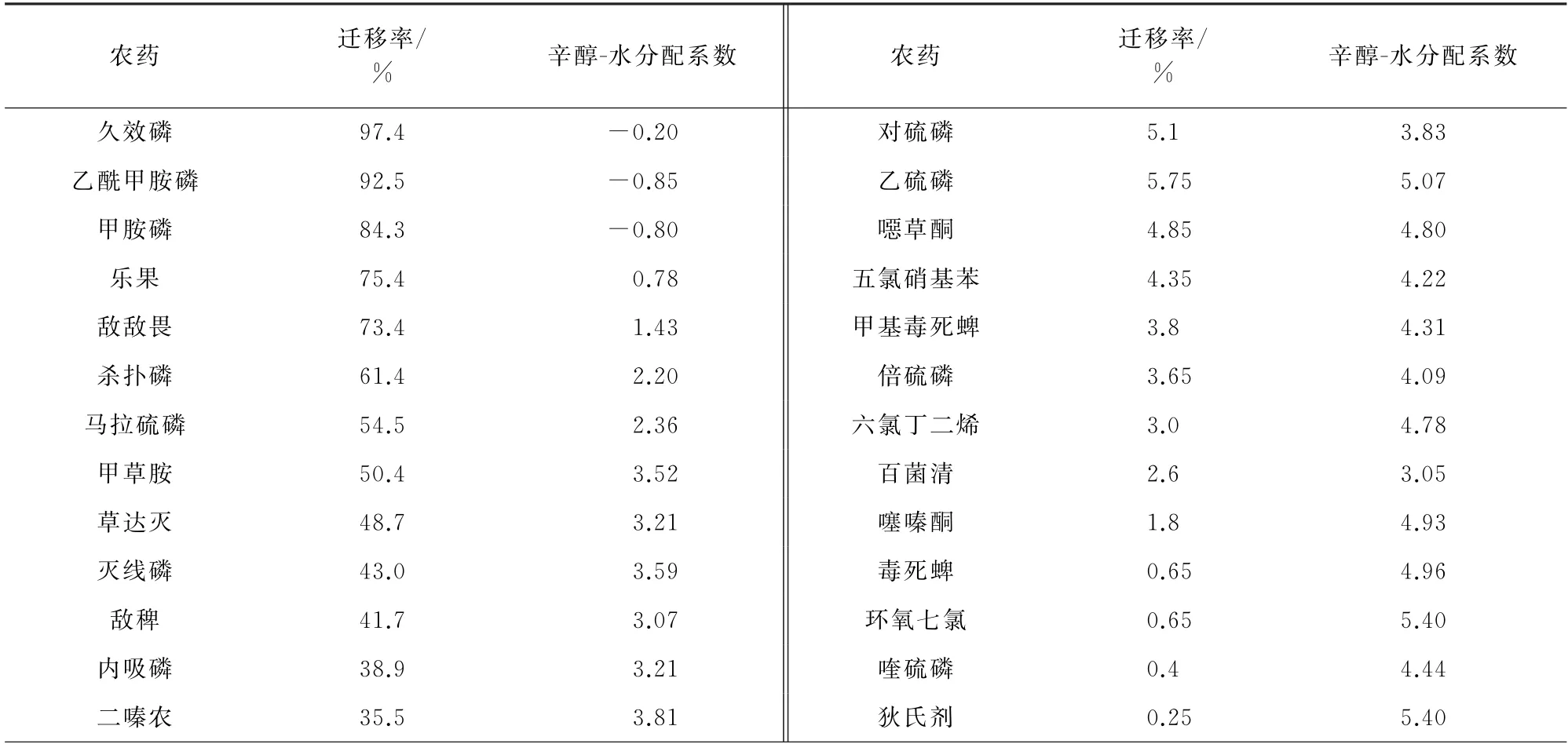
表5 農藥的分配系數與遷移率Tab.5 Values of distribution coefficient and migration rate of pesticides
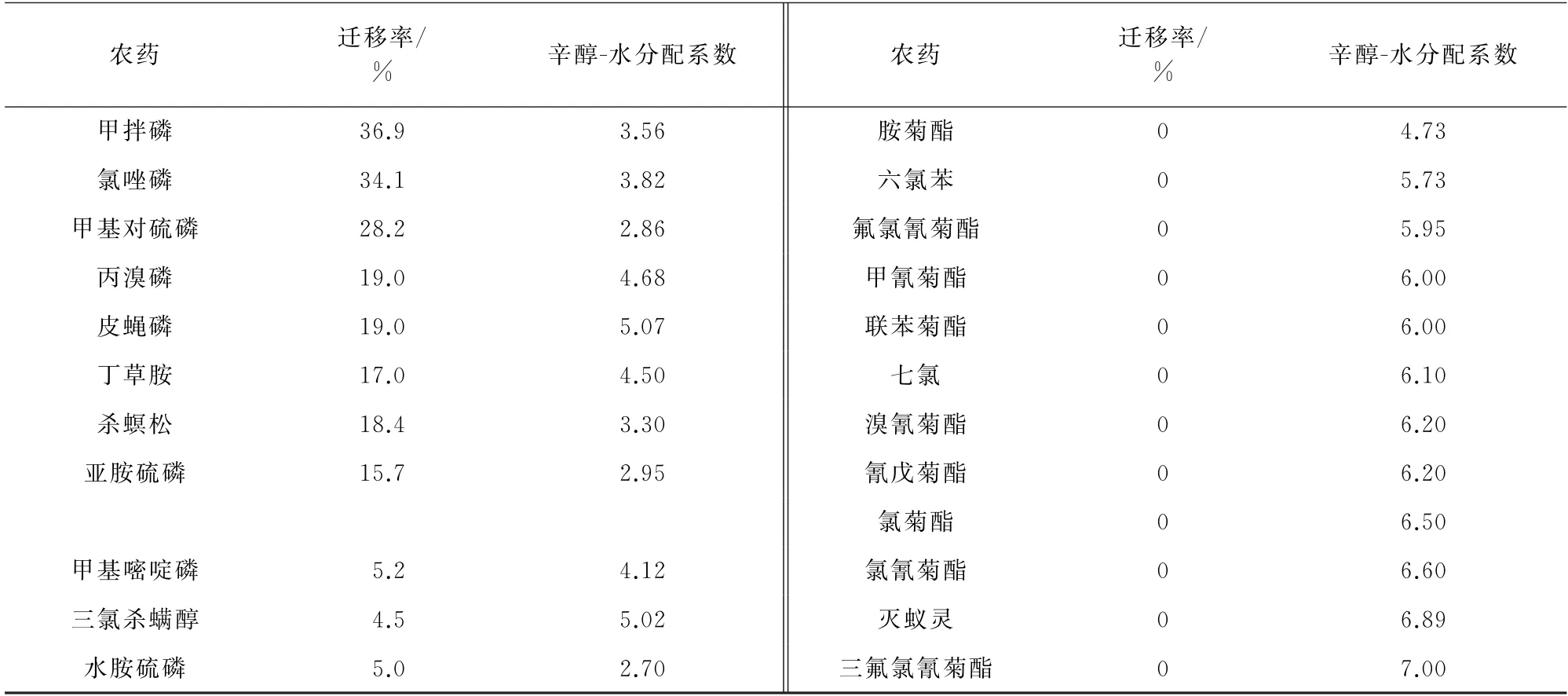
表5(續)
對農藥的遷移率與農藥在辛醇-水中的分配系數進行Pearson直線相關回歸分析,Pearson相關系數為-0.984,P<0.01,差異有統計學意義,表明遷移率與農藥在辛醇-水中的分配系數呈負相關關系;分配系數低于3.82的農藥的遷移率高于30%,隨著農藥的分配系數從-0.85(乙酰甲胺磷)增大到3.82(氯唑磷),農藥的遷移率從92.5%(乙酰甲胺磷)降低到34.1%(氯唑磷)。而農藥水胺硫磷、百菌清的分配系數分別為2.7,3.05并沒有表現出很高的遷移率,說明農藥的遷移率不僅受農藥分配系數影響,還受其他因素如溶解度等的制約。
茶葉浸泡第一湯中農藥的遷移率較高;茶湯中農藥的總遷移率與溶解度呈正相關,與農藥在辛醇-水中的分配系數呈負相關。農藥的溶解度低于20 mg·kg-1時,農藥的遷移率小于10%,農藥的溶解度高于24.4 mg·kg-1時,農藥的遷移率大于15.7%;農藥的分配系數低于3.82時,農藥的遷移率大于34.1%,農藥的分配系數高于3.83時,農藥的遷移率小于5.1%。
飲茶時建議棄掉頭次泡茶的茶湯,減少茶湯引起的農藥暴露;推薦使用水中溶解度低并且分配系數較高的農藥,此時由茶葉浸泡到茶湯中的農藥遷移率較低。本工作的研究同時可以為參照茶湯中農藥的殘留情況制定茶葉中農藥的最大殘留限量提供參考依據。

