偽狂犬活疫苗C株抗體消長規律及攻毒保護試驗
馬晶晶,高俊鋒,吳碧清,韓相敏,張 江,賴 志
(1. 上海創宏生物科技有限公司,上海 松江 201619;2. 上海農林職業技術學院,上海 松江 201699)
豬偽狂犬病(Pseudorahies,PR)是由皰疹病毒科,α-皰疹病毒亞科的豬偽狂犬病病毒(Pseudorabies vires,PRV)引起的多種家畜和野生動物的以發熱、奇癢及腦脊髓炎為主要癥狀的一種急性傳染病。豬是本病的原發感染宿主,又是病毒的長期儲存和排毒者[1-2]。母豬主要造成繁殖障礙,仔豬主要表現為神經癥狀、呼吸困難、拉稀等臨床癥狀。2011年后,我國多地區出現豬偽狂犬變異株并流行,引發豬只死亡,經濟損失嚴重。
疫苗接種是防治豬偽狂犬病的重要手段之一。目前豬偽狂犬病常規疫苗在接種后雖然能預防臨床癥狀的出現,但不能防止強毒在被感染動物體內復制、排出。有報道表明,新型自然弱毒株疫苗的應用可控制豬偽狂犬病的潛伏感染[3-5]。
偽狂犬活疫苗C株疫苗毒株,自然缺失基因片段gI、gE、Us9、Us2,本試驗擬通過中和抗體和攻毒保護試驗對偽狂犬活疫苗C株的免疫原性進行研究,并通過與常規疫苗Bartha株進行比較,評估其作為疫苗的應用,并為其在生產上推廣應用提供理論依據,以加速偽狂犬病基因缺失疫苗在我國用于防治和根除偽狂犬病的進程[6-8]。
1 材料與方法
1.1 強毒株 偽狂犬病病毒HB-11株,新流行野毒株,由上海創宏生物科技有限公司提供。
1.2 試驗用疫苗 豬偽狂犬活疫苗C株,購自武漢中博生物股份有限公司。
1.3 偽狂犬Bartha株疫苗 購自西班牙海博萊生物大藥廠。
1.4 細胞系 非洲綠猴腎傳代細胞,由上海創宏生物科技有限公司提供。
1.5 參照抗原和陽性血清 試驗用抗原為偽狂犬病病毒細胞培養物,中和抗體效價為1∶256;陽性血清為豬偽狂犬病病毒感染血清,中和抗體效價為1∶256。參照抗原和陽性血清均由上海創宏生物科技有限公司制備和保存。
1.6 試驗動物 斷奶仔豬,40頭,4周齡。所有動物在試驗前均經乳膠凝集試驗檢測為偽狂犬病病毒血清學陰性。試驗在嚴格隔離條件下進行。由上海交通大學七寶校區試驗豬場提供。
1.7 方法
1.7.1 抗體消長曲線的測定 將偽狂犬抗體陰性的健康斷奶仔豬20頭,隨機分成A、B兩組,每組10頭。A組:免疫組,頸部肌肉注射豬偽狂犬活疫苗C株1 mL,接種劑量為106.5TCID50;B組:對照組,頸部肌肉注射DMEM培養基1 mL。分別在接種前1天(記為D1)、接種后第3天(記為D3)、第7天(記為D7)、第14天(記為D14)、第21天(記為D21)、第28天(記為D28)、第42天(記為D42)、第60天(記為D60)、第90天(記為D90)、第180天(記為D180)對每頭豬進行采血,分離血清。然后使用固定病毒稀釋血清方法測定中和抗體效價。
1.7.2 攻毒保護試驗 將偽狂犬抗體陰性的健康斷奶仔豬20頭,隨機分成C、D、E、F四組,每組5頭。C組:C株免疫組,頸部肌肉注射豬偽狂犬活疫苗C株1 mL,接種劑量為106.5TCID50;D組:Bartha株免疫組,頸部肌肉注射偽狂犬病毒Bartha株活疫苗1 mL, 接種劑量為106.5TCID50;E組:攻毒對照組,頸部肌肉注射DMEM培養基1 mL;F組:空白對照組。在接種后第21天,C、D、E組每頭豬頸部肌肉注射偽狂犬病毒HB-11株病毒液1 mL,病毒含量為106.5TCID50。攻毒后,在第1、3、5、7、14天測量試驗豬體溫,每天1次,詳細記錄體溫變化;此外,每天觀察各組豬群是否出現體溫升高、食欲廢絕、呼吸困難、神經癥狀、拉稀和嘔吐等臨床癥狀,統計臨床癥狀數據,觀察至攻毒后第21天;每組隨機選取2只剖檢,觀察腦部、肺部、扁桃體、肝臟、脾臟、腎臟等病理變化[9]。分別在D1、D3、D7、D14、D21、D28、D42、D60、D90、D180對存活豬進行采血,分離血清,使用實時熒光定量PCR方法對病毒含量進行檢測。
1.7.3 數據處理 數據用Excel軟件進行處理后,采用SPSS 22統計分析軟件對數據進行One-Way ANOVA分析及LSD法多重比較。
2 結果
2.1 抗體消長規律試驗 免疫接種偽狂犬活疫苗C株后,持續檢測6個月的抗體水平,結果表明,偽狂犬活疫苗C株免疫后在D7可以檢測到中和抗體,并且抗體水平不斷上升,D42達到抗體水平高峰,D180抗體水平仍高于20,對照組(B組)抗體檢測結果一直為陰性,結果見圖1。
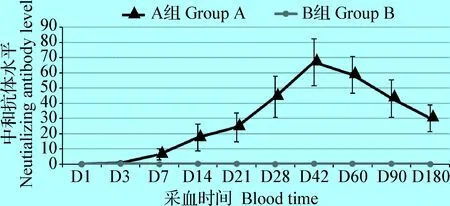
圖1 C株病毒免疫豬群后免疫組與對照組中和抗體消長規律圖Fig.1 The growth and loss of neutralizing antibody with strain C between the immunized group and the control group
2.2 攻毒試驗
2.2.1 攻毒后體溫測定 攻毒對照組(E組)在D3和D5的體溫超過40.5 ℃,Bartha株免疫組(D組)在D3的體溫超過40.5 ℃,C株免疫組(C組)體溫數據均低于40 ℃。方差分析結果顯示,各測溫時間點C組與E組均存在顯著差異(P<0.05),結果見表1。

表1 攻毒后體溫Table 1 Temperature after challenge
2.2.2 攻毒后臨床癥狀的觀察 D組和E組出現發熱、厭食和呼吸困難等癥狀;E組發病率100%(5/5),表現為發燒、精神沉郁、呼吸困難,嚴重的仔豬出現神經癥狀,其中2頭豬分別在第3天和第4天死亡。C組80%(4/5)以上仔豬表現為精神、呼吸、采食均正常,保護率不低于80%;F組仔豬均表現正常。
3.2.3 剖檢病變 C組和F組剖檢無明顯病變;D組剖檢有病變;E組剖檢病變明顯:腦膜充血出血,扁桃體出血,肺臟出現白色壞死灶,肝臟、脾臟顆粒狀出血點明顯。見中插彩版圖2。
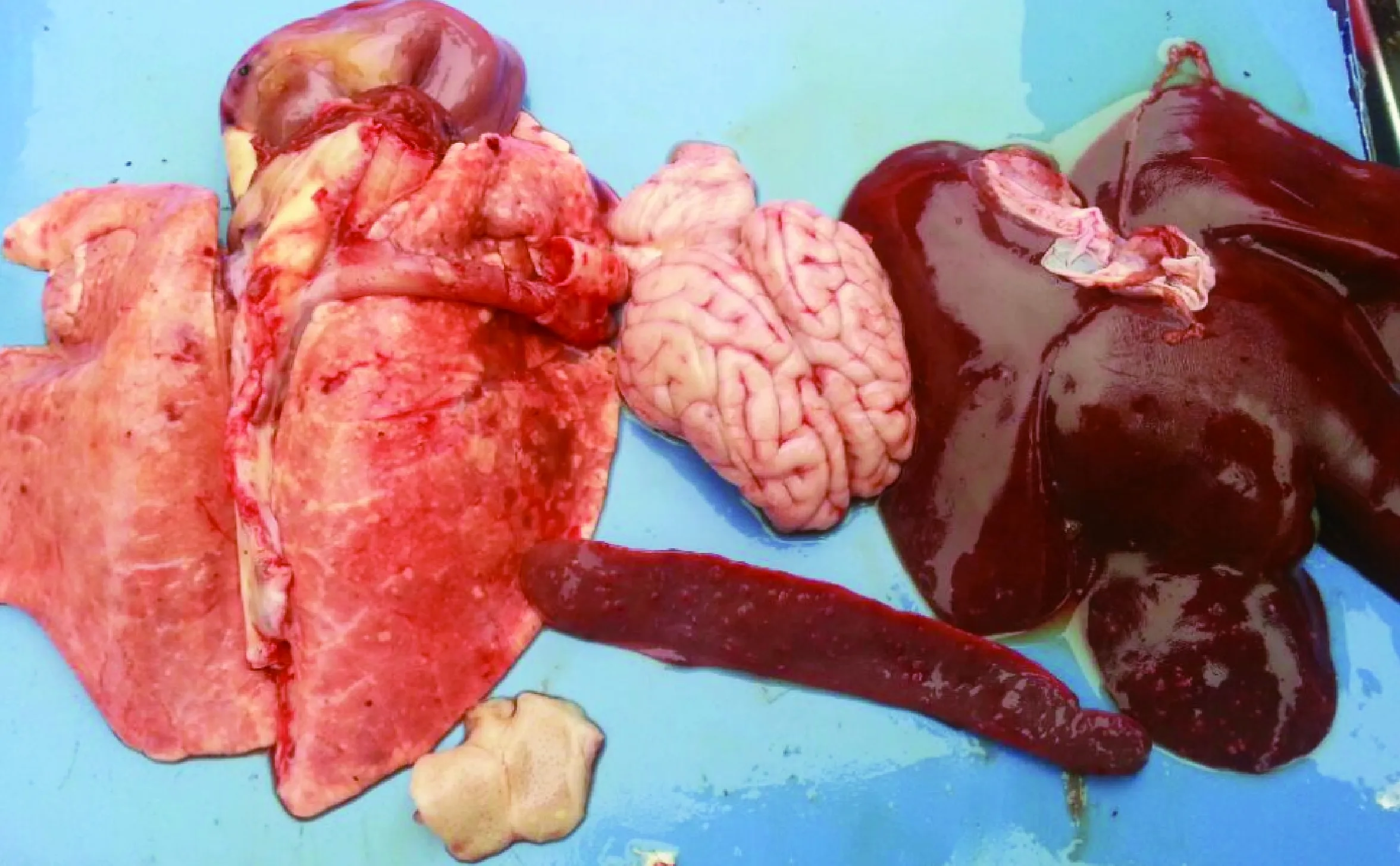
圖2 攻毒對照組剖檢病變Fig.2 Lesions in the challenge control group
3.2.4 病毒血癥 C組較D組病毒血癥持續時間短,病毒載量低,F組未檢出病毒。見表2。
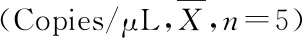
表2 病毒載量檢測結果Table 2 Viral load detection results
4 討論
豬偽狂犬病對養豬業的危害巨大,引起的經濟損失也難以估量,這也是目前很多國家將其作為凈化對象的重要原因。在我國,一直以來均依賴疫苗免疫進行防控。所以對于豬偽狂犬病病毒和相關疫苗的分析研究至關重要[10-12]。
固定病毒稀釋血清方法是檢測豬偽狂犬病病毒抗體的可靠方法,目前許多國家將其列為法定的檢測方法。豬偽狂犬病病毒屬于皰疹病毒科,中和抗體效價不高,在其判定上,有不少學者以血清1∶2的稀釋度是否出現細胞病變作為標準,同時也有許多學者認為,動物體的中和抗體效價小于1∶2時,也不能說明動物就一定是陰性,沒有感染豬偽狂犬病病毒。此外,豬偽狂犬病的免疫機理也很復雜,既有體液免疫,又有細胞免疫的參與。有的學者通過試驗得出:某些動物經注射疫苗后,中和抗體水平沒有轉陽,但通過攻毒試驗發現同樣具有保護性。該病毒的這些特性,給豬偽狂犬病的臨床診斷和疫苗效果的判斷標準帶來了復雜性。目前,一般將疫苗效果的界限定為:中和效價≥1∶2或中和抗體指數≥102.5時為血清抗體陽性[13]。
本試驗對試驗豬的抗體水平進行了檢測,偽狂犬活疫苗C株免疫組在第7天就產生了中和抗體,并持續升高,在42 d達到高峰,在180 d中和抗體水平仍高于保護值,表明偽狂犬活疫苗C株免疫保護期可持續6個月。
攻毒保護試驗中,攻毒對照組發病率100%,表現為發燒、精神沉郁、呼吸困難,嚴重的仔豬出現神經癥狀和死亡;空白對照組仔豬均表現正常;C株免疫組80%以上仔豬表現為精神、呼吸、采食均正常,保護率不低于80%。在對免疫接種豬剖檢時發現,接種豬偽狂犬活疫苗C株試驗組的內臟無明顯病理變化,而Bartha株試驗組和攻毒對照組的內臟都出現不同程度的出血和病變,且病毒血癥偽狂犬活疫苗C株較Bartha株持續時間短,病毒含量低。

