血清胱抑素C預測老年缺血性腦卒中后認知功能障礙臨床分析
趙 平 孔令勝 洪 波 季曉宇 任孝林 韓學聃 徐 玲 劉麗艷
徐州醫科大學附屬連云港市東方醫院,江蘇 連云港 222042
缺血性腦卒中不但可引起軀體功能障礙,而且可引起認知功能障礙[1]。卒中后認知功能障礙(post-stroke cognitive impairment,PSCI)是指在卒中發生后6個月內出現的達到認知功能障礙診斷標準的一種綜合征[2]。在中國腦卒中后3個月內認知功能障礙發生率在55.9 %以上[3],臨床表現可從最初的輕度認知功能障礙發展到后期的嚴重癡呆,嚴重降低患者生活質量,并影響神經功能康復及預后,因此對其進行早期診斷及干預具有重要的臨床意義。能否通過檢測血清生物標志物提前預測,做到早識別早干預,成為臨床醫師關注的熱點。血清胱抑素C(Cystation C,CysC)作為主要的內源性半胱氨酸蛋白酶抑制劑,不僅參與了動脈粥樣硬化的炎癥反應,成為動脈硬化發生、發展及心腦血管疾病的危險因素,而且還參與了中樞神經系統的神經元變性與修復[4-6]。目前對CysC與認知功能損害的關系尚無定論,本文旨在探討CysC與老年缺血性PSCI的相關性,為盡早預測老年缺血性PSCI提供參考依據。
1 對象與方法
1.1研究對象收集2017-06—2019-06連云港市東方醫院神經內科病房PSCI患者90例。入選標準:(1)年齡>65歲;(2)首次發病,發病7 d以內,經頭顱CT或MRI證實有明確的缺血性梗死灶,并有與梗死灶相對應的神經缺失癥狀及體征,符合缺血性腦卒中TOAST病因分型中動脈粥樣硬化型[7];(4)額葉前部、顳葉前部、海馬區、Wernicke區、Broca區等重要認知功能區2個以上的病灶橫徑≥5 mm,或單個病灶最大橫徑≥15 mm,或5個以的病灶上橫徑≥5 mm;(5)單肢癱瘓,肌力≤3級,或兩個以上肢體癱瘓,肌力<4級;(6)Hachinski缺血指數量表(Hachinski ischemia scale,HIS)評分≥5分,滿分18分,HIS≤4分排除阿爾茨海默病(Alzheimer’s disease,AD)[8];(7)美國國立衛生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)評分4~20分;(8)校正后蒙特利爾認知評估量表(Montreal cognitive assessment,MoCA)總分≥19分排除癡呆;(9)患者及家屬簽署知情同意書。根據治療14 d后蒙特利爾認知評估量表(MoCA)從中選取MoCA總分<26分的患者90例為PSCI組,另選取同期與PSCI組年齡、性別、教育程度相匹配的認知功能正常(MoCA總分≥26分)患者90例為非PSCI組。排除標準:(1)既往有卒中史、認知功能障礙(如路易體癡呆癥等),或有焦慮、抑郁及精神異常;(2)存在意識障礙,嚴重視力、聽力、言語障礙,不能配合完成量表測試者;(3)合并顱腦外傷、惡性腫瘤、甲狀腺疾病、嚴重感染、肝腎功能不全、帕金森病、長期營養不良、重度貧血、葉酸及B12水平低下;(4)存在酒精依賴、毒品接觸導致中樞神經系統變性或脫髓鞘疾病,藥物依賴性疾病(如部分化療藥物、抗癲癇藥物、鎮靜安眠類藥物等)導致的認知功能受損。本研究經連云港市東方醫院倫理委員會審核批準。
1.2方法及評價標準
1.2.1 樣本含量的確定:根據既往研究報道,缺血性腦卒中患者中CysC水平升高約50%,預期CysC水平升高人群中發生認知功能障礙的比值RR=3.0,病例與第一匹配的對照之間的危險因素相關程度Phi=0.5,設α=0.05(雙側),β=0.10,把握度(1-β)=0.90。利用PASS11軟件計算樣本量N1=N2=146例。假定研究對象的無應答率為10%,則需樣本量N1=N2=146÷0.9=162例。假定問卷合格率為90%,則需樣本量N1=N2=162÷0.9=180例。病例組與對照組各需要90例。
1.2.2 臨床資料:記錄所有患者的性別、年齡、BMI、受教育年限、高血壓史、糖尿病史、高脂血癥史、吸煙史、飲酒史、血脂等檢查結果。入院后所有患者在常規支持治療的基礎上,根據具體病情予血管內介入、溶栓、改善腦循環、促進腦代謝、拮抗腦水腫治療。
1.2.3 實驗室指標:于入院時分別檢測血尿常規、肝腎功能、血糖、血脂,記錄估算的腎小球濾過率(estimated glomerular filtration rate,eGFR),男性患者:eGFR=186×(血肌酐)―1.154×(年齡)―0.203×1.233;女性患者:eGFR=186×(血肌酐)―1.154×(年齡)―0.203×0.742×1.233。入院治療14 d后(禁食12 h后)清晨空腹采取肘靜脈血5 mL,2 664×g離心10 min,分離血清,置于-80 ℃冰箱冷凍待檢。采用膠乳增強免疫比濁法檢測CysC水平。試劑盒由北京利德曼生化股份有限公司提供,批號:京藥監械(準)字2011第2400494號,標本收集完成后由同一檢驗師統一檢驗,嚴格按照試劑盒說明書進行操作。檢測儀器Olympus AU5400型全自動生化分析儀(日本奧林巴斯產業株式會社生產)。
1.2.4 功能量表測評:2組患者于入院治療14 d后(病情趨于穩定)由經過統一的量表培訓的醫師評定。(1)NIHSS評分[9]:用來評定缺血性腦卒中神經功能損傷程度,包括意識、構音障礙、失語、面癱、凝視、視野、肢體運動、感覺、忽視癥、肢體共濟、遠端肢體功能等。每項從神經功能正常的0分至神經功能缺損最重的4分,滿分42分;通常0~5分為輕度卒中,6~20分為中度卒中,21分以上為重度卒中。(2)簡易智能狀態檢查量表(mini-mental state examination,MMSE)評分[10]:包括注意力和計算力、定向力、記憶力、閱讀及言語理解、視空間能力、書寫能力,滿分30分;評分與受教育年限相關,故按受教育年限分層:文盲(受教育年限<1 a)≥20 分,小學(受教育年限 1~6 a)≥23 分,中學及以上(受教育年限≥7 a)≥27 分。(3)MoCA評分[11]:包括語言(3分)、命名(3分)、視空間與執行(5分)、注意與集中(6分)、定向(6分)、延遲回憶(5分)、抽象思維(2分)等,滿分共30分。對受教育年限偏倚進行校正,如受教育年限≤12 a則在測試結果上加 1分。總分<26分則認為存在認知功能障礙。為排除癡呆,校正后MoCA 總分≥12分為納入標準。

2 結果
2.1PSCI組與非PSCI組基本資料比較先將基本資料進行單因素分析,2組患者的性別、年齡、BMI、受教育年限、高脂血癥、吸煙、飲酒、血脂、腎功能指標比較差異均無統計學意義(P>0.05);2組患者的糖尿病患病率、高血壓患病率、收縮壓、舒張壓、HbA1C、NIHSS、CysC、MMSE評分及MoCA評分比較,差異有統計學意義(P<0.001)。見表1。
2.2血清CysC與老年PSCI嚴重程度的相關性經Pearson相關分析,血清CysC水平與收縮壓(r=0.233,P=0.002)呈正相關,隨著收縮壓程度加重,血清CysC水平逐漸升高;血清CysC水平與MMSE評分(r=-0.456,P<0.001)及MoCA評分(r= -0.403,P<0.001)均呈負相關。見表2。
2.3老年PSCI患病風險的獨立危險因素分析以單因素分析中有顯著差異的因素為自變量,首先對擬引入的自變量進行多重共線性的初步診斷,發現血清CysC和糖尿病、高血壓發病率與HbA1C、血壓數值之間可能有共線性問題,故可把HbA1C、血壓排除出自變量。以老年缺血性腦卒中急性期是否發生認知障礙(依據入院治療14 d后的MoCA診斷)設置因變量(非認知障礙=O;認知障礙=1),以單因素分析中有顯著差異的變量(糖尿病、高血壓、CysC、NIHSS)為自變量納入Logistic回歸模型進行多因素分析,自變量賦值:糖尿病(無=0;有=1)、高血壓(無=0;有=1)、CysC為連續性變量(<0.88 mg/L=0;0.88~1.08 mg/L=1;>1.08 mg/L=2)。Logistic多因素回歸分析顯示,在校正糖尿病、NIHSS評分后高血壓和CysC仍是老年PSCI患病風險的獨立危險因素。見表3。
2.4血清CysC對認知功能障礙的預測價值繪制血清CysC預測老年缺血性腦卒中后認知功能障礙的ROC曲線,曲線下面積(AUC)0.773(95%CI0.705~0.832,P<0.0001),最佳診斷臨界值為0.91 mg/L(敏感度83.33%,特異度60.00%,Youden指數0.433),可見CysC對老年缺血性腦卒中后認知功能障礙有一定預測價值。見圖1。
3 討論
CysC參與并促進動脈粥樣硬化的發生、進展及炎癥反應[12-15],導致細胞外基質改變失衡,直接損害血管壁[16-18]。一旦發生急性缺血性腦卒中,腦脊液與血腦屏障通透性增加,CysC會大量析出進入血液循環,引起血清CysC水平升高[19-20]。本文顯示血清CysC與老年缺血性腦卒中后的MoCA評分呈負相關,與老年缺血性PSCI的嚴重程度呈正相關,說明高血清CysC水平的人群更易發生PSCI,高血清CysC為PSCI患病的危險因素,并對PSCI患病有一定預測價值,可幫助臨床醫師早期干預;同時發現在調整性別、年齡、受教育年限、糖尿病、高血脂、腎功能和吸煙飲酒等重要的動脈粥樣硬化的危險因素后,高血壓和高血清CysC與老年缺血性PSCI之間的相關性依然存在,表明高血壓和高血清CysC可能獨立于動脈粥樣硬化的其他危險因素影響之外。

表1 2組患者基本資料比較

表2 血清CysC影響因素的相關性分析
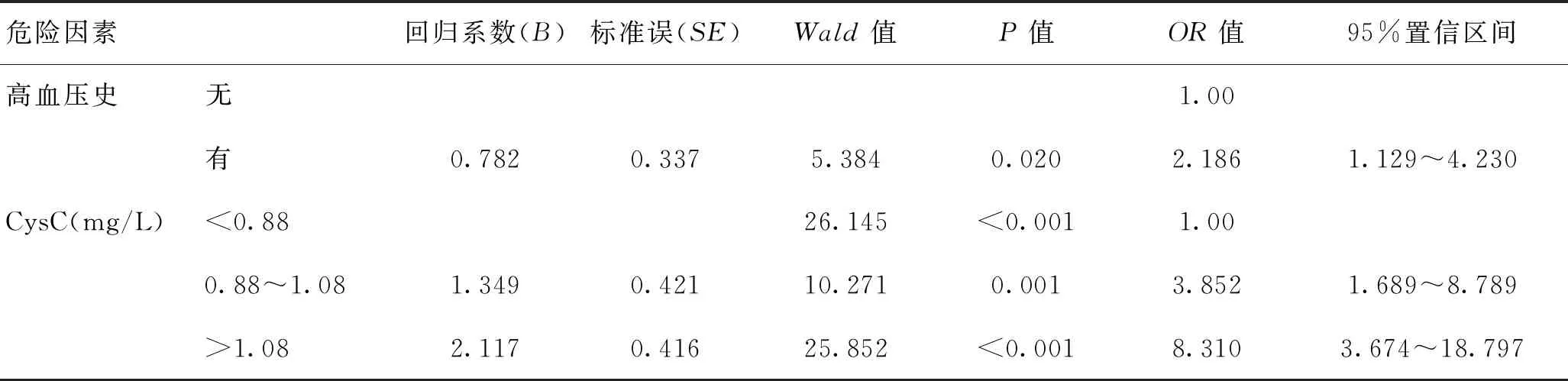
表3 認知功能障礙患病風險的Logistic回歸分析
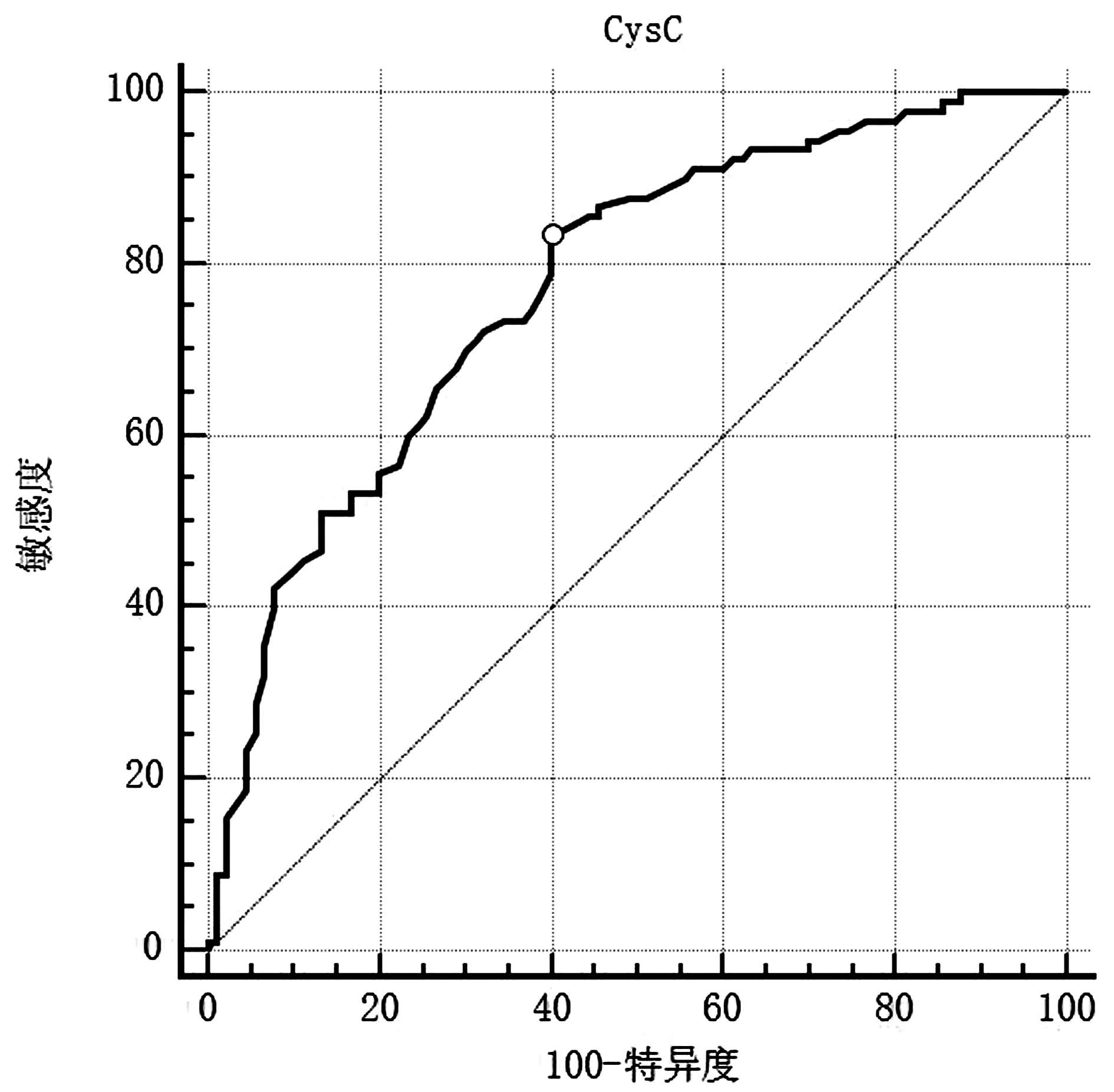
圖1 CysC預測老年缺血性腦卒中后認知功能障礙的ROC曲線Figure 1 ROC curve of CysC predicting cognitive dysfunction after ischemic stroke in the elderly
老年缺血性腦卒中后PSCI的發生與腦卒中所致腦組織損傷有關,腦血管局部急性缺血可直接導致神經元死亡,尤其是大腦一些關鍵皮質部位(如優勢側的左大腦半球、丘腦和角回、額葉深部區域、前額皮層、Papez環路和紋狀體環路等)的缺血壞死[21-25]。人體的語言功能及運用技巧神經中樞多位于大腦左半球,當左側大腦半球缺血損傷顳區、額區功能時,就會發生較重的PSCI,其中顳葉損傷能導致記憶障礙。額葉損傷可導致語言表述、精神活動及運動障礙[26-30]。大腦后動脈缺血梗死直接引起與記憶功能相關的海馬體神經元壞死,從而導致認知功能減退及永久性的記憶損害。有研究發現當動脈粥樣硬化進展及腦卒中腦組織損傷時,炎性介質大量釋放,刺激半胱氨蛋白酶的過度分泌,導致血管壁外基質損傷加重,相應的神經元及神經膠質細胞隨之表達出更多的CysC拮抗半胱氨酸蛋白酶的活性[31-32]。CysC參與動脈粥樣硬化的發生及進展,且血清CysC水平越高,動脈粥樣硬化程度越嚴重[16,33]。因此,血清CysC水平與腦卒中后腦組織損傷程度呈正相關,而腦卒中后腦組織損傷的程度與認知功能障礙的程度也呈正相關,由此不難理解血清CysC水平與認知功能障礙的程度具有相關性,可以作為評價PSCI嚴重程度的預測指標。
老年人腦萎縮是PSCI發生的另一個重要機制[17],在患亞臨床腦梗死和腦白質疏松疾病患者中血清CysC升高[18],有研究顯示血清CysC升高與老年人腦萎縮發生和進展有關,并有一定預測價值[19],認為CysC對老年人腦萎縮可能有促進作用,其機制可能是通過對內質網的作用影響老年人腦實質細胞的體積和數量[20]。免疫組織化學研究顯示阿爾茨海默病(AD)患者的腦組織淀粉樣沉積物中發現CysC,在空間上與β-淀粉樣蛋白(amyloid β-protein,Aβ)存在共存關系,且其CysC水平顯著高于認知功能正常人[21],Meta分析表明CysC是遲發型AD的危險因素。83%的AD患者尸檢可發現CysC與Aβ肽共同聚集于腦微動脈管壁形成淀粉樣沉積物。但有分子生物學研究認為CysC對認知功能可能有保護效應[22],一是CysC可以通過抑制組織蛋白酶而抑制淀粉樣蛋白的產生與聚積,二是可以通過與淀粉樣前體蛋白分子結合而抑制淀粉樣蛋白的聚積及在腦組織中的沉積。本文顯示血清CysC水平與老年缺血性PSCI的嚴重程度呈正相關,說明CysC對認知功能的保護效應有限,尚不足以阻止認知功能障礙的進展。
血清CysC水平與老年缺血性PSCI的的嚴重程度存在相關性,對于老年缺血性PSCI的早期發現識別具有臨床預測價值。本文仍存在一些局限性,首先,腦卒中后影響認知功能的因素繁多,本文僅能說明CysC水平與老年缺血性PSCI的相關性,不能得出二者之間存在因果關系。其次,本研究為單中心、小樣本、橫斷面研究,僅進行了一次CysC水平及MoCA評分檢測,未動態監測血清CysC水平隨患者MoCA評分的變化。為了避免選擇偏倚的局限性,還需進行多中心、大樣本并縱向隨訪研究來證實。

