復合全氟三丁胺攜氧材料的嗅鞘細胞移植促進大鼠周圍神經損傷修復的研究
雷 可,雷 濤,朱 萌,邱 容,王 倩,梁卓文
周圍神經損傷后雖然具有一定的再生能力,但是再生能力有限,在大部分再生神經重新到達并支配靶組織之前,遠端靶組織就已發生萎縮[1-2]。 因此,如何加快神經軸突生長及功能恢復是困擾人們的難題。 嗅鞘細胞(olfactory ensheathing cells,OECs)是一種特殊的嗅神經系統膠質細胞[3],大量的研究表明,OECs 能夠促進中樞以及外周神經系統神經再生[4-6]。 然而,細胞移植至神經損傷區域將面臨缺氧微環境,進一步影響移植細胞活性,嚴重制約細胞移植的神經修復效果[7]。 因此,改善OECs 移植區域的局部微環境供氧非常必要。組織工程材料的發展,為解決這一問題帶來了希望。 全氟碳化物(perfluorocarbons,PFCs),如全氟三丁胺(perfluorotributylamine,PFTBA)能夠高效提升組織材料中的氧含量,作為血液替代品廣泛應用[8-9]。 多項研究表明,在低氧條件下,PFTBA 能提高不同類型的細胞活性及存活率[7,10]。 因此,PFTBA 成為一種有吸引力的補充材料,能夠為移植在損傷區域的OECs 提供持續氧供,打破其缺氧微環境。 本研究將PFTBA 作為材料與Matrigel 混合為攜氧材料與OECs 混合后植入聚己內酯(polycaprolactone,PCL)靜電紡絲神經導管。 在體內條件下測試該復合物神經導管對大鼠坐骨神經1 cm 缺損的修復效果,為其在周圍神經再生領域的應用提供實驗基礎。
1 材料和方法
1.1 材料 選取6 ~8 周齡雄性SD 大鼠,10 只用于提取OECs,96 只用于體內實驗。 所有大鼠均由空軍軍醫大學實驗動物中心提供,本實驗已通過空軍軍醫大學動物實驗倫理委員會批準(KY20172005-1)。DF12(DMEM 和Ham′s F12 的1 ∶1混合物)細胞培養基、胎牛血清、青-鏈霉素(美國Gibco 公司);胰蛋白酶、磷酸鹽緩沖液、Triton X-100(北京索萊寶科技有限公司);左旋多聚賴氨酸(poly-L-lysine,PLL)、聚ε-己內酯(ε-caprolactone,PCL)、4′,6-二脒基-2-苯基吲哚(DAPI)(美國Sigma-Aldrich 公司);多聚甲醛(上海碧云天生物技術有限公司);進口山羊血清工作液(北京中杉金橋生物技術有限公司);SMA 單克隆抗體、p75NTR單克隆抗體、NF160 單克隆抗體(英國Abcam 公司);山羊抗鼠Cy3、山羊抗兔FITC、山羊抗鼠FITC(北京康為世紀生物科技有限公司)。細胞培養瓶(廣州潔特生物過濾股份有限公司);石蠟切片機(德國LEICA 公司);共聚焦顯微鏡(日本Nikon 公司);透射顯微鏡(日本Hitachi 公司);光學顯微鏡(日本Olympus 公司)。
1.2 方法
1.2.1 實驗分組 SD 大鼠60 只,隨機分為3組:自體神經移植組,PFTBA-OECs 神經導管組(PFTBAOECs組);OECs 神經導管組(OECs組),每組20 只。
1.2.2 OECs 的提取以及純化 依照Goulart 等[11]總結的方法并加以少許改動,分離6 ~8 周齡的雄性SD 大鼠嗅球,并從中剝取嗅神經層及嗅粘膜。0.25%胰蛋白酶消化20 min。 終止消化,1000 r/min 離心5 min,使用含有10%胎牛血清的DF12 培養基重懸細胞,接種;36 h 后,取未貼壁的細胞懸液,接種至PLL 包被的培養瓶中,正常培養基繼續培養7 d,貼壁細胞用于后續實驗。
1.2.3 OECs 鑒定 純化后的OECs,固定后進行免疫熒光染色,對SMA 和p75NTR進行特異性免疫熒光標記。 拍攝選取隨機區域并計數SMA 和p75NTR均陽性細胞數量及DAPI 標記細胞核數量,兩者之比計算OECs 純度。
1.2.4 移植后細胞活性測試 使用慢病毒轉染OECs 細胞[12],使其表達綠色熒光蛋白,即GFP-OECs。術后3,7,14,28 d,將各組大鼠(每個時間點,每組大鼠9 只)神經移植物,縱斷面冰凍切片,在熒光顯微鏡下對GFP-OECs 進行計數。 每個切片隨機選取5 個視野(1000 μm×300 μm)用于分析。
1.2.5 坐骨神經再生評估 取各組大鼠坐骨神經移植物石蠟切片。 對切片進行免疫熒光染色,特異性標記NF200 和S100。 通過共聚焦顯微鏡收集免疫熒光染色結果。
1.2.6 再生神經軸突髓鞘化評估 將各組神經移植物處理后超薄切片,透射電鏡觀察并計算再生軸突的髓鞘厚度。
1.2.7 功能恢復評估 計算坐骨神經指數(sciatic function index,SFI)評估坐骨神經損傷后功能恢復,術后4、8 周,分別收集各組大鼠5 只可進行足跡測量。 用以計算SFI 值。
1.3 統計學處理 應用SPSS 24.0 統計學軟件進行分析,計量資料以均數±標準差(±s)表示,兩組間比較使用t檢驗,多組間比較使用單因素方差分析;計數資料采用率表示,行χ2檢驗;P<0.05 為差異有統計學意義。
2 結果
2.1 實驗動物數量分析 自體神經移植組,OECs
神經導管組,PFTBA-OECs 神經導管組大鼠均存活,全部進入后續實驗數據分析。
2.2 OECs 純度 OECs 經過純化后進行p75NTR和SMA 雙標免疫熒光染色(圖1)。 OECs 純度(%)=p75NTR和SMA 雙標染色均陽性細胞數量及DAPI 標記的同一視野細胞核數量。 本研究所測得的OECs純度為(95.8±2.1)%。
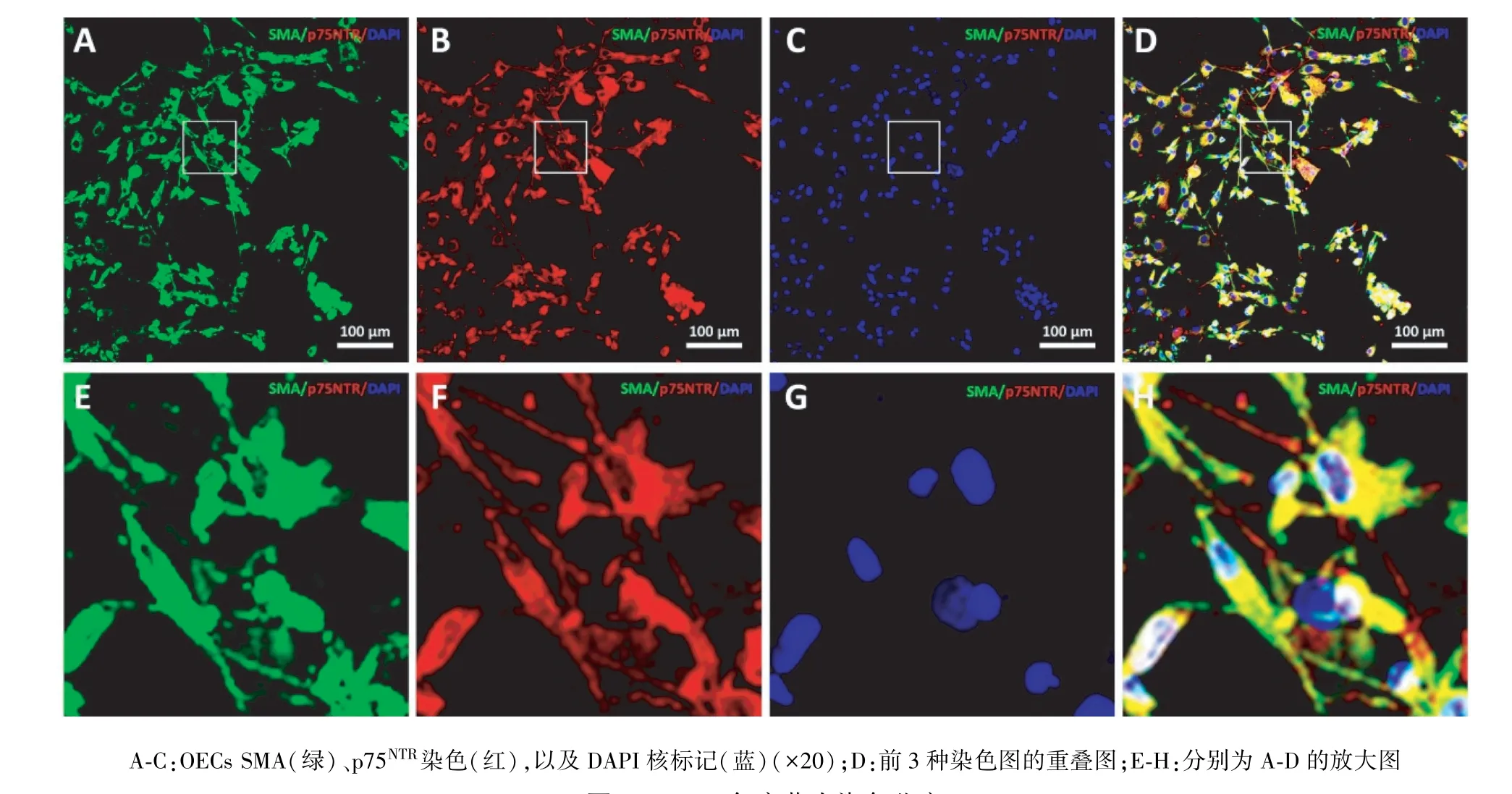
圖1 OECs 免疫熒光染色鑒定
2.3 PFTBA 對移植OECs 成活率的影響 術后3、7、14、28 d 分別對GFP-OECs 計數。 PFTBA-OECs組GFP-OECs 數量在術后每個統計時間點均明顯多于OECs組(P<0.05),圖2。
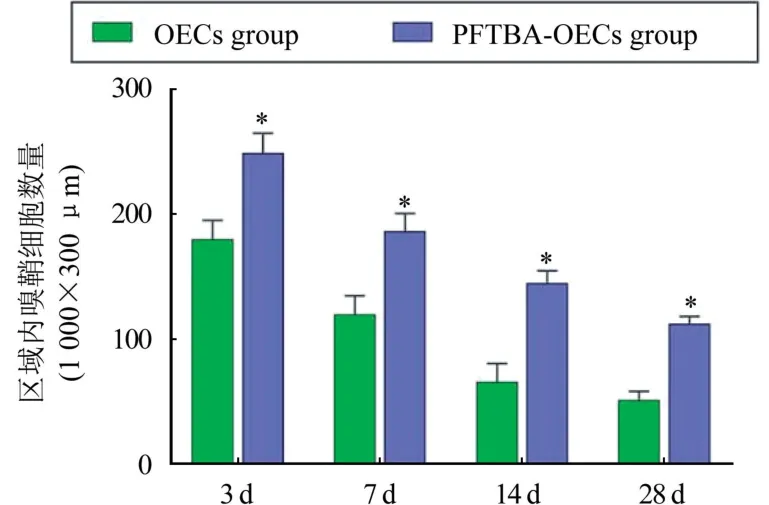
圖2 PFTBA 在體內條件下對OECs 存活率的影響
2.4 PFTBA-OECs 對神經再生的影響 術后4 周免疫熒光染色結果顯示,自體神經組和PFTBAOECs組再生神經纖維在損傷遠端也有分布,雪旺細胞數量也明顯多于OECs組(P<0.05),圖3。
2.5 PFTBA-OECs 對再生軸突髓鞘化的影響 術后4 周再生神經組織的透射電鏡結果顯示,PFTBAOECs組再生神經軸突的數量明顯多于OECs組(P<0.05),與自體神經移植組接近;PFTBA-OECs組髓鞘厚度明顯優于OECs組(P<0.05),圖4。
2.6 PFTBA-OECs 對坐骨神經損傷后功能恢復的影響 術后2、4、8 周SFI 顯示PFTBA-OECs組SFI值與自體神經移植組接近(P>0.05),明顯優于OECs組(P<0.05),圖5。

圖3 PFTBA-OECs 對大鼠坐骨神經再生的影響
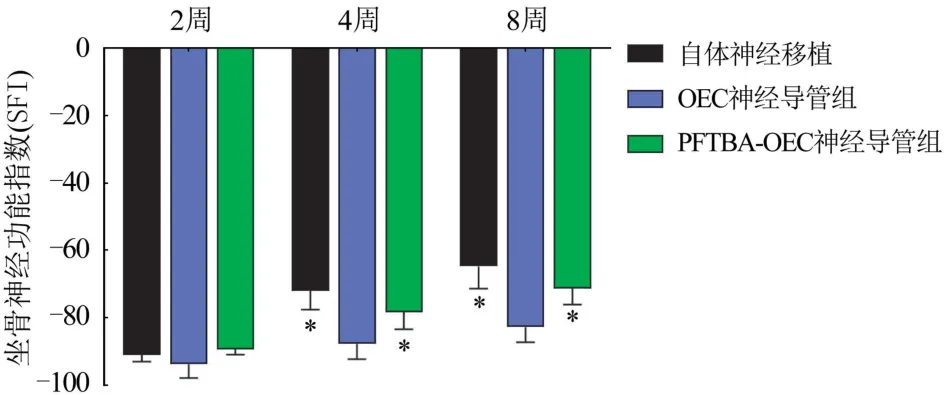
圖5 術后2、4、8 周大鼠SFI 值統計圖
3 討論
OECs 能夠促進中樞神經系統以及外周神經系統神經的再生以及生長[13-15]。 盡管OECs 移植能夠在一定程度上促進神經的再生以及功能的恢復,但是移植后,局部微環境的惡化[16],如缺氧、炎性反應等,致使移植細胞存活率低、生物活性差,嚴重制約了OECs促神經修復作用的發揮[7]。 因此,為移植細胞設計持續的供氧方案對于提高神經修復非常必要。
大量研究表明PFTBA 能夠提高多種細胞在缺氧狀態下的細胞活性。 因此,PFTBA 為組織工程修復神經缺損的局部缺氧提供了解決方法。 本研究發現復合有PFTBA 的OECs 在神經導管內存活率顯著提高。 在大鼠坐骨神經損傷模型中發現PFTBA 能夠有效打破移植局部缺氧微環境,顯著促進再生軸突的生長,為再生神經軸突營造良好的再生微環境。
本研究還發現PFTBA-OECs 能夠提升再生神經軸突的髓鞘化程度。 各處理組大鼠SFI 值表明,PFTBA-OECs 處理組大鼠的神經功能恢復情況明顯優于OECs 處理組。 本研究的缺點是尚未就PFTBA對細胞活性影響促進神經再生的具體機制進一步探究。 下步實驗將進一步深入了解PFTBA 促進神經再生的具體分子機制。
綜上所述,本研究證實了PFTBA 在OECs 移植以及組織工程方法修復神經缺損過程中的有效性,為解決組織修復材料局部缺氧提供了解決方案,為進一步提高組織工程方法修復神經損傷療效提供了新視野。

