黃瓜葉酸合成關鍵基因克隆與分析
周琪,劉小萍,薄凱亮,苗晗,董邵云,顧興芳,張圣平
(中國農業科學院蔬菜花卉研究所/農業農村部園藝作物生物學與種質創制重點實驗室,北京 100081)
0 引言
【研究意義】葉酸是人體生命活動必需的水溶性B族維生素,其分子由蝶啶、對氨基苯甲酸和谷氨酸殘基三部分組成[1]。根據取代基的不同,葉酸分為不同的種類,目前在動植物中已發現的葉酸種類有50多種[2-3]。葉酸參與核苷酸的生物合成、氨基酸代謝和甲基化循環,是細胞內主要的甲基供體,對DNA的合成、甲基化和修復至關重要[4-6]。美國食品和營養委員會推薦葉酸的攝取量成年人為400 μg·d-1,孕婦為600 μg·d-1。葉酸缺乏會引發巨幼紅細胞貧血和老年人認知功能障礙等疾病[7-8]。但人體無法自身合成葉酸,必須依賴飲食攝入。與水稻、谷子等作物相比,蔬菜中葉酸含量較高,成為人體攝入葉酸的主要來源[9-10]。由于烹飪加熱過程會導致葉酸降解[11-13],黃瓜以生食為主,能使其含有的葉酸不經烹飪降解而最大限度地保留,被人體吸收利用,成為人體補充葉酸的最佳選擇之一。黃瓜中葉酸合成代謝的分子生物學研究尚未見報道,研究黃瓜果實的葉酸合成代謝具有重要意義。【前人研究進展】植物中葉酸代謝途徑分為喋啶分支和pABA分支[3]。GTP在細胞質中形成喋啶,ADC在葉綠體中裂解生成pABA,隨后二者被轉入線粒體中形成二氫蝶酸,經谷氨酸化和還原反應形成四氫葉酸,最后通過加尾作用形成多尾葉酸[14-15]。在蝶啶分支中,GTP環化水解酶(GTPCHI)是催化第一步反應的酶,也是該分支的限速酶,調控該酶的基因為GCHI[16-18]。在pABA分支中,氨基脫氧分支酸合酶(ADCS)是其限速酶[19],由基因ADCS調控合成。GTP環化水解酶與氨基脫氧分支酸合酶被認為是限制植物葉酸合成途徑的兩個關鍵酶[20]。黃瓜是我國的重要蔬菜作物,尤其在設施生產中占有舉足輕重的地位,2017年收獲面積為123.52萬hm2,產量達到6 482.46萬t[21]。我國黃瓜以鮮食為主,能使其含有的葉酸得到最大限度的保留而被人體吸收利用。【本研究切入點】模式植物擬南芥中葉酸合成代謝相關研究較為深入,關于黃瓜葉酸代謝調控以及葉酸合成關鍵酶基因的克隆與表達分析尚未見報道。【擬解決的關鍵問題】本研究參考擬南芥調控葉酸合成代謝基因的蛋白序列,BLAST得到黃瓜的同源基因,并完成其在染色體上的定位。利用熒光定量PCR技術分析這些基因在測序黃瓜果實發育不同時期以及果實葉酸含量高低差異顯著的2份材料中的表達量。通過蛋白序列比對、結構域分析以及進化樹構建,分析調控葉酸合成限速步驟的關鍵酶基因的序列保守性,并克隆這兩個關鍵酶基因,分析其序列在不同材料中的差異。
1 材料與方法
1.1 試驗材料
本研究試驗材料為完成全基因測序的黃瓜自交系9930,以及果實葉酸含量高低差異顯著的2份自交系5G(低)和02245(高)。試驗材料于2018年春、秋兩季種植于中國農業科學院南口試驗基地連棟大棚(北京),前期正常管理,9930黃瓜果實發育不同時期葉酸含量測定:開花前2 d、開花當天、開花后7 d、開花后14 d、開花后21 d果實中的葉酸含量。65G和02245的果實葉酸含量測定在植株盛瓜期取樣,且選取植株中部節位、大小合適的商品瓜。
1.2 試驗方法
1.2.1 黃瓜葉酸合成代謝相關基因鑒定 根據文獻[8]和TAIR數據庫(https://www.arabidopsis.org/)獲得擬南芥與葉酸合成代謝相關基因的蛋白序列,利用BLAST方法在黃瓜9930_V3基因組上尋找相似性較高的同源基因。再通過BLAST,將這些基因比對到擬南芥TAIR10基因組中,獲取具體的基因名稱。采用MapChart軟件繪制黃瓜葉酸代謝相關基因在染色體上的物理位置。
1.2.2 黃瓜材料取樣方式及葉酸含量測定 每一份材料3個生物學重復,每個重復選取3條瓜,每個瓜上、中、下部位切取3個薄片,用液氮速凍。同一個生物學重復的樣品混合均勻并研磨成粉末,利用雙酶法提取葉酸,利用液相色譜三重四級桿質譜聯用儀測定葉酸含量[22]。
1.2.3 總RNA的提取與cDNA第一鏈的合成 果實取樣后用錫箔紙包裹于液氮中速凍,然后用研缽將其研磨成粉末。根據TaKaRa的RNA提取試劑盒提取RNA,利用Nanodrop2000核酸儀檢測其濃度,并經凝膠電泳檢測其完整性,質量合格的RNA可觀察到兩條清晰明亮的帶型。之后取適量的RNA,同時使用反轉錄試劑盒合成cDNA第一鏈。
1.2.4 黃瓜葉酸合成基因在果實發育不同時期及不同材料中的表達量分析 以反轉錄cDNA為模板,以黃瓜中穩定表達的基因(Csa_2G301530)為內參基因,針對基因功能序列分別設計引物(附表2),盡量保證引物無二聚體、發夾結構等。利用TaKaRa SYBR?Premix Ex Taq?II試劑盒(北京六合通經貿有限公司)對9930果實發育不同時期以及果實葉酸含量高低差異顯著的65G和02245中的基因進行實時熒光定量分析,采用F=2-△△Ct法分析其表達量[23]。
1.2.5 黃瓜葉酸合成關鍵酶基因的蛋白序列比對及系統進化樹構建 從NCBI上搜索各物種葉酸合成關鍵酶GTPCHI及ADCS同源基因的蛋白序列,利用MEGA軟件對序列進行比對,構建系統進化樹。利用在線軟件(http://weblogo.berkeley.edu/logo.cgi)對5個結構域氨基酸保守性進行分析。
1.2.6 黃瓜GCHI及ADCS的克隆與序列分析 根據黃瓜基因組網站信息(http://cucurbitgenomics.org/organism/3),利用primer 5.0設計引物擴增兩個基因(附表1)。建立20 μL的擴增體系,利用高保真酶(南京諾維贊)對兩個基因進行擴增。PCR循環條件為,95℃預變性3 min,95℃變性 15 s,60℃退火 15 s,72℃延伸 3 min,35個循環;72℃延伸5 min,10℃保存。每個擴增的基因盡量包含部分3′UTR和5′UTR序列,對于序列過長的基因設計多對引物,分段擴增,每段接頭部分有大于100 bp的重合。
擴增產物均用1%的瓊脂糖凝膠電泳進行檢測,送至上海生物工程有限公司測序。測序結果拼接后,比對分析同一基因在不同材料中的序列差異。
1.2.7 基因的生物信息學分析 利用在線軟件Expasy(https://www.expasy.org/)預測黃瓜CsGCHI及CsADCS編碼蛋白的等電點及分子量等,利用在線工具WoLF PSORT(https://wolfpsort.hgc.jp/)預測亞細胞定位情況。
2 結果
2.1 黃瓜葉酸合成相關基因
擬南芥中已報道的與葉酸代謝相關的酶共14個,其中大部分酶參與葉酸合成過程,其余為葉酸轉運子或與葉酸降解相關(表1)。其中羥甲基二氫蝶呤焦磷酸激酶(HPPK)/二氫蝶呤合成酶(DHPS)是一個雙功能酶,催化兩步連續的反應[10]。通過基因組數據庫獲取擬南芥中調控這些酶的基因序列,經BLAST比對尋找黃瓜中的同源基因。得到19個黃瓜中與葉酸代謝相關的基因,其中有11個(標*)參與合成途徑,包含了葉酸從頭合成的全部反應。
2.2 基因的染色體定位
根據各基因在染色體上的物理位置,利用MapChart軟件繪制黃瓜染色體物理圖譜并進行基因定位(圖1)。結果發現,這19個基因不均勻分布在黃瓜的7條染色體上,其中,4號和5號染色體上最多(4個),1號和3號染色體次之(3個),2、6號染色體較少(2個),7號染色體最少(1個)。除基因CsaV3_2G011840(D)、CsaV3_2G014940(E)、CsaV3_3G021950(F)外,其余大多分布在染色體長、短臂的兩端。
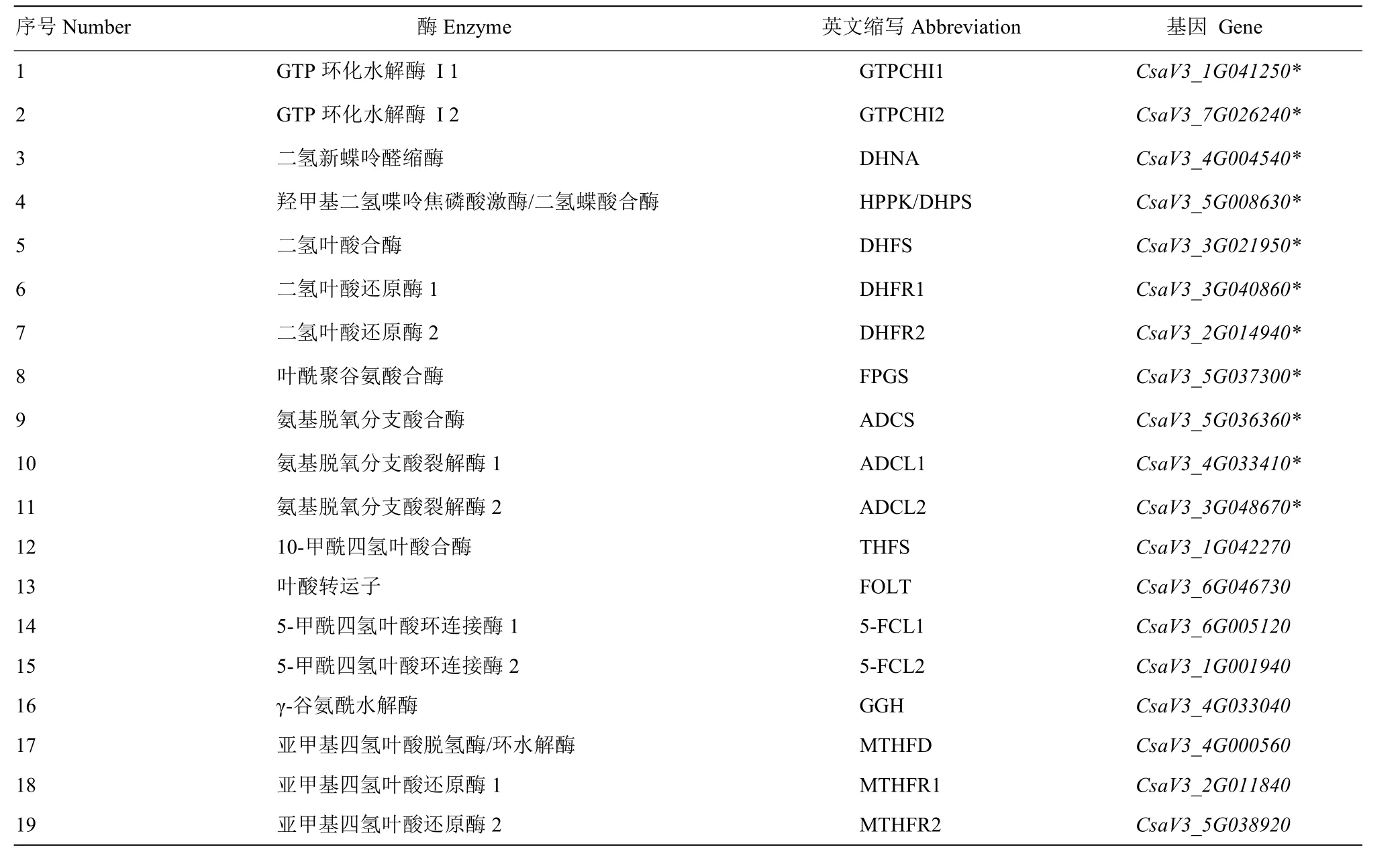
表1 黃瓜葉酸合成相關基因Table 1 Folate metabolism related genes in cucumber

圖1 黃瓜中葉酸合成相關基因在染色體上的位置Fig.1 The position on the chromosome of genes involving in folate synthesis in cucumber
2.3 9930果實發育不同時期葉酸含量及對應時期的葉酸合成基因的表達量
測定黃瓜自交系9930果實發育不同時期的葉酸含量(圖2-a),結果表明,開花當天葉酸含量最高,為42.16 μg/100 g FW,開花21 d的葉酸含量最低,為21.76 μg/100 g FW。葉酸含量的規律表現為,在開花之前呈上升趨勢,開花當天達到最高,開花之后呈下降趨勢。
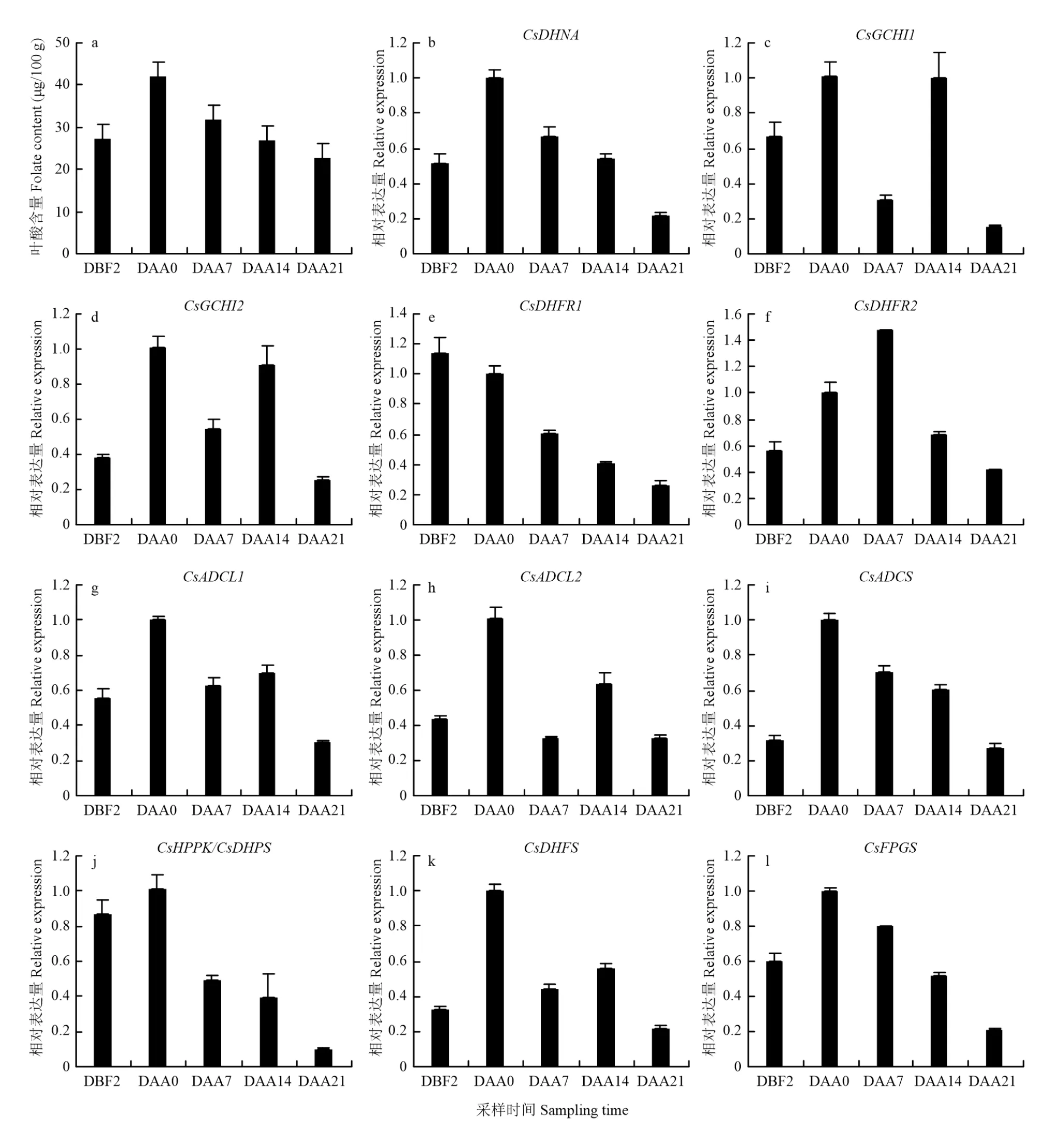
圖2 黃瓜葉酸合成基因在果實發育不同時期的表達量Fig.2 The expression level of folate synthetic genes in cucumber fruit at different stages
分析與葉酸合成相關的11個基因在9930果實發育不同時期的表達量,從表達量變化趨勢來看,在同源基因中,CsGCHI1與CsGCHI2(圖 2-c、d)、CsADCL1與CsADCL2(圖2-g、h)的趨勢一致。CsDHFR1的表達量在整個發育過程中呈下降趨勢,而CsDHFR2先上升后下降(圖2-e、f)。在開花前,除基因CsDHFR1(圖2-e)外的其他基因表達量均上升,與總葉酸含量呈正相關。在開花之后,基因CsDHFR1、CsFPGS、CsHPPK/CsDHPS、CsDHNA在果實發育過程中呈現下降的趨勢(圖2-b、e、j、l)。在整個發育過程中,基因CsFPGS、CsHPPK/CsDHPS、CsDHNA、CsADCS與葉酸含量變化趨勢完全一致(圖2-b、i、j、l)。
2.4 果實葉酸含量高低差異顯著材料65G和02245中基因的表達量分析
分別在2018年春季和2018年秋季測定核心種質群體[24]葉酸含量,從中挑選出在兩季中葉酸含量比較穩定的兩份材料65G及02245,65G果實的平均葉酸含量為21.75 μg/100 g,02245果實的平均葉酸含量36.15μg/100g。差異顯著性分析表明,兩者總葉酸含量具有顯著差異,且65G總低于02245(圖3-a)。測定11個葉酸合成相關基因在65G及02245中的表達量,分析發現,基因CsADCL1、CsADCL2、CsDHNA、CsFPGS的表達量具有顯著差異,基因CsADCS、CsDHFS、CsHPPK/CsDHPS表達量具有極顯著差異(圖3-b),且這些基因均在02245中高表達,與葉酸含量正相關。
2.5 黃瓜及其他物種GCHI蛋白質序列分析及進化樹構建
在細胞質中,GTPCHI催化GTP合成甲酸和二氫蝶呤三磷酸,這一反應是真核生物合成葉酸喋啶分支的第一步反應,也是該分支的限速步驟[16-18]。黃瓜中控制GTPCHI合成的同源基因是CsaV3_1G041250和CsaV3_7G026240(表1)。這兩個基因與擬南芥中該基因蛋白質序列的一致性分別為60%和61%(圖4-a)。利用NCBI網站進行BLAST分析得到除黃瓜外8個物種中該基因的蛋白序列,利用MEGA6中的Clustal W對蛋白序列進行比對。結果表明,各物種中GCHI同源基因均含有兩個GTP_cyclohydroI結構域,且無論是單子葉植物水稻、玉米還是雙子葉植物擬南芥中,該蛋白的結構域高度保守,說明它們可能來自共同的祖先(圖4-b)。
對各物種GCHI的氨基酸序列進行系統進化樹分析(圖4-c),發現同一物種或親緣關系較近的物種聚在一起,黃瓜首先與其他葫蘆科作物甜瓜、西瓜等聚在一起,說明該基因在親緣關系較近的物種中進化是保守的,可能行使著相同或相近的功能。
2.6 黃瓜及其他物種ADCS蛋白質序列分析及進化樹構建
在葉綠體中,ADCS催化葉酸前體4-氨基-4-脫氧絡合物(ADC)的生物合成,該步驟是pABA分支的限速步驟[14],黃瓜中控制該酶合成的同源基因是CsaV3_5G036360。CsaV3_5G036360與擬南芥該基因蛋白序列的一致性為57%。同樣通過BLAST找到除黃瓜外10個物種中該基因的同源蛋白序列,蛋白序列比對發現,ADCS含有4個結構域,包括2個GATase,1個Chorismate_bind和1個Anth_synt_I_N結構域(圖5-a),這4個結構域在不同物種中高度保守(圖5-b—e)。
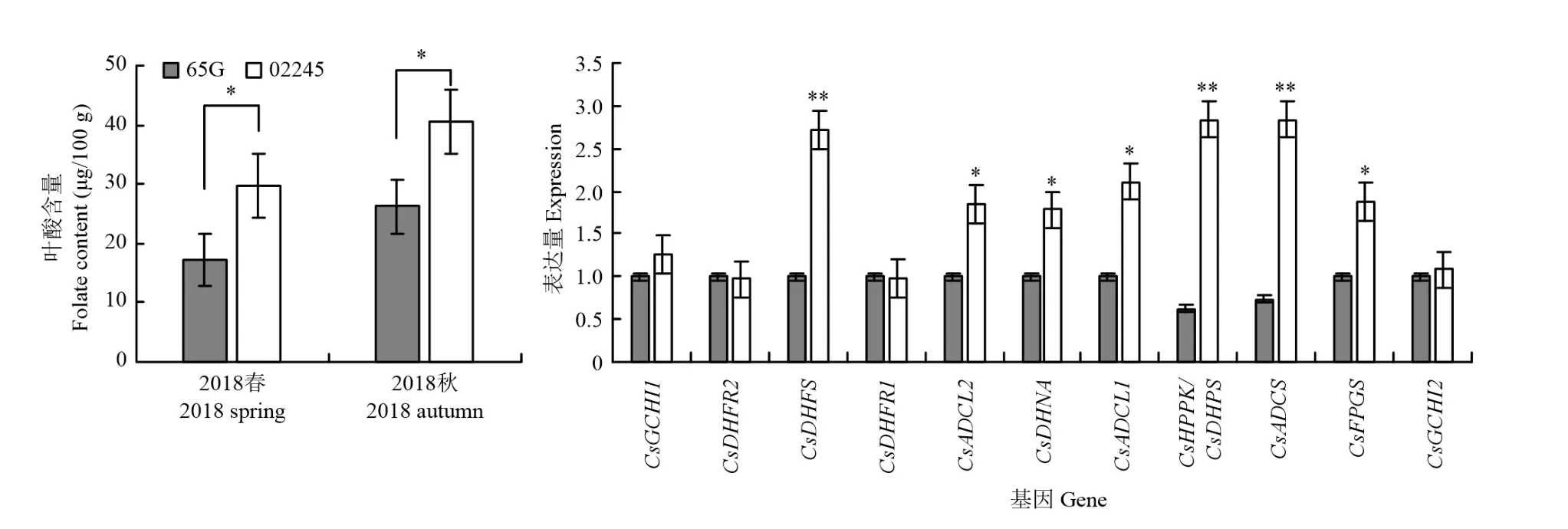
圖3 不同材料葉酸含量及基因表達量分析Fig.3 The folate content in 65G and 02245 and the expression level of folate metabolism related genes

圖5 黃瓜及其它物種ADCS蛋白序列比對以及進化樹Fig.5 Protein sequences alignment and evolutionary-tree generation of ADCS in cucumber and other species
從ADCS同源蛋白構建的進化樹中可以看到,這個基因在進化的過程中十分保守,遵循單子葉植物同源蛋白聚類到一起,雙子葉植物同源蛋白聚類到一起的進化原則。黃瓜與同屬葫蘆科的甜瓜等聚類到一起(圖5-f)。表明這個基因在不同植物中的功能比較保守,都催化葉酸前體的合成。
2.7 黃瓜GCHI與ADCS基因全長的克隆與序列分析
分別擴增果實葉酸含量高低差異顯著的65G和02245中調控葉酸合成限速步驟的關鍵酶基因GCHI和ADCS的序列。結果表明,在兩份材料中,CsaV3_1G041250全長均為3 012 bp,CDS長度均為1 413 bp(附圖1)。在兩份材料中有多個SNP差異位點,有7處變異發生在內含子區域,CDS區有3處突變未引起蛋白質序列的改變,有3處SNP的突變導致了氨基酸序列的改變,第2 474 bp處,65G與02245編輯的氨基酸分別為天冬酰胺和蘇氨酸,第2 669 bp處分別為絲氨酸和酪氨酸,第3 018bp處分別為丙氨酸和纈氨酸(圖6)。在兩份材料中,CsaV3_7G026240全長均為3047bp,CDS長度均為1407bp,在內含子區有一個變異,氨基酸序列無差異(附圖2);Csa5G623430全長均為7 941 bp,CDS長度均為2 706 bp,變異均發生在內含子區域,氨基酸序列無差異(附圖3)。
2.8 黃瓜GCHI與ADCS基因的生物信息學分析
黃瓜CsGCHI及CsADCS編碼蛋白的等電點(pI)及分子量預測結果表明CsGCHI等電點理論值為6.38,編碼468個氨基酸,估計分子量51.621 kD,總平均親水性為-0.350,說明該蛋白為親水性蛋白。CsGCHI蛋白分子不穩定參數為37.90,小于40,因此該蛋白是穩定蛋白。CsADCS等電點理論值為5.88,編碼901個氨基酸,估計分子量101.17 kD,總平均親水性為-0.350,該蛋白為親水性蛋白。CsADCS蛋白分子不穩定參數為44.31,大于40,因此該蛋白是不穩定蛋白。亞細胞定位情況預測結果表明,CsGCHI蛋白最可能定位于高爾基體,而CsADCS蛋白定位于細胞質的可能性最大。

圖6 黃瓜CsaV3_1G041250基因在65G、02245中的序列差異Fig.6 The sequence difference of CsaV3_1G041250 between 65G and 02245
3 討論
擬南芥中已報道的與葉酸代謝相關的酶有14個,分別由26個基因調控[8]。學者們利用同源比對來尋找其他作物中與葉酸代謝相關的基因,其中水稻中14個,番茄中10個。本研究獲得19個黃瓜葉酸代謝相關基因,其中11個參與葉酸合成,包括了葉酸從頭合成的全部反應過程。這19個基因在黃瓜7條染色體上均有分布,且大多位于染色體長、短臂兩端。對番茄果實葉酸合成基因表達模式的研究發現,基因GCHI、ADCS和ADCL隨著果實成熟,其表達量逐漸降低,基因DHFR和DHFS的表達在果實發育后期顯著升高,而其他基因在不同發育階段變化不明顯[25]。在小麥種子發育過程中,基因GCHI、ADCS的表達量逐步下降,基因FPGS在種子5—30 d的表達量維持恒定,而后迅速降低[20]。在水稻中,GCHI、ADCS和HPPK均在開花期表達最高(不同時期表達變化5—6倍),在乳熟期(5—10 DPA)至種子成熟時期,這3個基因的表達又逐步回升。FPGS在抽穗期表達量最高而后逐步下降[26]。本研究中,在開花之前,CsDHFR1>CsDHFR2;在開花之后,CsDHFR1<CsDHFR2。推測CsDHFR1在開花之前起主要作用,CsDHFR2在開花之后起主要作用。在黃瓜中,基因CsADCS、CsGCHI、CsHPPK/CsDHFS與水稻中這些基因的表達趨勢類似,在開花當天表達量最高;基因CsFPGS也與小麥和水稻中類似,在果實發育過程中呈下降趨勢,推測它們可能受相同或相近的模式調控。尤為重要的是,黃瓜中存在與果實葉酸含量變化趨勢完全一致的基因CsDHNA、CsHPPK/CsDHFS、CsFPGS以及CsADCS,推測它們對不同時期葉酸含量變化趨勢起主要作用。
葉酸合成分為pABA分支和喋啶分支,pABA分支包括兩步反應,分支酸和谷氨酰胺在氨基脫氧分支酸合成酶(ADCS)的催化下生成氨基脫氧分支酸,其產物在氨基脫氧分支酸裂解酶(ADCL)的催化下合成對氨基苯甲酸(pABA)[27]。黃瓜中調控這兩步反應的基因CsADCS、CsADCL表達量在65G與02245中均具有顯著差異。喋啶分支包括4步反應,GTP在GTPCHI的催化下形成二氫新蝶呤三磷酸(DHN-P3),DHN-P3經兩步去磷酸化反應生成二氫新蝶呤(DHN),DHN的側鏈在二氫新蝶呤醛縮酶(DHNA)的作用下被切除,釋放出二氫蝶啶(HMPHP)[28]。在黃瓜中,調控這4步反應的基因僅CsDHNA在65G與02245中具有顯著差異。
隨后,pABA分支和喋啶分支的產物轉入線粒體中合成四氫葉酸。首先二氫蝶啶在二氫蝶啶焦磷酸激酶(HPPK)的催化下生成具有活性的焦磷酸鹽化合物,然后與pABA在二氫蝶酸合酶(DHPS)的催化作用下形成二氫蝶酸(DHP)。隨后在二氫葉酸合成酶(DHFS)的催化下形成單尾形式的二氫葉酸。二氫葉酸分別在二氫葉酸還原酶(DHFR)和葉酰多谷氨酰合成酶(FPGS)的催化下形成多尾形式的四氫葉酸[29]。黃瓜中調控這幾步反應的基因中,CsHPPK/CsDHPS、CsDHFS、CsFPGS的表達量在 65G與02245中具有顯著差異。在整個葉酸合成通路中有6個基因在65G與02245具有顯著差異,且在葉酸含量高的材料中,差異基因的表達量也高,基因的表達量與葉酸含量呈正相關。
葉酸的強化主要依靠過量表達葉酸合成過程中的酶實現,GTPCHI和ADCS分別是葉酸合成過程中喋啶分支和PABA分支的限速酶[20]。國內外的學者將控制這兩個酶的基因在擬南芥[30]、番茄[31]、水稻[32]中過量表達,葉酸含量均得到了顯著提高。因此,在植物中過量表達控制這兩個酶的基因,是利用轉基因技術提高植物中葉酸含量的有效途徑。本研究中,黃瓜CsGCHI兩個同源基因氨基酸序列與擬南芥中該酶氨基酸序列的同源性較高。氨基酸序列比對以及結構域分析表明,GTPCHI的結構在整個進化過程中得到了很好的保存。擴增兩份不同材料中CsGCHI基因序列,在CDS區找到6個SNP位點的差異,其中有3個導致了氨基酸序列的改變,且都發生在具有GTPCHI催化活性的保守結構域內,但是該基因的表達量沒有差異。推測該基因可能通過氨基酸序列的改變行使功能,并進一步影響葉酸含量。黃瓜CsADCS氨基酸序列與擬南芥中該酶氨基酸序列同源性較高,各物種中該基因的蛋白序列高度保守且都具有4個結構域,可能行使相同或相似的功能。
4 結論
本研究成功鑒定出19個不均勻分布在7條染色體上的黃瓜葉酸代謝相關基因,基因CsFPGS、CsHPPK/CsDHPS、CsDHNA和CsADCS是影響黃瓜果實葉酸含量變化,導致葉酸含量高低顯著差異的關鍵基因。調控葉酸合成限速步驟的關鍵酶基因CsGCHI及CsADCS功能相對保守,CsGCHI在黃瓜65G、02245中有3個SNP位點的突變導致了氨基酸序列的差異。本研究明確了相關基因在黃瓜果實發育不同時期以及不同材料中的表達量差異,分析了關鍵酶基因的序列差異,為揭示黃瓜葉酸合成代謝調控網絡奠定了基礎。
致謝:感謝中國農業科學院生物技術研究所公共實驗室韓麗妲老師及實驗室成員萬幸、楊敏等對黃瓜果實葉酸含量測定提供的幫助!

