紫花苜蓿MsDWF4的表達特性及耐鹽性效應
崔苗苗,馬琳,張錦錦,王筱,龐永珍,王學敏
(中國農業科學院北京畜牧獸醫研究所,北京100193)
0 引言
【研究意義】紫花苜蓿(Medicago sativaL.)為豆科苜蓿屬多年生牧草[1],莖葉中含有豐富的蛋白質、礦物質和維生素,因其高營養價值和高消化率等優點,被譽為“牧草之王”,是中國乃至世界上種植面積最大,種植范圍最廣的豆科牧草[1-3]。然而在中國,紫花苜蓿多種植在沒有灌溉條件的瘠薄地和鹽堿地[4],造成紫花苜蓿單位面積產量低、干草品質差、粗蛋白含量較低、種子細小和總量供應不足等問題[5],嚴重制約了苜蓿的產業化發展。海關統計數據顯示中國苜蓿的進口量呈逐年上升趨勢[6]。因此,加快培育高產抗逆紫花苜蓿是提高苜蓿產業化程度,盡快擺脫依賴進口局面的有效手段[7]。研究抗逆基因對紫花苜蓿抗逆性的調控作用,對于深入了解紫花苜蓿的抗逆機制,從而更好的指導紫花苜蓿抗逆育種具有非常重要的意義。油菜素內酯(brassionsterinds,BRs),又稱為蕓苔素內酯,因其強大的生理活性,被列為第六大類植物激素[8],參與并促進植物種子發芽、根莖伸長生長、光形態建成和生殖發育等過程和增強植物對高溫、低溫和高鹽等逆境的抗逆性[9]。近年來,對BRs的研究較多,但對BRs相關基因調控植物抗逆性的分子機制研究相對較少,在紫花苜蓿中更缺乏相關內容的報道。DWF4編碼的細胞色素氧化酶CYP90B1,是BRs合成的關鍵限速酶[10],在BRs的生物合成中催化C-22羥基化反應。挖掘紫花苜蓿中的DWF4,研究其對紫花苜蓿抗逆性的調控作用,對于在油菜素內酯合成途徑方面了解紫花苜蓿的抗逆應答機制具有重要的意義。【前人研究進展】油菜素內酯是1970年由MITCHELL等[11]從油菜花粉中篩選和分離出來的具有高生物活性的物質,并命名為油菜素。1979年,GROVE等[12]解析出其化學結構為甾醇內酯,迄今為止,已經分離出了70多種類似的化合物,統稱為油菜素甾醇類化合物[13]。通過對外源施加的標記中間產物和 BR突變體的研究,目前,BRs的合成途徑已經日漸清晰:從起始物鯊烯,經過多個生物化學反應,最終合成BRs[14],這其中有眾多的基因參與。DWF4編碼的細胞色素P450家族的CYP90B1蛋白酶(一種細胞色素P450單加氧酶),是甾醇到brs2生物合成途徑分支點的第一限速酶,起C-22羥化酶的作用[10,15],該步驟(圖 1[10])是油菜素內酯(BRS)生物合成和內源性油菜素內酯水平反饋調控的關鍵[13]。1998年,CHOE等[13]和SHIMADA等[16]從擬南芥中鑒定得到第一個DWF4,該基因的突變體生長緩慢,植株矮小,葉片小而多,且高度不育,而超表達DWF4促使植物中油菜素內酯合成的增加,進而促進植物的生長并增強植物的抗逆性。進一步研究表明,在促進植物生長方面,超表達DWF4主要通過促進植物細胞的伸長和分裂進而促進轉植株的生長[17]。此外DWF4還參與調控植物的分枝、花序、種子產量等,與野生型相比,超表達DWF4的轉基因擬南芥的株高和種子產量均被顯著提高,且超表達DWF4的轉基因植株的二級分枝數[13,18]、鮮重和生物量[19]等均顯著增加。DWF4的生理功能極其廣泛,除了在生長發育中起作用,還能夠顯著提高植物的抗逆性。研究顯示,超表達DWF4可以增強煙草對非生物脅迫的抗性[19],提高馬鈴薯的耐鹽性[20]和芥菜的抗寒能力[21]。在生理學水平上,DWF4主要通過增加滲透調節物質的積累和提高抗氧化酶的活性增強植物對干旱、冷害和高溫的抗性[22-23],研究證明,DWF4通過調控相關抗氧化防御系統的活性,以保護作物抵御鹽害[24-27]。【本研究切入點】迄今為止,紫花苜蓿中油菜素內酯合成酶基因DWF4的功能研究鮮見報道,其調控紫花苜蓿抗逆性的機制還不是很清楚。【擬解決的關鍵問題】本研究從紫花苜蓿中克隆得到紫花苜蓿油菜素內酯合成酶基因MsDWF4,分析其序列特征,調查該基因對多種逆境與激素的響應,構建基因超表達紫花苜蓿材料,并開展耐鹽性研究,為探索DWF4調控紫花苜蓿抗逆性的分子機制奠定基礎。
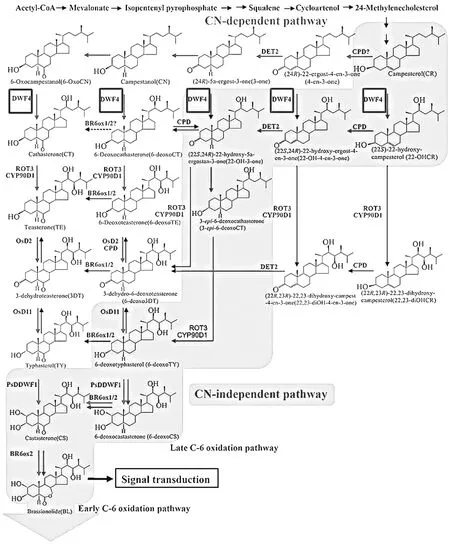
圖1 油菜素甾醇的生物合成途徑示意圖[10]Fig. 1 A simplified brassinosteroid biosynthetic pathway [10]
1 材料與方法
1.1 試驗材料
試驗于2018年6月至2019年6月在中國農業科學院北京畜牧獸醫研究所牧草資源實驗室進行。試驗所用植物材料為紫花苜蓿中苜1號(Medicago sativaL.cv. Zhongmu No.1),由中國農業科學院北京畜牧獸醫研究所楊青川研究員惠贈。
1.2 植物的培養
將紫花苜蓿種子在預先鋪好濾紙的培養皿中萌發,至種子露白后,移到1/2MS液體培養基中,在人工智能溫室中培養。光照:16 h光/8 h黑暗,溫度:25℃/23℃,光強 400 μmol·m-2·s-2。
1.3 組織表達特性
取紫花苜蓿根尖、花、嫩葉、莖、莖尖和子房等各組織,利用Eastep? Super總RNA提取試劑盒(北京華奧新創科技有限公司)提取各組織總RNA。利用Trans? Script All-in-One First-Strand cDNA Synthesis試劑盒(北京全式金生物技術有限公司)將 RNA反轉錄為cDNA。
1.4 逆境和激素處理
將紫花苜蓿中苜1號種子平鋪于濾紙上,發芽4 d后移到1/2 MS營養液中,水培兩周后,選取長勢一致的幼苗進行各項處理。將紫花苜蓿幼苗材料分別移到含有 15% PEG、150 mmol·L-1NaCl、1 μmol·L-1生長素(IAA)、1 μmol·L-1油菜素甾醇(BR)、1 mmol·L-1脫落酸(ABA)和 0.1 mmol·L-1的茉莉酸(JA)的 1/2MS液體培養基中處理;高溫處理時,將幼苗移入35℃培養箱;低溫處理時,將幼苗放在 4℃培養箱中。以上處理,分別在0、2、4、6、8、12、24和48 h取地上部和根部樣品,提取RNA,并反轉錄為cDNA。每個處理3次生物學重復。
1.5 DWF4的克隆
根據已有物種的DWF4序列信息,以 Noble Foundation(https://www.noble.org)網站上公布的紫花苜蓿基因序列為參照,設計cDNA全長引物ORF-F/R。以紫花苜蓿植株cDNA為模板,利用KOD-Plus高保真PCR酶(北京百靈克生物科技有限公司)進行PCR擴增。反應條件為10×Buffer for KOD-Plus 5 μL、2 mmol·L-1dNTP 5 μL、25 mmol·L-1MgSO42 μL、ORF-F 1.5 μL、ORF-R 1.5 μL、cDNA 2 μL、KOD-Plus 1 μL和 ddH2O 32 μL。PCR 反應程序為 94℃ 2 min;94℃ 15 s,56℃ 30 s,68℃ 2 min,共 32個循環;68℃ 5 min,4℃保存。將擴增后的PCR產物用AxyPrep DNA凝膠回收試劑盒(購自北京京哲永興生物技術責任有限公司)回收,與pEASY-T1載體(購自北京全式金生物技術有限公司)連接,將重組質粒轉化大腸桿菌DH5α感受態細胞,經分子檢測后,陽性克隆菌液送生工生物工程(上海)股份有限公司測序。
1.6 生物信息學分析
對獲得的序列進行生物信息學分析,生物信息學分析工具及用途見表1。

表1 本研究用到的生物信息學工具Table 1 Bioinformatics tools which were used in this research
1.7 MsDWF4的表達特異性分析
根據得到的紫花苜蓿DWF4的CDS序列設計實時熒光定量PCR特異引物qDF/R(表2),采用兩步法,用ABI7500型熒光定量PCR儀(美國應用生物系統公司,美國)進行qRT-PCR反應擴增。反應體系為×SYBR qPCR Mix(Low Rox)5 μL、qDF(10 μmol·L-1)0.2 μL、qDR(10 μmol·L-1)0.2 μL、ddH2O 1.6 μL 和 cDNA3 μL。反應條件為 95℃ 2 min;95℃ 15 s,60℃ 30 s,40個循環。根據得到的Ct值,將各處理0 h作為對照,用2-△△Ct法[28]計算MsDWF4的相對表達量。以MsActin2為內參基因,每個試驗3個樣品,每個樣品3次重復。
1.8 超表達載體的構建
利用 ClonExpressⅡOne Step 克隆試劑盒(北京京哲永興生物技術責任有限公司),一步克隆法構建MsDWF4超表達載體。具體為:設計含有KpnⅠ和XbaⅠ酶切位點的引物pMsDWF4F/R(下劃線部分表示酶切位點序列,表2)。用pMsDWF4-F/R引物擴增得到含有酶切位點的目的基因的開放閱讀框,限制性內切酶KpnⅠ和XbaⅠ雙酶切pCAMBIA1300植物表達載體質粒,將目的片段連接到載體上。在插入位點的上下游設計載體檢測引物MDF/R,利用PCR和測序鑒定陽性載體質粒。
1.9 農桿菌轉化及轉基因植株的檢測
將構建好的載體質粒,采用凍融法轉化入農桿菌菌株GV3101,然后用農桿菌介導法轉化紫花苜蓿[29]。用 CTAB法提取轉基因植株基因組DNA,以基因組DNA為模板,以載體質粒為陽性對照(對照1),以非轉基因紫花苜蓿基因組DNA和去離子水為陰性對照(對照2和對照3),MDF/R為上下游引物,進行PCR檢測,篩選轉基因陽性株系。
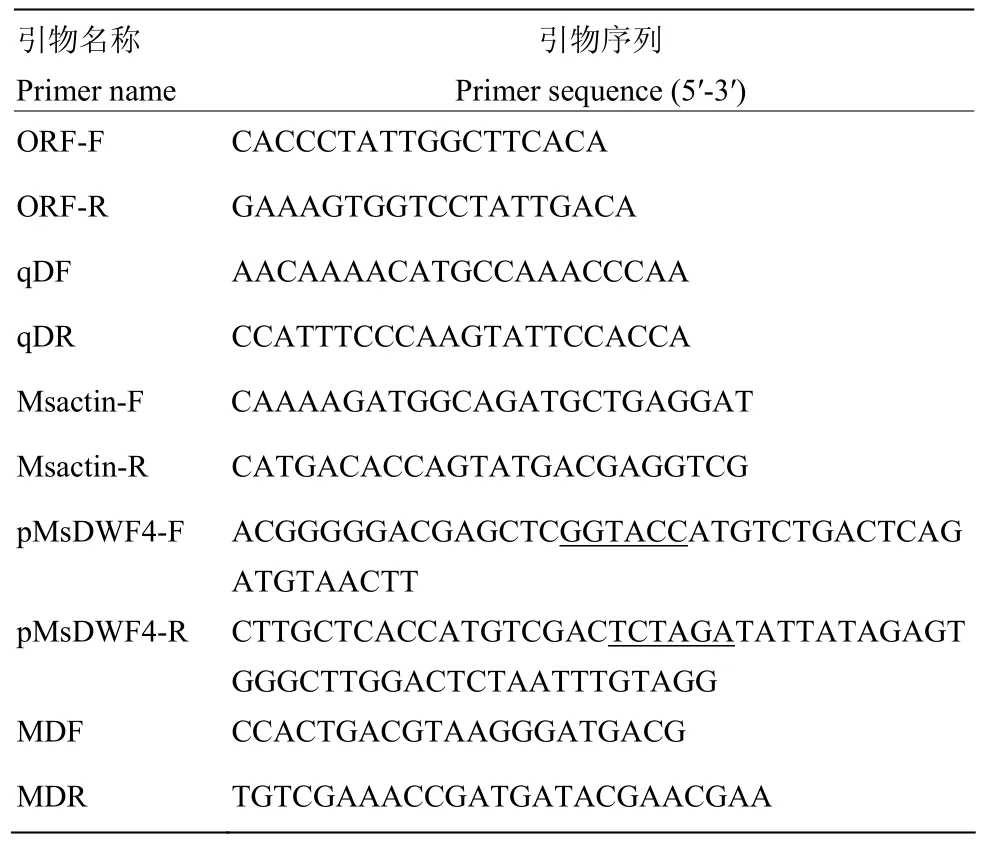
表2 本試驗所用引物Table 2 Primers used in this research
1.10 轉基因紫花苜蓿的耐鹽性分析
提取轉基因植株的RNA,逆轉錄為cDNA后,以qDF/R為引物,進行qRT-PCR檢測,篩選出表達量高的株系。將篩選出的株系進行扦插培養,控制生長條件一致,每隔4周修剪一次,直至植株狀態一致。12周后,用200 mmol·L-1NaCl處理轉基因和對照植株(扦插處理同時進行),在處理0、6和12 h分別取各個材料的地上部組織,檢測抗氧化酶過氧化氫酶(catalase,CAT,紫外分光光度法)、過氧化物酶(peroxidase,POD,可見分光光度法)和超氧化物歧化酶(superoxide dismutase,SOD,可見分光光度法)的活性,同時用qRT-PCR檢測各材料中MsDWF4的表達水平。
2 結果
2.1 MsDWF4序列與生物信息學分析
應用同源克隆技術從紫花苜蓿中擴增得到一個完整的開放閱讀框(ORF)(圖2)。該序列的CDS區長度為1 470 bp,編碼489個氨基酸。蛋白保守結構域的預測結果分析發現該基因編碼的蛋白在第 1—486位氨基酸殘基有一個特異性的保守結構域PLN02500(cytochrome P450 90B1),該蛋白屬于 P450超家族。
多序列比對結果表明,該序列編碼的蛋白質與其他物種的DWF4高度同源,同源性為61.0%—95.5%。其中與蒺藜苜蓿 DWF4(Medicago truncatula,MtDWF4)序列同源性高達95.5%(圖3)。說明該序列可能是一個DWF4,將其命名為MsDWF4。
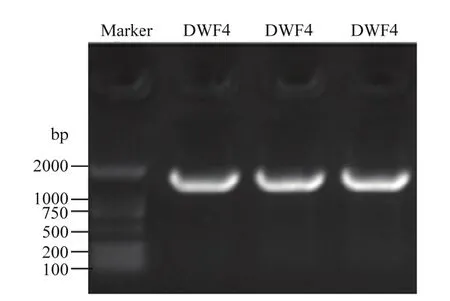
圖2 MsDWF4的擴增結果Fig. 2 Amplification results of MsDWF4

圖3 不同物種DWF4氨基酸序列比對結果Fig. 3 Amino acid sequence alignment results of DWF4 from different species
將 MsDWF4與其他物種的 DWF4蛋白,利用MEGA X構建系統發育樹,結果表明,紫花苜蓿與豆科物種親緣關系最近;與殼斗科、茜草科等的關系較遠;而與玉米和普通小麥等禾本科物種的親緣關系最遠(圖4)。
蛋白質理化性質分析結果可得出,MsDWF4蛋白分子量為55.69 kD,理論等電點(pI)為9.00。跨膜結構域的預測結果(電子附圖1)顯示,在MsDWF4的N端有1個跨膜螺旋(trans-membrane helix,TMHs)結構,位于第7—25位氨基酸;MsDWF4整條鏈中親水性氨基酸殘基多于疏水性氨基酸殘基,表明MsDWF4可能為一個跨膜親水蛋白(電子附圖2)。
通過Swiss-model對MsDWF4進行三級結構同源建模,構建出MsDWF4的同源模型6a17.1.A(電子附圖3)。6a17.1.A為擬南芥DWF4的三級結構。全局模型質量估計(global model quality estimation,GMQE)值為0.81,MsDWF4與模板相似性為76.29%,可見紫花苜蓿DWF4與擬南芥DWF4的蛋白三級結構高度相似,兩者可能具有相似的蛋白功能。
激酶磷酸化修飾位點預測結果(圖 5)發現MsDWF4蛋白有32個絲氨酸(Serine),18個位點較為活躍;有21個蘇氨酸(Threonine),12個位點較為活躍;有14個酪氨酸(Tyrosine),4個位點較為活躍。
2.2 紫花苜蓿DWF4表達特性
2.2.1 紫花苜蓿DWF4組織表達特性分析MsDWF4組織特性分析結果(圖6)表明,MsDWF4在根尖組織中的相對表達量最高,在花、嫩葉、莖尖和子房等組織中的表達量次之,其次是子房中的表達量,在成熟的莖中表達豐度最低。
2.2.2MsDWF4表達對逆境和外源激素的響應 為了明確MsDWF4對多種非生物逆境(35℃、4℃、15% PEG、150 mmol·L-1NaCl)和外源激素(1 μmol·L-1BR、1 μmol·L-1IAA、1 mmol·L-1ABA 和 0.1 mmol·L-1JA)的響應模式,利用qRT-PCR技術對MsDWF4在不同處理條件下的表達水平進行分析(圖7和圖8)。
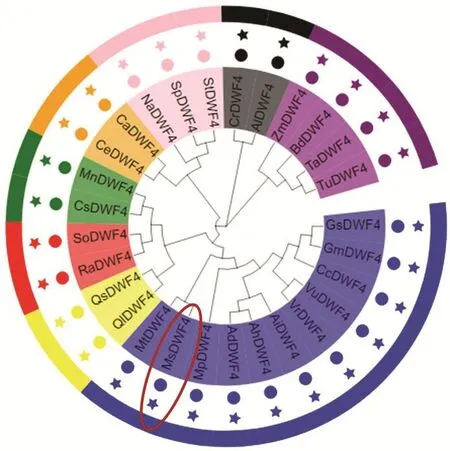
圖4 不同物種DWF4系統發育樹分析Fig. 4 Phylogenetic tree analysis of DWF4 in different species
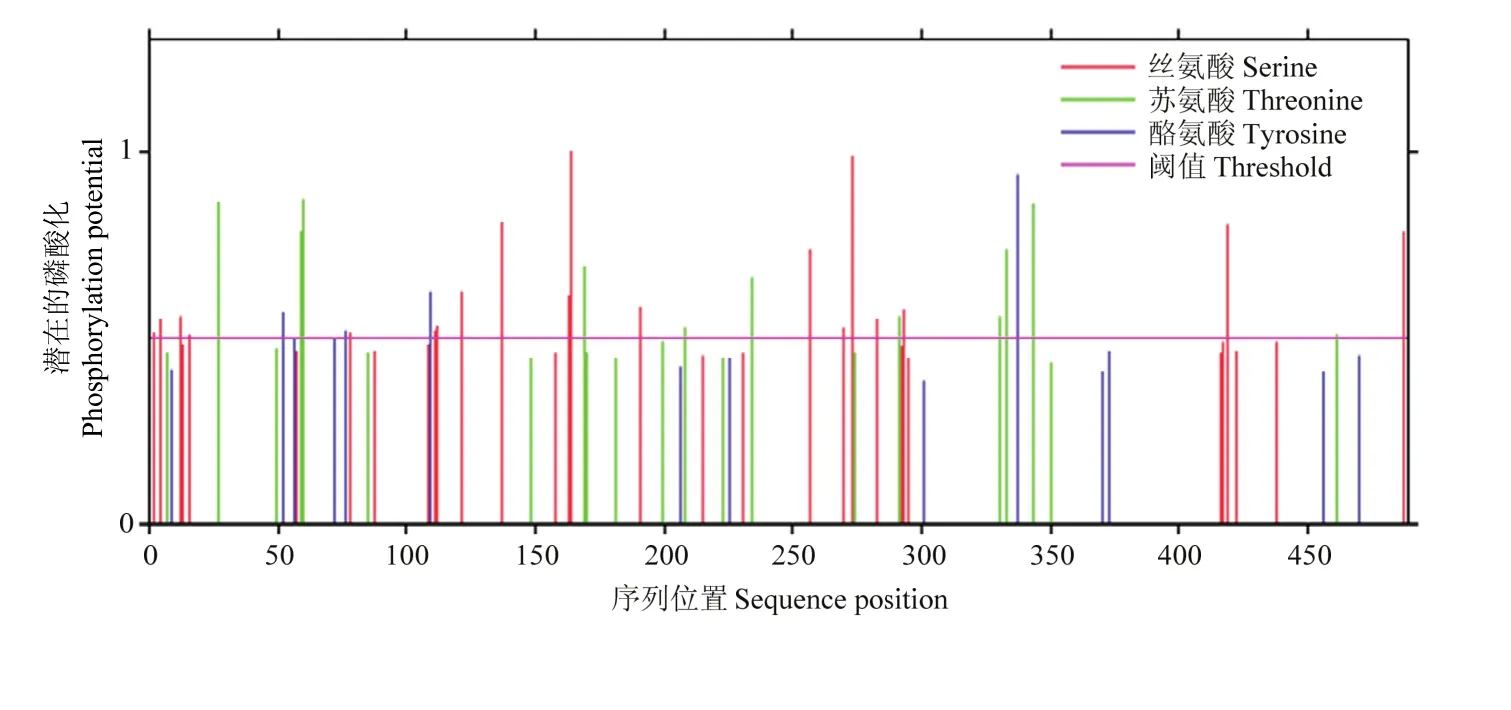
圖5 MsDWF4激酶磷酸化修飾位點的預測Fig. 5 Prediction of kinase-specific phosphorylation sites of MsDWF4
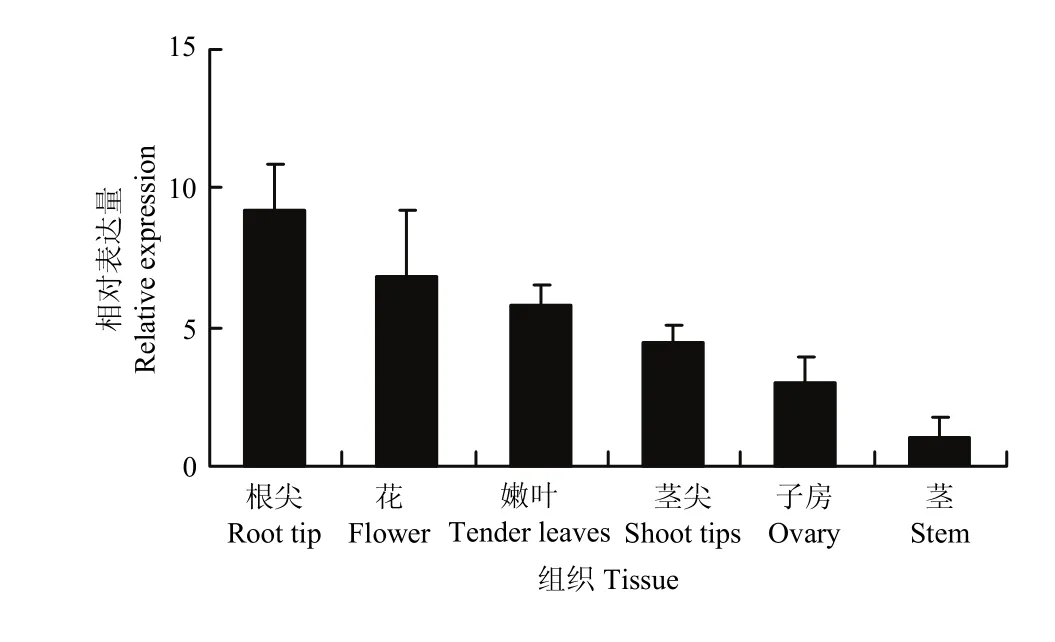
圖6 MsDWF4組織特異性表達模式Fig. 6 Tissue-specific expression pattern of MsDWF4
結果顯示,NaCl顯著誘導基因在地上部和根部的表達,MsDWF4對鹽脅迫的響應迅速,在處理2 h后地上部(圖 7-A)的表達就達到極顯著水平,然后在處理6 h后表達快速下降;根部(圖7-B)的基因誘導表達水平整體上低于地上部。15% PEG處理下,MsDWF4在地上部(圖7-C)被快速誘導,處理4 h表達水平達到峰值,隨后表達豐度下降;在根部(圖7-D)的表達呈先降低后升高的趨勢,并在處理 12 h時達到峰值。35℃處理條件下,MsDWF4的相對表達量總體呈上升趨勢,地上部(圖7-E)和根(圖7-F)中MsDWF4的表達量分別在處理6和48 h時達到峰值。低溫(4℃)脅迫同樣誘導MsDWF4表達顯著上調,處理6 h時地上部(圖7-G)和根部(圖7-H)MsDWF4的相對表達量達到最高值,分別為對照的7.7倍和6.5倍。
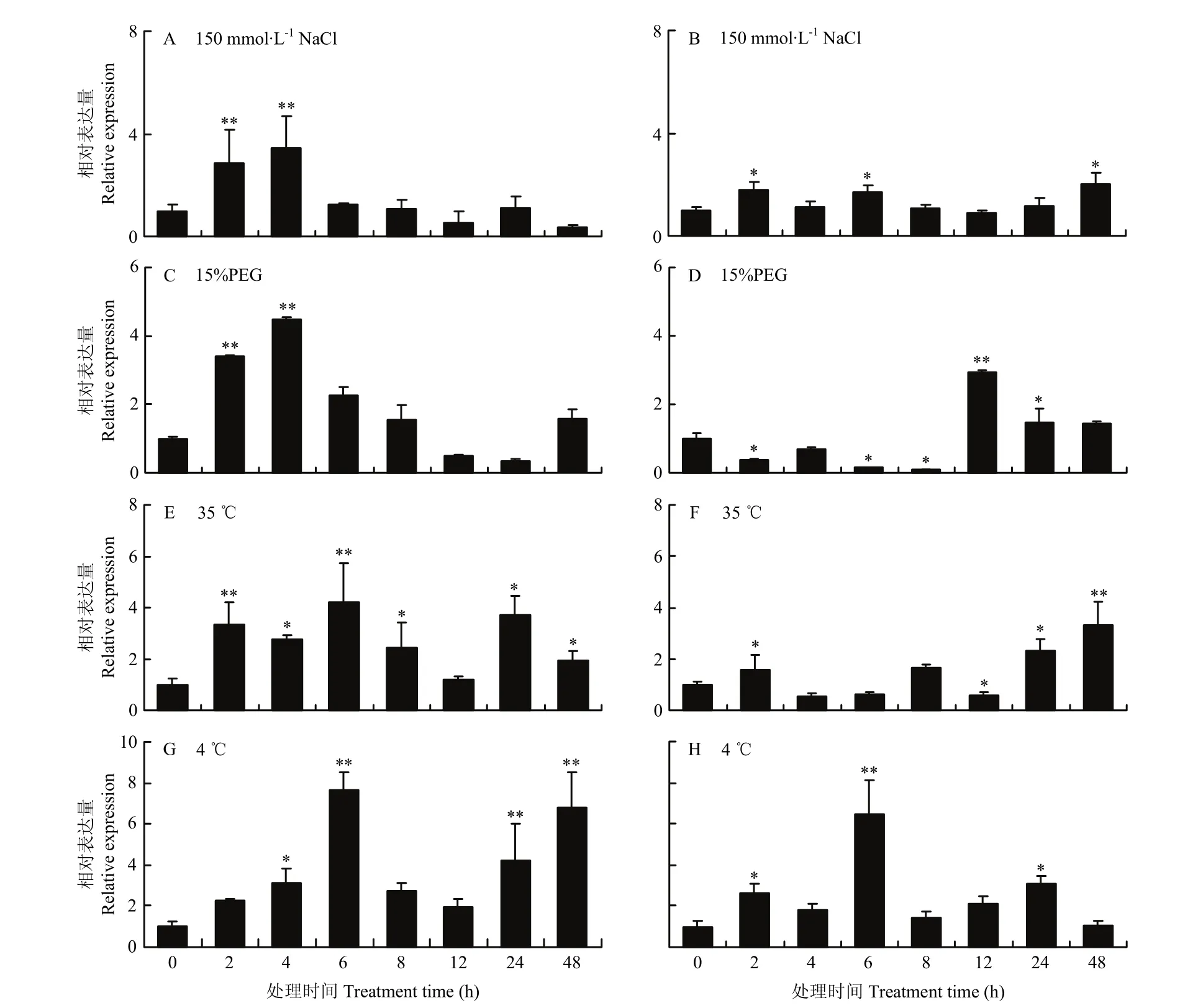
圖7 不同逆境處理條件下MsDWF4的相對表達量Fig. 7 Relative expression of MsDWF4 gene under different stress treatments
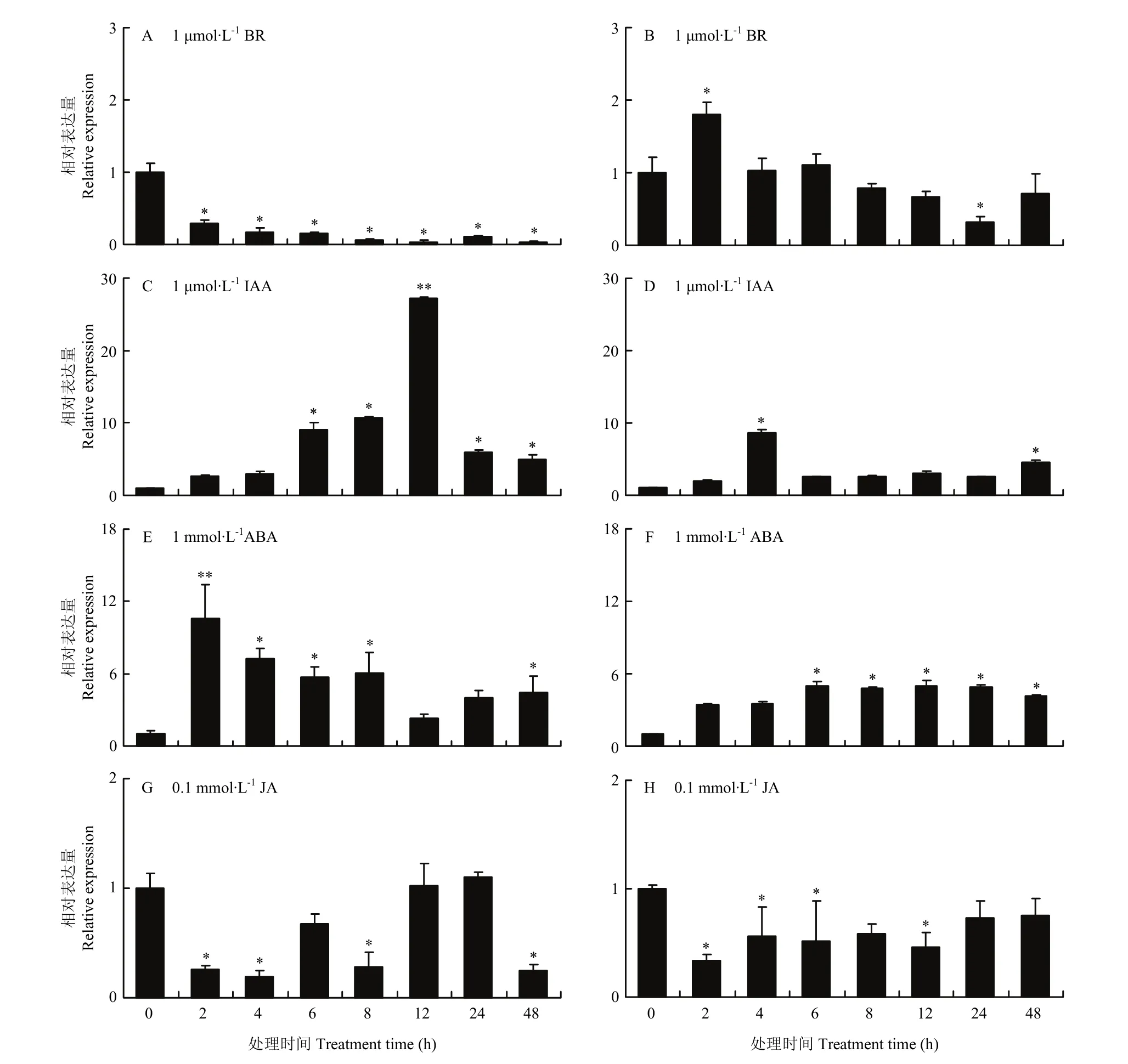
圖8 不同激素處理下MsDWF4的相對表達量Fig. 8 Relative expression of MsDWF4 under different hormone treatments
MsDWF4對多種激素處理均有響應。外源油菜素內酯處理下,MsDWF4在地上部(圖8-A)和根(圖8-B)中的表達被抑制,且隨著BR處理時間的延長,基因被抑制的程度不斷增強。IAA處理下,植株中MsDWF4的表達被誘導且其表達量在處理12 h(地上部)(圖8-C)和4 h(根部)(圖8-D)達到峰值,分別為對照的10.78倍和8.69倍。ABA誘導MsDWF4表達上調,地上部(圖8-E)和根部(圖8-F)MsDWF4的表達量在ABA處理2和6 h時達到最高,分別為對照的6.03倍和5.01倍。JA抑制MsDWF4在植株中的表達,MsDWF4的表達在處理4 h(地上部)(圖8-G)和2 h(根部)(圖8-H)最低,為對照的19.23%和33.21%。
2.3 超表達MsDWF4轉基因紫花苜蓿的檢測
通過遺傳轉化,共獲得11個超表達MsDWF4的轉基因紫花苜蓿株系,并對其進行PCR檢測,結果表明,株系2、株系6、株系7、株系8、株系10與株系11的PCR擴增片段長度與目標條帶一致(圖9),表明這些株系為陽性株系,超表達載體已經成功轉化到紫花苜蓿中。
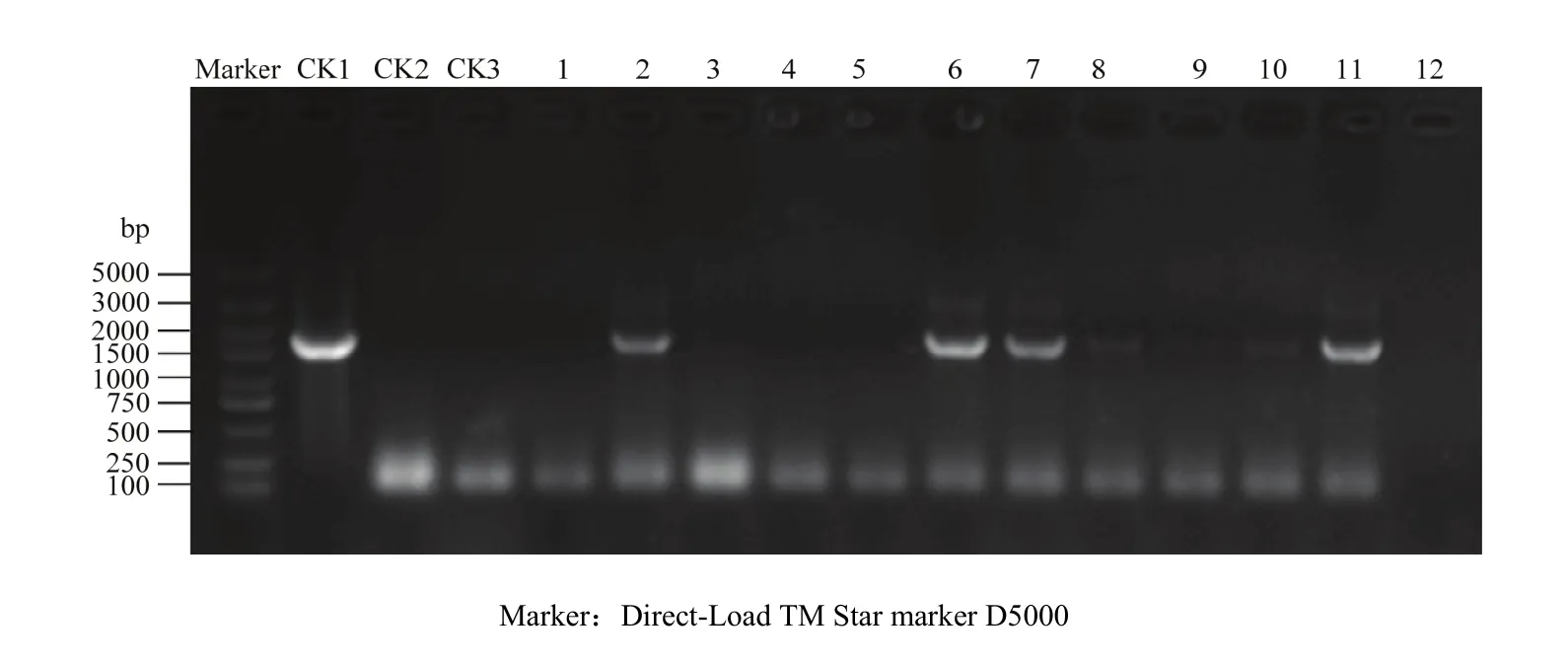
圖9 轉基因植株檢測Fig. 9 Identification of positive transgenic lines
利用qRT-PCR檢測這6個株系中MsDWF4的表達情況,結果顯示,株系6和株系7表達量較高(圖10),命名為L6和L7。
2.4 轉基因紫花苜蓿的耐鹽性檢測
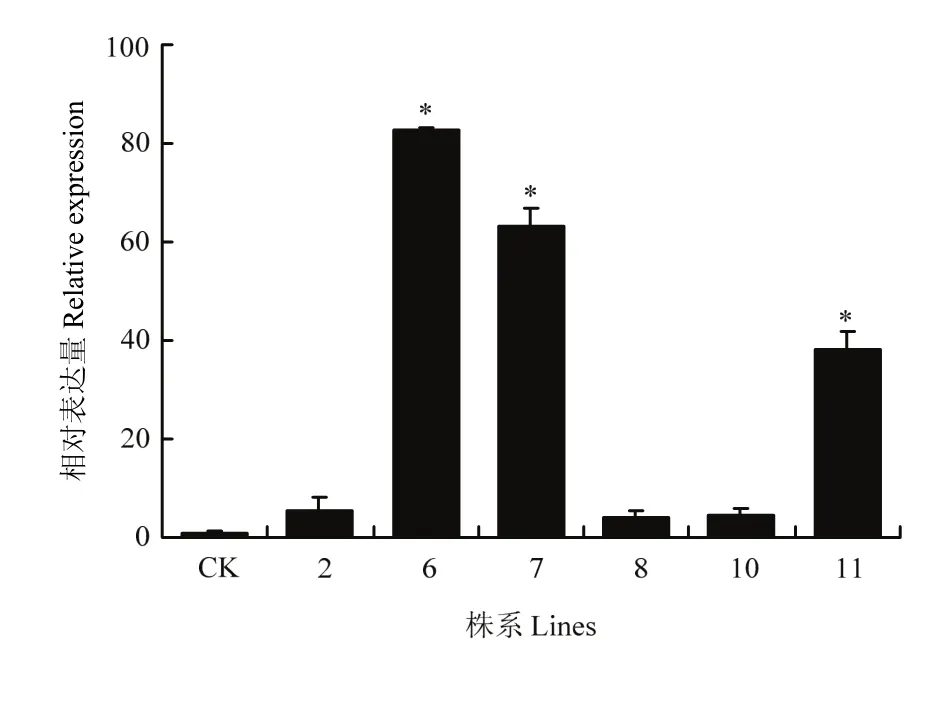
圖10 超表達MsDWF4株系的qRT-PCR檢測Fig. 10 Expression level analysis of MsDWF4 gene in overexpression lines by using qRT-PCR
為檢測轉基因紫花苜蓿的耐鹽性,分析了高鹽(200 mmol·L-1NaCl)處理下轉基因紫花苜蓿株系(L6和L7)及對照株系中MsDWF4的表達量和3種抗氧化酶(POD、CAT和SOD)的活性。結果顯示,轉MsDWF4和對照株系中MsDWF4的表達均被鹽脅迫顯著誘導,而且轉基因株系的誘導水平顯著高于對照植株。在正常條件下,轉基因株系的 CAT、POD和SOD酶活性均顯著高于野生型;受高鹽脅迫,轉基因株系和對照株系中3種酶活性均顯著增強,但2個轉基因株系的抗氧化酶活性顯著高于對照,增加速度更快。在鹽處理12 h后,CAT和POD活性在轉基因材料和對照中均下降,CAT活性仍高于對照植株。而SOD的活性在處理12 h仍然呈上升趨勢,并且顯著高于對照植株。
3 討論
DWF4是油菜素內酯合成的限速酶基因,已在多種植物中得到分離鑒定,但紫花苜蓿中DWF4的研究還未見報道。本研究利用同源克隆的方法分離得到紫花苜蓿油菜素內酯合成酶基因MsDWF4。對MsDWF4蛋白特性進行分析得知 MsDWF4為不穩定的跨膜親水蛋白,其不穩定性可能為后續蛋白質的功能研究增加難度[30]。MsDWF4蛋白的三級結構的預測分析表明,DWF4蛋白的三級立體結構形成一個中空的活性囊。研究表明,DWF4蛋白的活性囊結構是其與配合物的結合位置,活性囊的形狀和體積會隨著配合物種類的變化而變化[30],DWF4的特異性抑制劑BRZ(brassinazole),與DWF4結合后,DWF4的空間構象發生改變,抑制BRs合成過程中的C-22位的羥基化反應,降低內源BRs水平[31-34]。因此,紫花苜蓿的MsDWF4蛋白可能也是通過這樣的方式進行BR生物合成調控的。這些結構和理化性質的分析有利于加深對MsDWF4蛋白的了解,并且為之后MsDWF4的功能研究提供理論基礎。
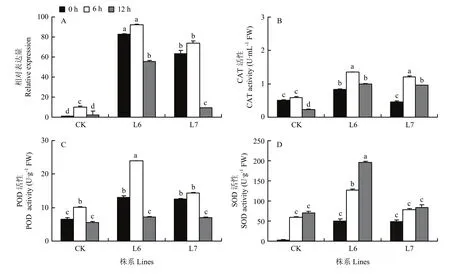
圖11 200 mmol·L-1 NaCl處理條件下MsDWF4的表達及抗氧化酶的活性Fig. 11 Expression level of MsDWF4 and antioxidant enzyme activity analysis in CK and transgenic lines under 200 mmol·L-1 NaCl treatment
蛋白質磷酸化是一種重要的翻譯后修飾[35],主要集中在肽鏈中的酪氨酸、絲氨酸、蘇氨酸殘基上,磷酸化后,這些氨基酸帶上電荷,導致蛋白質的結構發生變化,進一步引起蛋白質的活性發生變化[36],磷酸化修飾與激素反應,信號轉導,細胞周期及生長發育等諸多的生物學問題密切相關[36]。本研究預測了MsDWF4的磷酸化位點以及活躍的磷酸化位點,為后期開展MsDWF4功能的研究奠定了基礎。
通過對MsDWF4表達模式的分析,發現MsDWF4主要在根尖、莖尖等生長旺盛的組織器官中表達,這與前人研究相似[16,37]。暗示MsDWF4可能與其他物種的DWF4一樣,參與了紫花苜蓿的生長發育過程,對植株生長具有促進作用。具體功能還需要進一步的驗證。
多項研究顯示,DWF4參與了植物抗逆性的調控。SAHNI等[38]通過對植物的生長狀態和應激反應的表型觀測發現,與野生型相比,超表達擬南芥DWF4的轉基因植物對脫水和熱激的耐受性明顯增加。低溫環境下,轉DWF4的植株相對電導率明顯低于野生型,而脯氨酸積累量則明顯高于對照野生型[21]。擬南芥AtDWF4過表達的幼苗相較于野生型幼苗低溫耐受性明顯提高[39],即超表達DWF4能夠提高植株的抗寒性。本研究對MsDWF4在高溫、低溫和干旱脅迫下的表達進行了分析。結果顯示,NaCl、15% PEG、35℃和4℃逆境處理下,MsDWF4的表達均可被不同程度的誘導,說明MsDWF4很可能也參與了這些逆境脅迫的響應。
自然環境中,當植物在生長發育過程中長時間受到非生物脅迫(如干旱、高鹽、高溫和低溫等)時,植物細胞感知逆境信號并轉換為胞內信號,進而通過調控相關基因表達和蛋白的合成,改變其細胞內部的生理代謝,啟動各種防護機制以抵御和適應逆境脅迫[40]。其中抗氧化酶系統就是一個非常重要的防御機制。當植物遭受逆境脅迫時,細胞通過增加相關抗氧化防護酶(CAT、POD和SOD等)活性的和一些非酶類的小分子物質(還原性谷胱甘肽、抗壞血酸鹽、生育酚等)的含量來清除逆境脅迫下細胞內積累的大量的活性氧(reactive oxygen species,ROS)以降低ROS對細胞器和各種生物大分子的破壞,從而維持細胞內環境的穩態及各種代謝活動的正常進行[41-43]。研究發現,鹽脅迫下超表達DWF4的馬鈴薯植株中,滲透調節物質(如脯氨酸、可溶性蛋白和可溶性糖等)的含量和抗氧化酶(SOD、POD和APX等)的活性均高于對照組,滲透調節物質和抗氧化酶共同減輕植物鹽脅迫傷害從而來提高馬鈴薯的抗鹽性[13,20,24-27]。PeDWF4可促使鹽脅迫下的植物細胞大量表達DWF4進而增加BR含量,從而提高轉基因材料的抗鹽性[44]。本研究中,鹽脅迫下,MsDWF4的表達被顯著誘導,且高鹽脅迫下超表達MsDWF4的紫花苜蓿植株中MsDWF4的表達量和SOD、POD和CAT這些抗氧化酶的活性都較對照高,這些抗氧化酶可清除鹽脅迫下植物體內增加的ROS,減輕紫花苜蓿因鹽脅迫造成的傷害,從而使轉基因植株具有更高的耐鹽性。說明MsDWF4通過調節植物的抗氧化酶系統,正向調控了紫花苜蓿的耐鹽性。
ABA被稱為“逆境激素”[45],逆境脅迫條件下植株體內的脫落酸大量積累,并參與逆境脅迫應答。已有研究發現,ABA處理后玉米DWF4的相對表達量升高[46]。本研究中,MsDWF4受多種逆境脅迫的誘導表達上調,因此我們分析了ABA激素對MsDWF4表達的影響。結果顯示,無論是在地上部還是根部,該基因表達都受ABA誘導上調。暗示MsDWF4對逆境脅迫的響應可能是依賴于或部分依賴于ABA途徑的。
油菜素內酯(BRs)的動態平衡是高等植物正常生長發育的基礎,植物內源油菜素內酯積累增加會導致油菜素內酯生物合成降低以及降解增加。DWF4是BR生物合成的第一限速酶基因,被認為是平衡BR濃度水平的目的調節基因[13]。外施油菜素內酯合成抑制劑Brz(brassinazole)可以增加DWF表達,而用表油菜素內酯(brassinolide,BL)處理植物,會使特異參與油菜素內酯生物合成途徑的基因DWF4和BR6ox1等的表達降低,內源性BL含量增加時BR特異性生物合成基因,DWF4、CPD、BR6ox1和ROT3等基因的表達下調,而 BR缺陷體中這些基因的表達上調[47-49]。本研究中用1 μmol·L-1BR處理紫花苜蓿后,MsDWF4的表達被顯著抑制。說明在紫花苜蓿中,外源BR對DWF4起到抑制作用,以維持植物體內油菜素內酯的動態平衡。
除了 ABA,BR與其他激素也存在互作。REN等[50]通過對與JA信號轉導相關基因的相對表達量的檢測發現,當外界條件變化觸發JA信號時,JA通過下調DWF4的表達來破壞BRs信號,從而實現植物的最佳生長。本研究中,0.1 μmol·L-1JA處理下,根部和地上部MsDWF4的表達均被抑制,暗示 JA是對MsDWF4進行負調控從而實現對紫花苜蓿生長的調控。KIM等[51]、CHUNG等[52]和YOSHIMITSU等[53]通過對啟動子的分析和內源性BRs的測定證明生長素對BRs生物合成有刺激作用且直接調控BR的生物合成。本研究中用低濃度的生長素(1 μmol·L-1)處理紫花苜蓿后,根部和地上部中MsDWF4的表達均被顯著上調。說明在紫花苜蓿中,生長素對BR的生物合成同樣起到積極的促進作用。
4 結論
獲得紫花苜蓿油菜素內酯合成的關鍵酶基因MsDWF4,該基因編碼489個氨基酸,為親水性跨膜蛋白,屬于P450超家族。MsDWF4主要在生長活躍的組織和器官中表達,可能參與紫花苜蓿某些生長發育方面的調控,并對多種非生物逆境發生響應。MsDWF4正向調控紫花苜蓿的耐鹽性。

