用t-BAMBP從鋰云母沉鋰廢液中萃取堿金屬
汪金良,季柏仁
(1.江西理工大學 材料冶金化學學部,江西 贛州 341000;2.江西省閃速綠色開發與循環利用重點實驗室,江西 贛州 341000)
銣和銫在許多領域有著重要用途[1-5]。當前,主要從花崗偉晶巖中提取銣和銫,主要工業礦物有鋰云母和銫榴石。江西宜春鋰云母礦中含有豐富的銣和銫[6-7],這些銣和銫在提取鋰過程中被富集到沉鋰廢液中。
從溶液中提取銣、銫,主要有沉淀法、離子交換法和溶劑萃取法。沉淀法較為成熟,主要采用四苯硼鈉法[8]、亞鐵氰化鋅法[9]等進行復鹽沉淀,但流程冗長、分離效果差、產品純度不高、收率低、生產成本高。離子交換法用的較少,因為離子交換劑的交換容量小、溶液濃度低,且分離效果相對較差[10-11]。溶劑萃取法研究較多,應用較廣[12-13],其中,酚醇類4-叔丁基-2-(α-甲芐基)酚(t-BAMBP)萃取劑,具有選擇性強、反應迅速、易于反萃取、毒性小、價格較便宜等優點,得到較為廣泛認可[14-16]。
用t-BAMBP從溶液中萃取銣、銫的研究已有相關報道,但從高鉀鈉溶液中分離萃取銣和銫的研究尚未見有報道。試驗研究了用t-BAMBP+磺化煤油體系從鋰云母沉鋰廢液中萃取分離銣和銫,為實現鋰云母資源的綜合利用提供參考信息。
1 試驗部分
1.1 試驗原料與試劑
試驗所用沉鋰廢液取自宜春某碳酸鋰企業,為鋰云母經硫酸鹽焙燒—浸出—凈化—沉淀等工序提取碳酸鋰后的沉鋰廢液,pH=7.8,主要成分見表1。

表1 鋰云母沉鋰廢液的主要成分 g/L
試驗所用試劑:t-BAMBP,磺化煤油,氫氧化鈉,鹽酸,均為分析純。試驗用水為重慶阿修羅公司AXLB1020-1型純水機制備的去離子水。
1.2 試驗原理與方法
堿性條件下,t-BAMBP酚羥基上的酸性質子H+容易發生解離,解離后的質子H+與廢液中的堿金屬離子(以M+表示)發生交換反應,生成疏水性極強的酚鹽而進入有機相。反應式為

t-BAMBP為黏稠狀有機物,可用磺化煤油稀釋[17]。
t-BAMBP萃取劑對堿金屬離子的萃取能力隨堿金屬離子半徑增大而遞增,即Cs+>Rb+>K+>Na+>Li+[18]。
用氫氧化鈉溶液將含堿金屬元素廢液調至一定堿度。準確移取一定體積廢液和有機相至125 mL梨形分液漏斗中,并置于恒溫振蕩器(SHZ-88型,常州金壇市萬華實驗儀器廠)中,控制一定溫度,反應一定時間后,靜置、分層;定量移取一定萃余液,用原子吸收光譜儀(TAS990型,北京普析通用儀器有限責任公司)測定堿金屬質量濃度,用差量法計算有機相中對應堿金屬質量濃度,計算相應萃取率、分配比D和分離系數β。
2 試驗結果與討論
2.1 萃取劑質量濃度對堿金屬萃取率的影響
在pH=14.0、萃取相比Vo/Va=1.0、振蕩速度200r/min、溫度25 ℃、萃取時間5.0 min條件下,萃取劑t-BAMBP質量濃度對堿金屬萃取率的影響試驗結果如圖1所示。

—■—Rb+;—●—Cs+;—▲—Li+;—▼—Na+;—◆—K+。圖1 t-BAMBP質量濃度對堿金屬萃取率的影響
由圖1看出:t-BAMBP質量濃度對堿金屬萃取率影響較大,隨t-BAMBP質量濃度升高,各堿金屬萃取率均升高;t-BAMBP對堿金屬的萃取順序為Cs+>Rb+>K+>Li+>Na+。Na+半徑比Li+的大,Na+萃取率本應高于Li+萃取率,但因體系中Na+質量濃度(90.03 g/L)遠高于Li+質量濃度(4.75 g/L),從而使Li+萃取率反而高于Na+萃取率;t-BAMBP質量濃度提高到0.5 g/mL時,Cs+萃取率達98.43%,Rb+萃取率達63.14%。繼續升高t-BAMBP質量濃度,Rb+萃取率提高幅度不大,而其他元素萃取率仍在提高,尤其是K+萃取率升高明顯,這將造成后續銣、銫分離困難;另外,萃取劑質量濃度太高會降低萃取體系的流動性,造成分層困難。綜合考慮,確定萃取劑質量濃度以0.5 g/mL為宜。
2.2 廢液堿度對堿金屬萃取率的影響
在萃取劑質量濃度0.5 g/mL、萃取相比Vo/Va=1.0、振蕩速度200 r/min、溫度為25 ℃、萃取時間5.0 min條件下,廢液堿度對堿金屬萃取率的影響試驗結果如圖2所示。
由圖2看出:堿金屬萃取率與廢液堿度(pH)呈正相關,pH越高,金屬萃取率越大,但pH過高,兩相乳化現象加重,從而導致分層時間大大延長;當pH提高到14.0時,Cs+萃取率達98.43%,Rb+萃取率達63.14%;繼續升高廢液pH,Cs+和Rb+萃取率均提高不明顯,而其他堿金屬的萃取率都有所提高。t-BAMBP酚羥基上的酸性質子H+在堿性條件下易發生解離,解離后的質子H+與溶液中的堿金屬離子發生交換反應,生成疏水性極強的酚鹽而進入有機相,而堿金屬離子與H+之間的交換能力不同,故而可實現元素間的分離。綜合考慮,確定廢液pH以14.0為好。
2.3 萃取相比對堿金屬萃取率的影響
在萃取劑質量濃度0.5 g/mL、廢液pH=14.0、振蕩速度200 r/min、溫度25 ℃、萃取時間5.0 min 條件下,萃取相比Vo/Va對堿金屬萃取率的影響試驗結果如圖3所示。

—■—Rb+;—●—Cs+;—▲—Li+;—▼—Na+;—◆—K+。圖3 萃取相比對堿金屬萃取率的影響
由圖3看出,堿金屬萃取率與Vo/Va正相關。萃取劑對堿金屬有一定飽和容量,即相比Vo/Va越大,萃取的堿金屬越多;隨Vo/Va增大,各堿金屬萃取率均有所提高,Vo/Va增至1.0時,Cs+萃取率為98.43%,Rb+萃取率為63.14%;繼續增大Vo/Va,Rb+和Cs+萃取率雖略有升高,但生產成本也會相應增加。綜合考慮,確定相比Vo/Va以1.0為好。
2.4 振蕩速度對堿金屬萃取率的影響
在萃取劑質量濃度5 g/mL、廢液pH=14.0、 萃取相比Vo/Va=1.0、溫度25 ℃、萃取時間5.0 min條件下,振蕩速度對堿金屬萃取率的影響試驗結果如圖4所示。

—■—Rb+;—●—Cs+;—▲—Li+;—▼—Na+;—◆—K+。圖4 振蕩速度對堿金屬萃取率的影響
由圖4看出,振蕩速度對堿金屬萃取率影響不大。試驗中發現,振蕩速度較高時,兩相分相時間大大延長,且出現輕微乳化現象。綜合考慮,確定振蕩速度以200 r/min為宜。
2.5 溫度對堿金屬萃取率的影響
在萃取劑質量濃度0.5 g/mL、廢液pH=14.0、萃取相比Vo/Va=1.0、萃取時間5.0 min條件下,溫度對堿金屬萃取率的影響試驗結果如圖5所示。

—■—Rb+;—●—Cs+;—▲—Li+;—▼—Na+;—◆—K+。圖5 溫度對堿金屬萃取率的影響
由圖5看出,溫度對堿金屬萃取率影響不大,隨溫度升高,堿金屬萃取率略有下降,但變化不大。這是由于t-BAMBP萃取堿金屬的過程放熱,溫度升高不利于萃取。綜合考慮,確定在常溫(25 ℃)下萃取最佳。
2.6 萃取時間對堿金屬萃取率的影響
在萃取劑質量濃度0.5 g/mL、廢液pH=14.0、萃取相比Vo/Va=1.0、振蕩速度200 r/min、溫度25 ℃條件下,萃取時間對堿金屬萃取率的影響試驗結果如圖6所示。

—■—Rb+;—●—Cs+;—▲—Li+;—▼—Na+;—◆—K+。圖6 萃取時間對堿金屬萃取率的影響
由圖6看出,t-BAMBP萃取堿金屬離子的反應速度很快,5.0 min即達萃取平衡。
2.7 優化條件下的萃取
根據單因素試驗結果,用t-BAMBP+磺化煤油體系從沉鋰廢液中萃取堿金屬。試驗條件:t-BAMBP質量濃度0.5 g/mL,廢液pH=14.0、萃取相比Vo/Va=1.0、振蕩速度200 r/min,溫度25 ℃, 萃取時間5.0 min。試驗結果如圖7、8所示,萃取后水相和有機相化學組成見表2,pH約為14.0。

圖7 優化條件下的堿金屬的分配比
由圖7看出:Cs+的分配比最大,其次是Rb+,均大于1;而Li+、Na+、K+的分配比均小于1。這表明,采用t-BAMBP+磺化煤油萃取體系可有效分離廢液中的Cs+、Rb+與K+、Li+、Na+。
由圖8、表2看出:堿金屬離子之間的分離系數大小為β(Cs+/Rb+)?β(Rb+/Na+)>β(Rb+/Li+)>β(Rb+/K+)>β(K+/Li+)>β(Li+/Na+)>1。其中β(Cs+/Rb+)最大,這表明:采用t-BAMBP+磺化煤油體系進行萃取,可將Rb+和Cs+有效分離;萃取后,廢液中的Cs+幾乎全部進入有機相,Rb+大部分進入有機相,而Li+、Na+和K+大部分留在水相。但由于廢液中Na+、K+含量高,雖只有少量進入有機相,但其在有機相中的含量仍遠高于Rb+和Cs+。因此,須經過多級逆流萃取進一步分離。
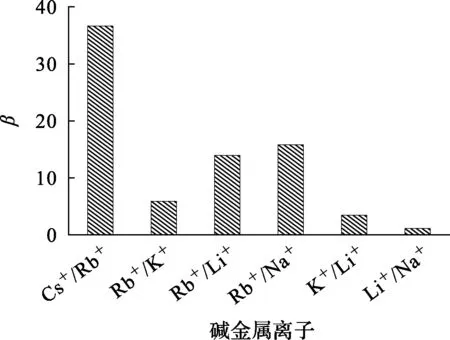
圖8 優化條件下堿金屬之間的分離系數

表2 單級萃取平衡后水相和有機相的化學組成
3 結論
針對高鉀鈉鋰云母沉鋰廢液,用t-BAMBP+磺化煤油體系進行萃取,可以將溶液中Cs+、Rb+與K+、Li+、Na+分離;t-BAMBP萃取堿金屬的順序為Cs+>Rb+>K+>Li+>Na+,堿金屬間的分離系數大小為β(Cs+/Rb+)?β(Rb+/Na+)>β(Rb+/Li+)>β(Rb+/K+)>β(K+/Li+)>β(Li+/Na+)>1,該體系對Cs+、Rb+有很強的萃取分離能力。
在萃取劑質量濃度0.5 g/mL、廢液pH=14.0、 萃取相比Vo/Va=1.0、振蕩速度200 r/min、溫度20 ℃、萃取時間5.0 min最佳條件下,Cs+、Rb+、Li+、Na+和K+萃取率分別為98.43%、63.14%、 7.77%、6.89%和22.58%。
溶液中存在大量K+和Na+,對Rb+、Cs+的分離有較大影響,應采取多級逆流萃取方式提高Rb+、Cs+的富集度和分離程度。

