急性淋巴細胞白血病患兒MTHFR C677T基因多態性與大劑量甲氨蝶呤治療后肝功能異常的相關性
劉林娜,李濤,葛寒宇,陳占國,余堅,鄭曉群
(溫州醫科大學附屬第二醫院育英兒童醫院 醫學檢驗中心,浙江 溫州 325027)
急性淋巴細胞白血病(acute lymphoblastic leukaemia,ALL)是來源于B/T系淋巴細胞的惡性腫瘤,細胞分化異常而停滯于早期階段,導致發熱、貧血、中性粒細胞減少、血小板減少等臨床表現及實驗室檢查異常,尤其當異常增殖的腫瘤細胞浸潤髓外組織時可致中樞神經系統白血病或睪丸白血病等[1]。甲氨蝶呤(methotrexate,MTX)屬于抗葉酸類的抗腫瘤藥,通過競爭性抑制細胞內二氫葉酸還原酶的活性,從而抑制腫瘤細胞的異常增殖[2]。大劑量甲氨蝶呤(high-dose methotrexate,HD-MTX)可通過血腦和血睪屏障,是ALL患兒鞏固治療階段的主要化療藥物,對預后有十分重要的意義,但HD-MTX誘導的不良反應常常導致化療的中斷[3]。亞甲基四氫葉酸還原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)基因位于染色體1p36.3,編碼葉酸代謝通路中的限速酶,使5,10-亞甲基四氫葉酸轉化為具有生物學活性的5-甲基四氫葉酸,也是MTX發揮藥理作用的關鍵酶之一[4]。C677T是目前國內外研究較多的位點之一,突變后胸腺嘧啶(T)替代了第677位堿基胞嘧啶(C),使編碼的丙氨酸變成了纈氨酸,而使酶活性發生變化,并且已有研究報道該變化與多種疾病相關,其中包括對ALL化療的不良反應[5], 但此結論尚存爭議。因此,本研究將探討ALL患兒MTHFR C677T基因多態性與HD-MTX治療后肝功能異常的相關性,以及對肝功能各指標和功能的影響,為患者的個體化用藥提供可靠的參考依據。
1 資料和方法
1.1 一般資料 收集2017年10月至2020年3月就診于溫州醫科大學附屬第二醫院育英兒童醫院兒童血液科ALL患兒66例,年齡1~12歲,診斷標準按照《兒童急性淋巴細胞白血病診療建議》(第四次修訂)[6],入選標準:①按照細胞形態學-免疫學-細胞遺傳學-分子生物學(Morphology-Immunology-Cytogenetics-Molecular biology,MICM)診斷與分型標準;②骨髓形態學:原始及幼稚淋巴細胞≥20%,若不足20%必須經分子診斷確定存在ALL致病基因,如ETV6-RUNX1。所有患者經VDLD方案誘導化療、CAM或CAML方案早期強化治療后休療2周左右[6],在使用HD-MTX前均無明顯骨髓抑制、胃腸道反應、口腔黏膜損害及肝腎功能異常等。本研究經溫州醫科大學附屬第二醫院育英兒童醫院倫理委員會審批,征得患兒父母或其法定監護人的知情同意并簽署知情同意書。
1.2 儀器與試劑 advia2400 全自動生化分析儀(德國西門子公司),ABI7500實時熒光定量PCR儀(美國應用生物系統公司),安捷倫1290高效液相系統和6420系列三重四極串聯質譜儀(美國Agilent公司),ZORBAX Eclipse Plus C18 column色譜柱(美國Agilent公司)。前白蛋白(prealbumin,PA)測定試劑盒(上海復星長征醫學科學有限公司),谷丙轉氨酶(alanine transaminase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、總蛋白(total protein,TP)、白蛋白(albumin,ALB)、乳酸脫氫酶(lactate dehydrogenase,LDH)、谷氨酰轉移酶(γ-glutamyl transpeptidase,GGT)、總膽紅素(total bilirubin,TBIL)以及膽堿酯酶(cholinesterase,CHE)測定試劑盒(德國西門子公司),人MTHFR基因檢測試劑盒(武漢友芝友醫療科技股份有限公司),MTX標準品(純度>98%,美國Sigma-Aldrich公司),甲醇、乙腈(色譜純,德國Merck Millipore公司),甲酸(色譜純,美國Sigma-Aldrich公司)。
1.3 方法
1.3.1 HD-MTX化療方案:所有ALL患兒1/6總量(不超過0.5 g)在1 h內靜脈滴注,剩余部分勻速滴注維持23 h,每10~14天1次,共4次。HD-MTX用藥后36 h四氫葉酸鈣解救,并根據MTX血藥濃度予以調整。6-巰基嘌呤50 mg/(m2·d),每療程不超過7 d,根據白細胞數調整劑量。并給予腰椎穿刺+鞘內注射、水化堿化、速尿利尿及血藥濃度監測。
1.3.2 實驗室檢查:采用實時熒光定量PCR-探針法檢測MTHFR C677T基因多態性;根據《兒童急性淋巴細胞白血病診療規范(2018年版)》[7]于患兒靜脈滴注HD-MTX后48 h抽取靜脈血,分別檢測血常規、肝腎功能,并采用高效液相色譜法檢測HD-MTX血藥濃度,此后每24 h檢測1次,直至血藥濃度≤0.25 μmol/L。
1.3.3 不良反應評價:ALL患兒HD-MTX治療后不良反應評價標準參照WHO抗癌藥物不良反應表現與分級標準,在HD-MTX使用后48 h開始監測血常規、ALT、血尿素氮(blood urea nitrogen,BUN)、是否惡心嘔吐以及口腔黏膜損傷情況等,每位患者的每種不良反應僅記錄1次。
1.4 統計學處理方法 采用SPSS24.0 軟件進行統計學分析,采用logistic回歸模型分析MTHFR C677T基因型與HD-MTX各不良反應的關系,2組間計量資料的比較采用獨立樣本t檢驗或者秩和檢驗,2組間計數資料的比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 ALL患兒臨床特征 將MTHFR C677T基因CC型歸為野生型,共34例,CT+TT型歸為突變型,共32例,2組患兒的年齡、性別、免疫分型、核型、融合基因和危險分層差異均無統計學意義(P>0.05)。見表1。
2.2 MTHFR C677T基因分型結果及Hardy-Weinbery平衡檢驗 FQ-PCR基因分型結果如圖1所示,66例患兒中野生型(CC)34例,占51.5%,雜合突變型(CT)25例,占37.9%,純合突變型(TT)僅7例,占10.6%。對MTHFR C677T進行Hardy-Weinbery平衡檢驗后P=0.46(P>0.05),證明該基因型頻率符合Hardy-Weinbery 定律,即本研究樣本對于總體有一定的代表性。
2.3 MTHFR C677T不同基因型與HD-MTX不良反應的關系 為了校正劑量因素對不良反應發生率的影響,采用logistic回歸分析,以MTHFR C677T不同基因型為自變量,不良反應發生率為因變量進行統計分析,結果顯示:野生型與突變型相比較,骨髓抑制、口腔黏膜損害和胃腸道反應發生率差異無統計學意義(P>0.05),而肝功能異常發生率差異有統計學意義(P<0.05),突變型發生肝功能異常的風險更高,見表2。
2.4 MTHFR C677T不同基因型與肝功能各指標的關系 與野生型相比,突變型血清ALT、AST、CHE含量異常的患兒比例顯著升高(P<0.05),而其他肝功能指標PA、TP、ALB、LDH、GGT以及TBIL差異無統計學意義(P>0.05),見表3。野生型和突變型ALT或AST異常患兒的AST/ALT比值分別為0.89±0.45和0.71±0.30,差異無統計學意義(P>0.05)。
2.5 MTHFR C677T不同基因型患兒HD-MTX血藥濃度的差異 為進一步探討不同基因型患兒肝功能異常發生率不同的原因,分別比較不同基因型患兒滴注HD-MTX后48 h、72 h血藥濃度的差異,結果顯示突變型患兒48 h、72 h血藥濃度均高于野生型患兒 (P<0.05)。見圖2。
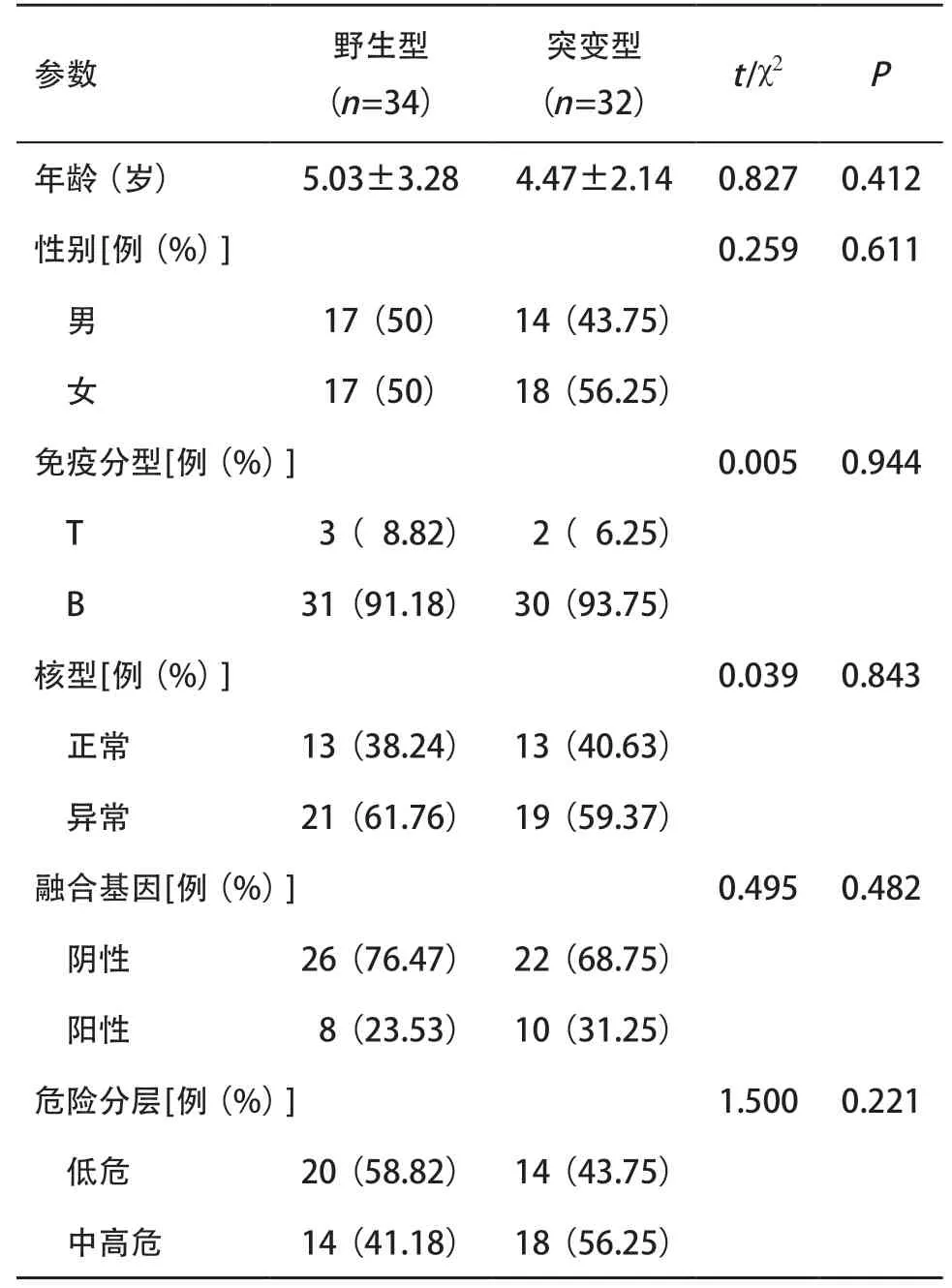
表1 66例ALL患兒臨床特征
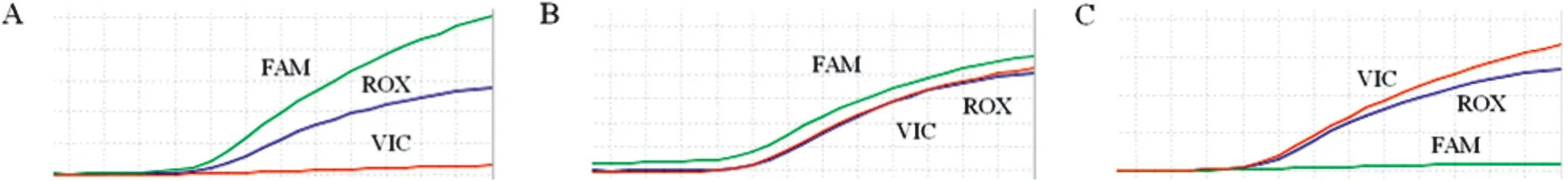
圖1 MTHFR C677TFQ-PCR基因分型結果
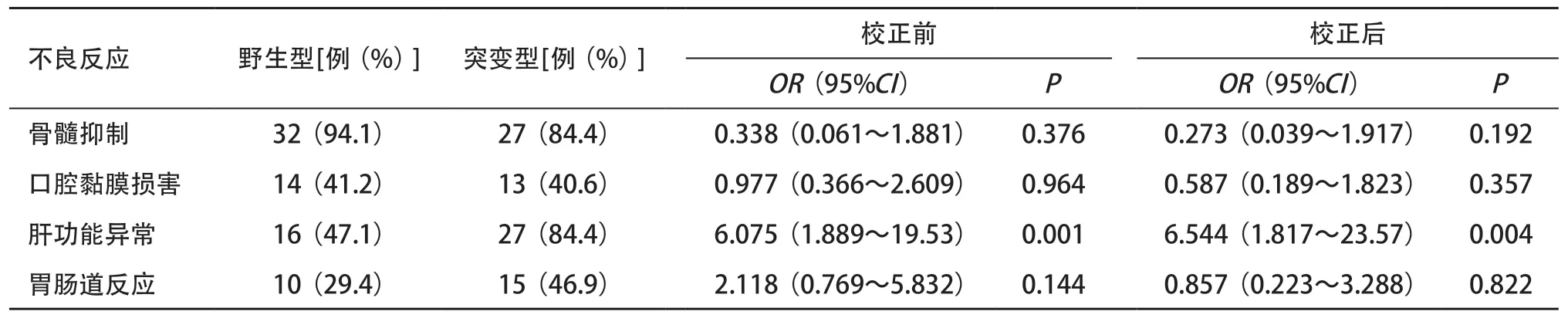
表2 MTHFR C677T不同基因型和HD-MTX不良反應的關系
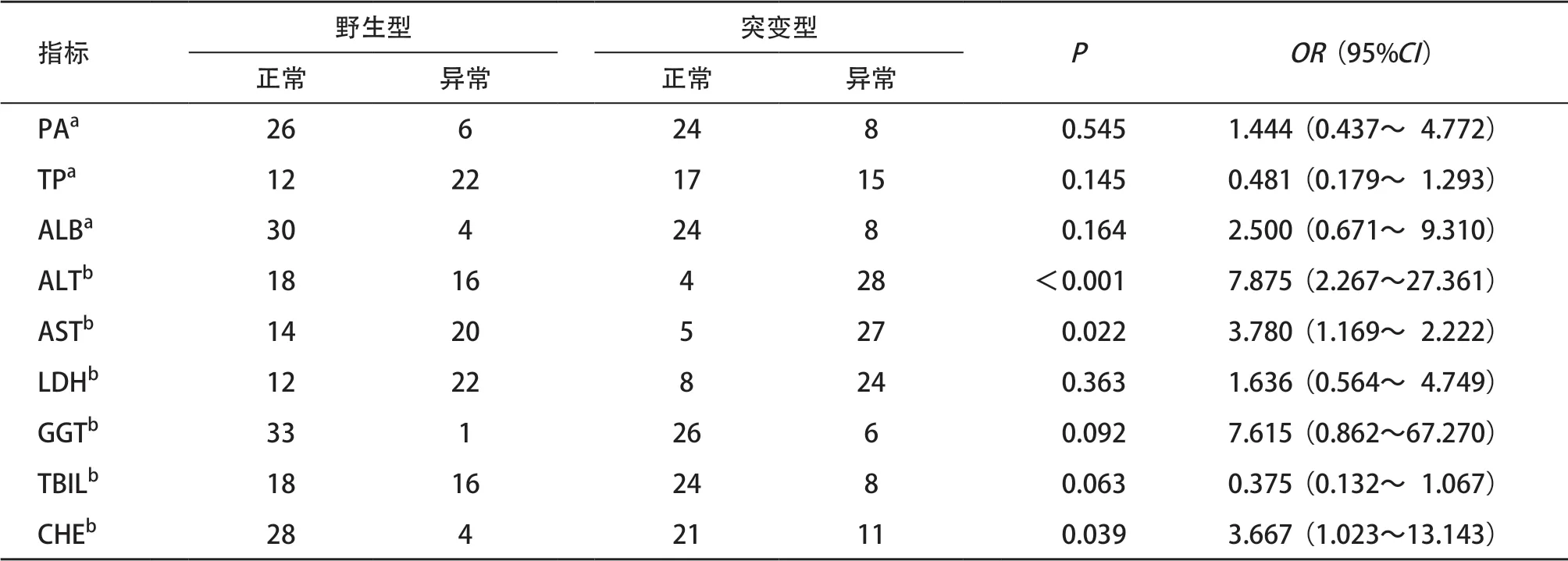
表3 MTHFR C677T不同基因型與肝功能各指標的關系(例)
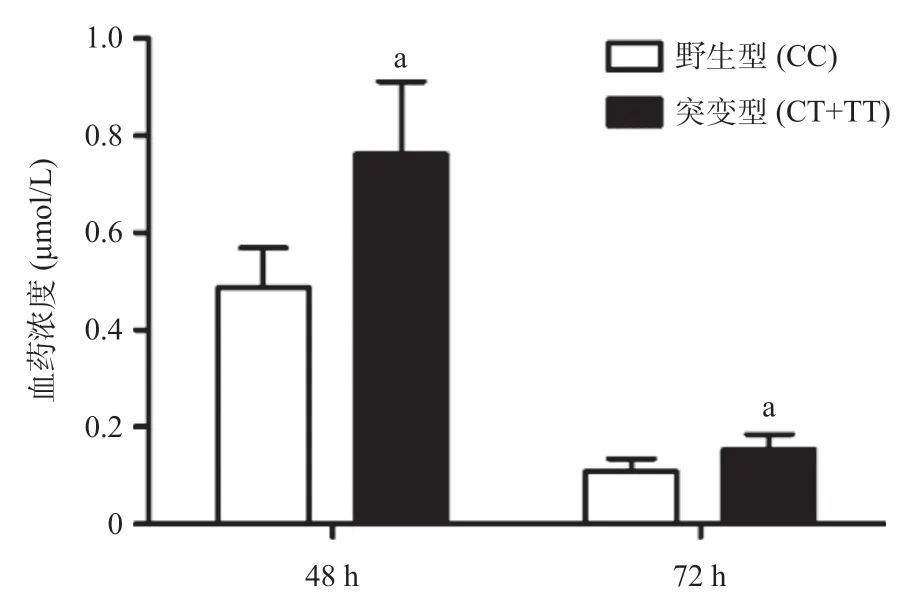
圖2 MTHFR C677T不同基因型患兒滴注HD-MTX 48 h、72 h血藥濃度的比較
3 討論
HD-MTX常用于ALL患兒化療的鞏固治療階段,但由于其選擇性較差,部分患兒在使用期間會發生不同程度的肝功能異常,發生率和嚴重程度均存在明顯的個體差異,無法用傳統的藥代動力學和藥效學解釋[8]。研究發現,藥物反應會受不同的遺傳背景影響,其中單核苷酸多態性(single nucleotide polymorphism,SNP)是藥物基因組學中影響藥物反應的主要原因[9]。迄今為止,研究與藥物反應和毒性相關的遺傳變異仍然是癌癥化療中的巨大挑戰。近年來,國內外眾多學者對MTHFR C677T基因多態性與HD-MTX治療后肝功能異常的相關性進行分析,但對具體肝功能各指標和功能的影響研究甚少。
由于本研究納入的純合突變型(TT)病例數較少,僅7例,且經過統計發現CT型和TT型各毒副反應發生率以及肝功能各指標的差異無統計學意義,因此根據顯現模型將CC型作為野生型,CT+TT型作為突變型,通過校正劑量因素的影響后,發現突變型發生肝功能異常的風險更高,與HAGLEITNER等[10]的Meta分析結果一致,說明T等位基因會增加HDMTX治療后的肝毒性,可能機制為突變后MTHFR熱穩定性和活性較野生型均有所降低,導致催化5,10-亞甲基四氫葉酸還原為5-甲基四氫葉酸的功能障礙,間接引起體內甲基化水平降低、MTX代謝減慢,進而導致發生肝功能異常的風險升高。進一步分析不同基因型與肝功能各指標的關系發現,突變型較野生型血清ALT、AST、CHE含量異常的患兒比例顯著升高,其他相關指標差異無統計學意義,說明不同基因型患兒肝實質損害發生率有差異,而肝臟合成功能、儲備功能、膽紅素代謝功能差異無統計學意義。針對ALT或AST異常的患兒,突變型與野生型患兒AST/ALT比值差異無統計學意義,且均值都小于1,表明HD-MTX雖對肝細胞有損害,但對肝細胞線粒體損傷較輕,使得存在細胞質內的ALT大量釋放入血,ALT升高程度大于AST。本研究發現突變型患兒48 h、72 h血藥濃度均顯著高于野生型,與XU 等[11]的研究結論一致。究其原因可能為突變后MTHFR酶活性降低,導致血藥代謝、葉酸代謝以及細胞修復減慢。因此,針對突變患兒應避免HD-MTX與其他有肝損的藥物同用,且在用藥前后應檢查肝功能,對異常者需及時積極治療。
相關研究認為,埃及、亞洲人群中MTHFR C677T基因多態性與肝臟毒性的風險增加相關[12],而另一項研究證實在土耳其和歐洲人群中結論則完全相反[13],說明該基因多態性在不同人種中的表現存在差異。有研究報道,除HD-MTX誘導的肝功能異常,MTHFR C677T多態性可能對ALL易感性、預后等存在影響,JUSTER-SWITLYK等[14]觀察到MTHFR C677T多態性與MTX引起的脊髓病相關,而ROY等[15]也發現MTHFR C677T突變的兒童葉酸缺乏現象更常見以及在誘導治療期間更易發生敗血癥引起的死亡。綜上分析,MTHFR C677T在疾病發生發展中的作用依然有待深入研究和探討。除MTHFR C677T位點,MTHFR A1298C、TPMT A719G以及TPMT G460A與HD-MTX血藥濃度、各不良反應的相關性研究較多,然而各學者研究結論不一[16],總體而言,尚不能成為預測HDMTX治療時肝功能異常的良好指標。
綜上所述,MTHFR C677T基因分型有望成為ALL患兒HD-MTX治療時降低肝毒性和改善治療結果的有效檢測手段。然而本次研究來自單中心,病例數有限,且單個SNP可提供的信息量較少,需擴大病例數在更多人群中進行驗證,以期為ALL患兒提供更有價值的個體化用藥指導。

