生命科學新技術在體育科學領域的應用
——以UPLC-QTOF在HIIT減脂研究中的應用為例
蘇利強,陳海春,溫岱宗,袁 恩,周立分
(1.福建師范大學體育科學學院,福建福州350108;2.江西中醫藥大學科研處,江西南昌330004)
1997 年世界衛生組織(WHO)將肥胖癥確定為一種疾病,大量研究也證明肥胖癥是一種慢性非傳染性疾病。從肥胖癥的生理機制看,1901年已有臨床證據推測下丘腦與肥胖癥有關[1]。1954年,Stellar[2]提出了腹內側核飽食中樞與外側核饑餓中樞相互平衡并控制進食和體質量的假說,研究發現5-羥色胺、肽類遞質等與食欲有關,從中樞調控角度探索了肥胖的發生機制。肥胖研究領域的一個重大突破是1994年“脂肪調節器”瘦素的發現,其在血液中的濃度與脂肪量成正比,可作用于下丘腦,抑制食欲,實現對脂肪的調控[3],隨后發現的脂聯素[4]、鳶尾素[5]也可通過不同途徑調控脂肪量,這些重要蛋白可能成為控制肥胖的靶點。代謝角度的研究認為胰島素抵抗與肥胖有關[6-7],很多活性成分可通過調節胰島素影響糖脂代謝,一磷酸腺苷(AMP)依賴的蛋白激酶(AMPK)是一種細胞能量傳感器,可調節胰島素敏感性,AMPK 的活性改變可影響胰島素抵抗,從而引起細胞能量失衡,導致肥胖[8]。慢性炎癥在肥胖的發病機制中起著至關重要的作用[9]。在肥胖的發展過程中,脂肪組織表現為脂肪細胞肥大、血管生成增多、免疫細胞浸潤和細胞外基質過度生成等動態組織學改變,引發機體慢性炎癥[9],而血管壁的慢性炎癥反應可引起動脈粥樣硬化[10]。流行病學研究顯示,肥胖是心血管疾病的重要風險因素,也是死亡的獨立預測因子[11]。鑒于肥胖對心血管的危害,探索高效的減脂途徑對改善肥胖者心血管健康有重要意義。
高強度間歇訓練(high-intensity interval training,HIIT)是WHO 和美國運動醫學會(ACSM)推薦的一種有效提高身體機能的運動方式[12],在超重/肥胖人群取得同樣心血管健康收益的情況下,HIIT比中等強度訓練節約時間[13]。HIIT可通過增加物質和能量代謝,減少脂肪堆積,達到減脂的目的[14],也對提高心肺機能、改善糖脂代謝、降低胰島素抵抗有促進作用[15]。HIIT可刺激機體骨骼肌細胞膜表面葡萄糖轉運蛋白4(GLUT4)表達及轉位活性,提高胰島素攜糖轉運進入肌細胞貯藏的效率,從而提高胰島素敏感性[16]。HIIT影響炎癥因子的研究發現,肥胖青少年經過24 周HIIT訓練后,血炎癥因子顯著改善[17]。目前很多研究從基因、mRNA、蛋白質等層面入手闡釋HIIT 的健康效益[15,17-19]。隨著研究的深入,人們逐漸認識到,某些基因表達的變化不一定能引起特定機能的改變,某些蛋白質可能因不具備活性,其濃度的變化不會對器官系統產生影響,某個基因和蛋白質的缺失會因其他基因和蛋白質的存在而使其功能得到補償,而小分子代謝產物才是這一系列事件的最終結果,它能更直接、準確地反映生物體的病理和生理狀況[20]。對運動減脂而言,通過探索肥胖人群運動前后小分子代謝物的變化,可從微觀的物質代謝層面了解減脂的機制。在研究小分子代謝物的過程中,有效的分離與檢測技術成為影響學科發展的重要因素,色譜-質譜技術可快速、準確和高通量地分離、鑒定與檢測小分子代謝物[21],為從代謝組學層面探索運動減脂的機制提供借鑒。
代謝組學是20 世紀90 年代末發展起來的一門學科,其在新陳代謝的動態過程中,系統研究代謝產物的變化規律,揭示機體生命活動代謝本質,主要關注分子量在1 000 Da 以內的小分子代謝物。1985 年Nicholson等[22]利用核磁共振技術分析大鼠的尿液,發現尿液代謝物的變化與病理變化相關聯,意識到這可能是生命科學研究的巨大突破。隨后Dugas 等[23]采用氣相色譜-飛行時間質譜聯用系統(GC-TOF/MS)分析特定代謝物與肥胖的關系,發現美國肥胖婦女的循環血多種代謝物水平高于體質量正常者,這些代謝物與高脂肪、高血脂和缺乏高強度身體活動相關。Romo-Hualde 等[24]采用超高效液相色譜-串聯四極桿飛行時間質譜(UPLC-QTOF)對硫辛酸(α-La)干預肥胖進行了尿樣的代謝組學研究,發現14個代謝物與超氧化物歧化酶(SOD)呈正相關,推測α-La對減肥的有益作用是通過改善抗氧化性能實現的。目前UPLCQTOF被廣泛應用于肥胖、糖尿病、腫瘤生物標志物的篩選與鑒定[25-28],這些研究表明應用 UPLC-QTOF 可篩選和鑒定差異代謝物,有利于闡明運動減脂的代謝機制,對肥胖的預防有積極作用。
本文對超重/肥胖女大學生進行8 周的HIIT 干預后,采用UPLC-QTOF對其尿液進行代謝組學分析,通過篩選和鑒定HIIT運動前后差異代謝物,結合差異代謝物的代謝通路探討HIIT減脂的機制。
1 研究對象與方法
1.1 研究對象
受試者招募于江西中醫藥大學,對其進行疾病調查與身體形態機能測試。納入標準:①女性,年齡18~22歲;②身體健康;③除體育課外,無規律體育鍛煉習慣;④體質量指數(BMI)>24 kg/m2;⑤同意參與試驗并簽署知情同意書。排除標準:①心血管疾病、肝病、腎病等慢性疾病患者;②近期有服用藥物者;③不能完成全程運動干預者。共納入16名受試者。
1.2 研究方法
1.2.1 形態學指標
在入組后干預前進行形態學指標測試,完成8 周HIIT 干預后24 h 進行第2 次測試,早晨空腹測試。采用身高儀器測試身高,生物電阻抗身體成分分析儀(InBody 270)測試體質量,以及骨骼肌、脂肪占比等,計算BMI和腰臀比。
1.2.2 Beep test方法
Beep test 是評價心肺機能的一種負荷方法[29]。受試者在相隔20 m 的兩條線之間進行由慢到快的往返跑,節奏完全由音樂節拍器控制,在聽到音樂帶中“笛”樣哨音指令后開始向對面跑,到達后停止,等待下一聲哨音。初始跑速為8.5 km/h,每過1 min節奏加快一級(stage),速度增加0.5 km/h。受試者跑步速度逐漸加快,連續3 次不能在規定時間內按要求踏上或踏過端線,或感到無法堅持運動時停止測試,通過受試者完成的水平評價最大耗氧量(VO2max)。
1.2.3 尿液預處理
分別在運動方案實施前和完成運動方案后24 h取晨尿,-80 ℃保存。對收集的每例尿液進行預處理:尿液37 ℃解凍20 min,3 000g(4 ℃)離心10 min,取上清液 100 μL 加甲醇 400 μL 沉淀蛋白,渦旋 1 min后冰上孵化10 min,14 000g(4 ℃)離心15 min,取上清液300 μL,0.22 μm 微孔過濾,加入取樣瓶,-80 ℃保存待測。待全部尿液收集處理完成后,對每例尿樣逐一進行測試。
1.2.4 尿代謝組學測試
(1)儀器性能及實驗條件。色譜儀器為島津LC-30A。色譜柱為ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×100 mm);柱溫為40 ℃;流速為0.3 mL/min;進樣量為1 μL;流動相采用乙腈-0.1%甲酸水,二元梯度洗脫,流動相A 為0.1%甲酸水溶液,流動相B 為乙腈溶液,洗脫流程見表1。
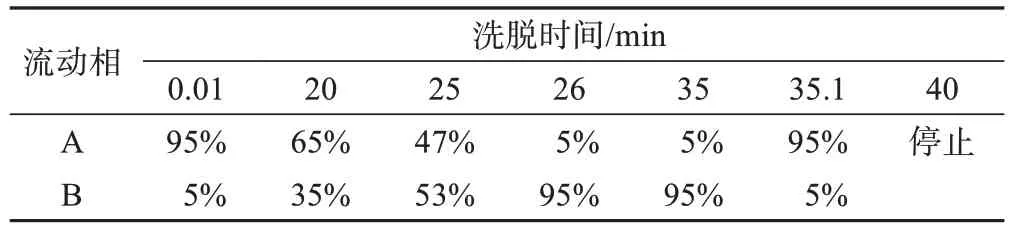
表1 流動相梯度洗脫程序Table 1 Gradient elution of mobile phase
(2)質譜條件。質譜儀器為AB Sciex Triple TOF 5600+,使用電噴霧離子源(ESI),輔氣和碰撞氣為高純氮氣(99.99%),分辨率為35 000(FWHM)。每例樣品分別采用正離子和負離子2 種模式獲取質譜信息,一級質譜母離子掃描范圍為50~1 000 Da,同時進行二級質譜掃描,子離子掃描范圍為50~1 000 Da。
(3)數據預處理與分析。UPLC-QTOS 所得數據通過MarkerView v1.2.1(AB SCIEX)軟件預處理,將處理后的變量矩陣導入SIMCA-P 14.1 軟件進行無監督的主要成分分析(PCA)和有監督的正交化偏最小二乘判別分析(OPLS-DA),通過OPLS-DA 模型找到組間區分貢獻最大的主成分。利用排列實驗和CVANOVA 方法對模型的有效性進行進一步驗證,如果隨機排列后模型的R2Y值和Q2值都小于模型值表示實際模型有效,CV-ANOVA 所得P<0.05 表明模型建立成功,組間差異具有統計學顯著性。依據OPLSDA 模型分析得出變量重要投影值(variable importance in projection,VIP),以VIP>1.5 為標準篩選運動前后區分顯著性水平的代謝標志物,結合t檢驗,將VIP>1.5且P<0.05者視為運動前后具有明顯差異的代謝標志物。依據不同的加合離子模式結合監測到差異物對應的質荷比(m/z)在HMDB 數據庫中搜索,m/z值偏差在5×10-6以內,將初步篩選處理的化合物結合MEDTLIN 和HMDB 等數據庫提供的二級離子質譜碎片進行進一步驗證,最終確定代謝物。
1.3 干預方案
受試者在Beep test 測試過程中通過Polar 表記錄最大心率,推算心率儲備(heart rate reserve,HRR)[30]。通過HRR 監控各受試者的運動強度。對受試者進行8 周 HIIT 干預,每周 4~5 次,每次包括 35%~40%HRR 強度的準備活動,共 5 min,然后執行 10~15 組間歇訓練,高強度為75%~80%HRR持續1 min,間歇強度為35%~40% HRR 持續1 min,執行完成后進行5 min(35%~40% HRR)整理活動。負荷監控:通過Polar 表的實時心率指導訓練強度。訓練期間通過健康教育規范受試者的生活習慣。不能完成總量的75%者視為未完成訓練任務,其中2 名受試者未完成訓練任務。通過24 h 回顧法對受試者訓練期間的其中3 d進行膳食調查。
1.4 統計學方法
數據統計分析采用SPSS 19.0 軟件完成,連續變量采用均數±標準差(-x±s)表示,用平均偏差(mean deviation,MD)和95%置信區間(95%CI)反映運動前后差異程度,組間比較采用t檢驗方法進行檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1 運動期間膳食情況
24 h 回顧法調查結果顯示,受試者早、中、晚餐能量占 比 分別 為(33.4±3.7)%、(34.3±6.7)% 、(32.3±8.0)%,蛋白質、脂肪、糖攝入能量比例分別為(15.5±3.1)%、(20.6±3.2)%、(63.9±4.3)%,可見經健康教育規范營養結構后,受試者三餐能量比例和三大供能物質能量攝入比例均符合中國居民膳食營養素參考攝入量[31]。
2.2 形態機能情況
由表2 可知,8 周HIIT 后超重/肥胖女大學生體質量和BMI 均無顯著變化,骨骼肌占體質量百分比較HIIT 干預前顯著提高(0.745%,P=0.016<0.05),脂肪占體質量百分比顯著下降(-1.891%,P=0.011<0.05),腰臀比顯著下降(0.02%,P=0.001<0.05),心肺機能指標 VO2max顯 著 提高(2.392 mL·kg-1·min-1,P=0.023<0.05),提示8 周HIIT 不僅可改善超重/肥胖女大學生身體成分,而且可顯著提高其心肺機能。
2.3 代謝圖譜分析
2.3.1 總離子流
從色譜-質譜法測得的各代謝物的m/z離子強度及其隨時間變化曲線(圖1)看,設置的流動相梯度洗脫程序能較好地區分各m/z的離子,便于查找和區分代謝物,同時可觀察到HIIT干預前后部分時段代謝物離子強度有區別,如負離子模式下在11~13 min 區間,HIIT 干預后部分代謝物離子強度顯著降低,正離子模式下在26~29 min區間,HIIT干預后部分代謝物離子強度顯著提高。
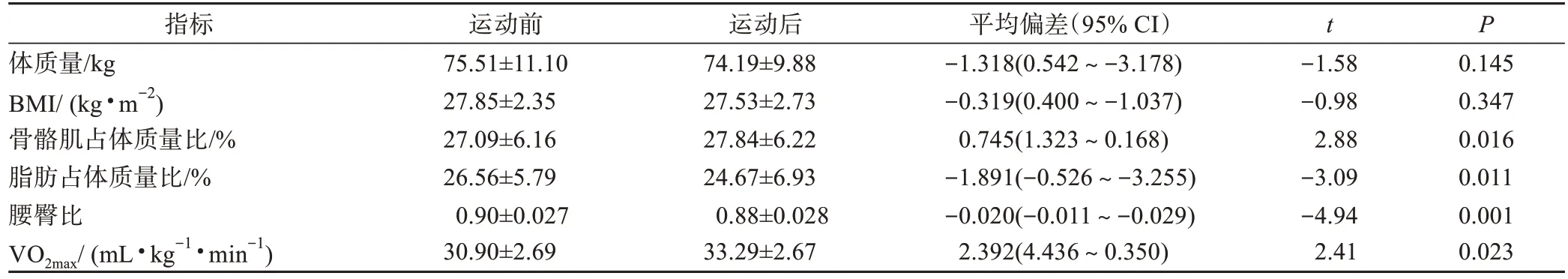
表2 HIIT前后身體形態指標和VO2max變化Table 2 Changes of body composition and VO2max before and after HIIT
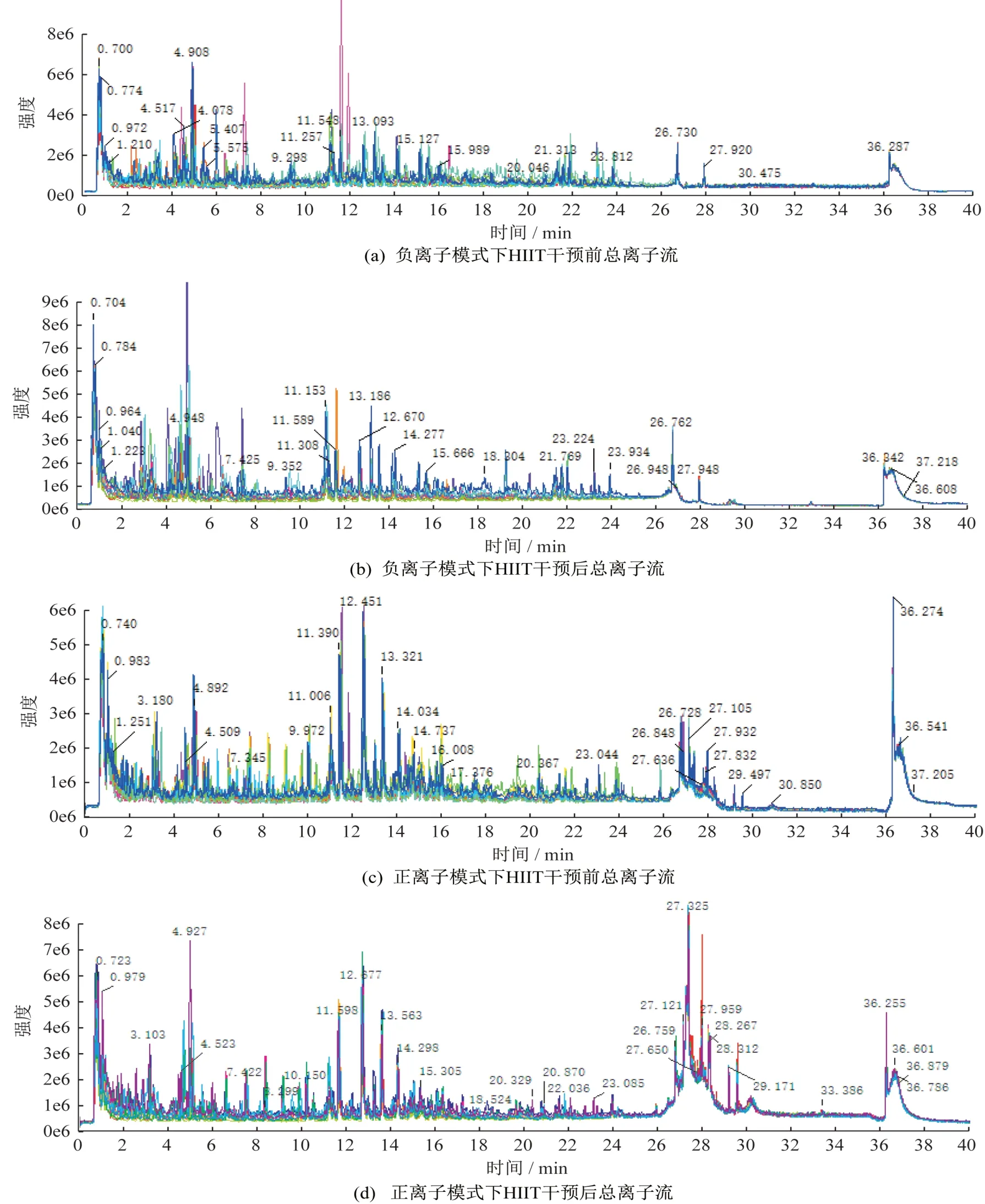
圖1 HIIT干預前后總離子流Figure 1 Total ion flow chart before and after HIIT intervention
2.3.2 代謝組學分析
所得數據通過MarkerView v1.2.1 軟件進行預處理,處理后的變量矩陣導入SIMCA-P 14.1 軟件進行多元統計分析。經過PCA 對處理后的變量矩陣數據進行降維,去除噪聲,結果顯示負離子模式下HIIT 干預前后主成分t[1]、t[2]和t[3]三維區分效果較好(圖2a),正離子模式下HIIT 干預前后主成分t[1]、t[2]和t[3]三維區分效果較好(圖2b)。可見HIIT 干預后超重/肥胖女大學生尿代謝物輪廓發生變化。為進一步在PCA 模型的基礎上篩選差異代謝物,采用OPLSDA 對數據進行分析,由OPLS-DA 模型得分(圖2c、2d)可以看出,正、負離子模式下HIIT干預前后離子區分良好,無重疊,無交叉,正、負離子模式下OPLS-DA模型均具有良好的擬合度和預測能力。隨機排列實驗可對OPLS-DA模型進行有效性檢驗,采用SIMCA-P 14.1 軟件對數據正、負離子模式下OPLS-DA 模型進行200次排列實驗,結果顯示,隨機排列后的正離子和負離子模式下OPLS-DA 模型R2Y值和Q2值均小于實際模型值(圖3),由此可推斷正離子和負離子模式的實際OPLS-DA模型是有效的。
2.3.3 差異代謝物的篩選與鑒定
在正離子和負離子模式下OPLS-DA 模型的基礎上進行運動前后 VIP 和P值的計算,將 VIP>1.5 且P<0.05 的代謝物作為差異代謝物。在PeakView 1.2.1 軟件中將潛在差異代謝物的m/z、MS/MS 二級圖譜與HMDB、MEDLIN 等生物學數據庫進行比對,最終在負離子模式下鑒定出9 個代謝物,在正離子模式下鑒定出7個代謝物,結果見表3。
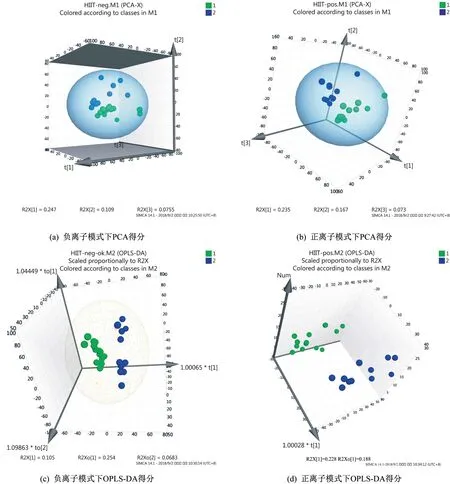
圖2 HIIT干預前后PCA和OPLS-DA得分Figure 2 Scores of PCA and OPLS-DA before and after HIIT intervention
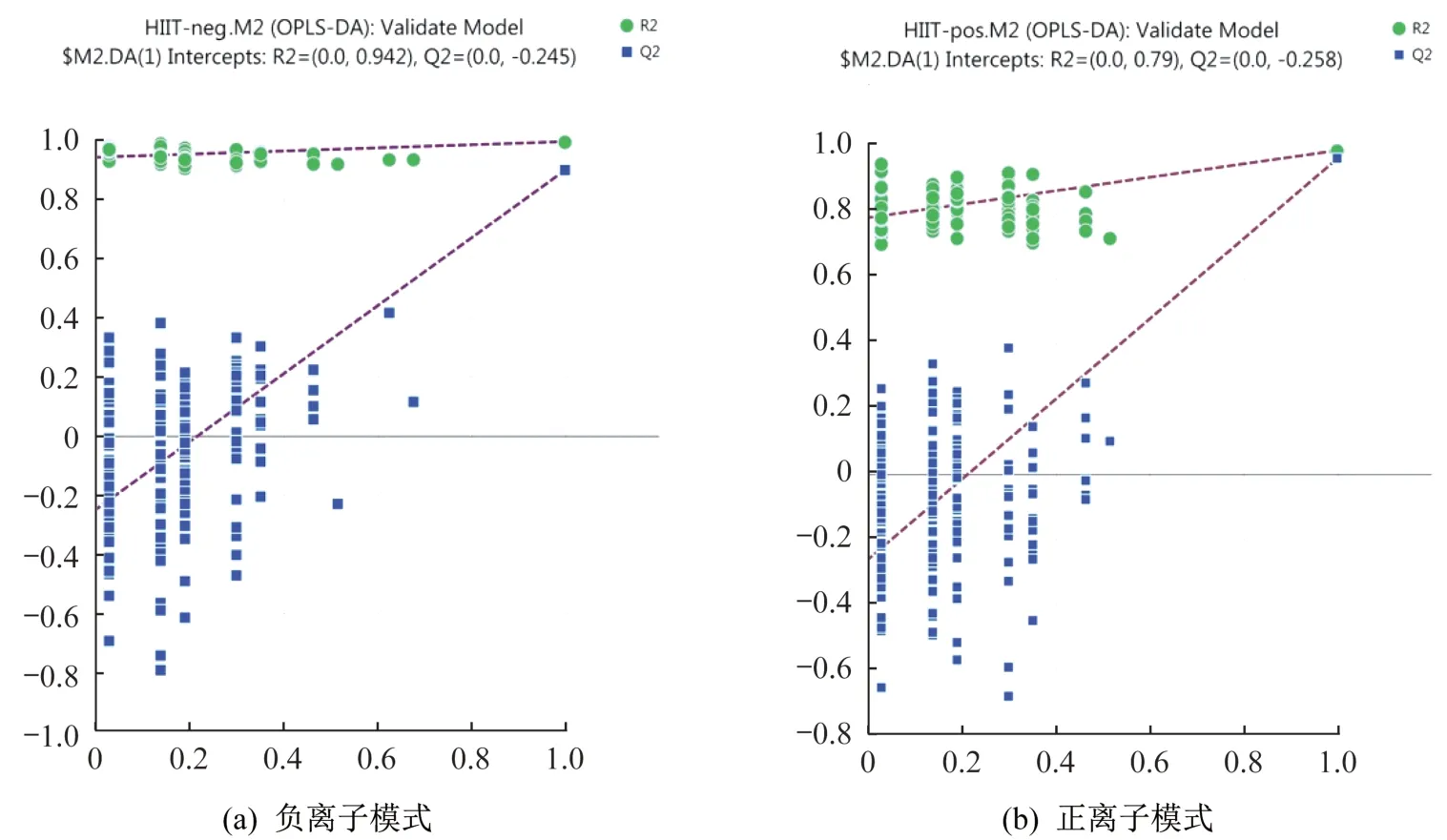
圖3 HIIT前后OPLS-DA模型排列實驗結果(n=200)Figure 3 An OPLS-DA model permutation experiment before and after HIIT
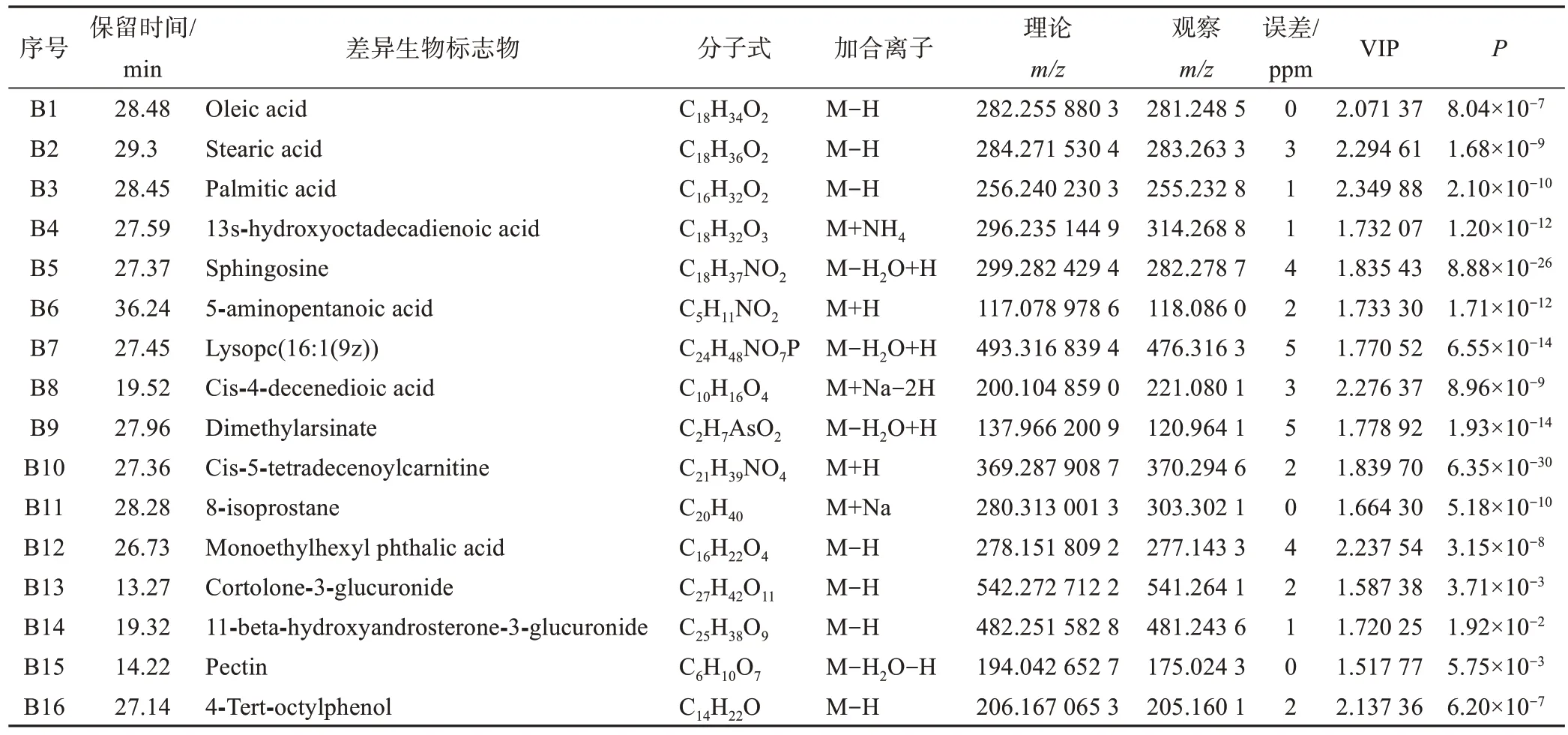
表3 HIIT干預前后差異代謝物特征匯總Table 3 Summary of characteristics of differential metabolites before and after HIIT intervention
2.3.4 代謝通路分析
將16 種差異代謝物導入MetPA(metabolic pathway analysis)系統,用相應軟件(Database and Metabo-Analyst 4.0)進行代謝通路分析,結果顯示,HIIT 干預超重/肥胖女大學生主要涉及脂肪酸生物合成、亞油酸代謝、鞘脂代謝、線粒體脂肪酸的伸長、甘油磷脂代謝、賴氨酸降解、脂肪酸代謝、精氨酸與脯氨酸代謝等8 條代謝通路變化,其中脂肪酸生物合成通路富集分析值最大,說明該通路涉及的差異代謝物最多(圖4)。脂肪酸生物合成共涉及49個化合物,本文鑒定的差異代謝物中油酸、硬脂酸和棕櫚酸均屬于該通路中的化合物(圖5),因此HIIT 減脂機制可能與該代謝通路有較大關聯。此外,鞘脂代謝的拓撲影響值最大(圖4),說明鞘脂代謝通路中合成或分解鞘氨醇的路徑最多,因此,提示HIIT減脂過程中鞘脂代謝的鞘氨醇表現較為活躍。
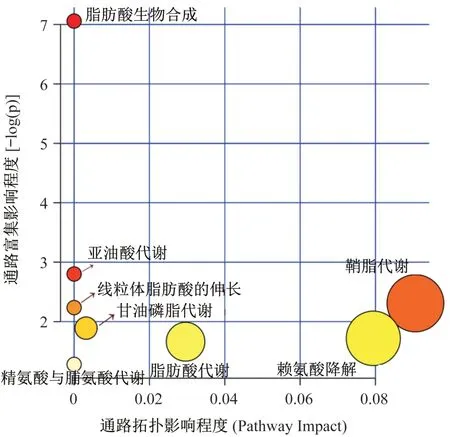
圖4 通路拓撲影響程度代謝通路分析Figure 4 Metabolic pathway analysis
3 討論
3.1 差異代謝物與脂代謝調控
肥胖人群脂代謝調控能力與脂肪組織、血中游離脂肪酸(FFA)有一定聯系。在正常情況下,血中FFA可被吸收入脂肪組織,肥胖人群脂肪組織含量多,吸收 FFA 能力有限,造成 FFA“溢出”到血液循環[32],過多FFA 可導致骨骼肌、肝臟和心臟中的異位脂質沉積,影響胰島素抵抗,對機體產生不良影響[33]。FFA直接作用于各種組織中的G 蛋白偶聯受體(GPCR),可調節食欲、平衡能量[33-34],另外 FFA 的增加與脂質過度積累和炎癥途徑的激活有關[35],因此,肥胖人群異位脂質沉積增加導致脂代謝調控能力下降,脂質過氧化和慢性炎癥增加導致其身體機能下降。
對超重/肥胖女大學生進行為期8 周的HIIT 干預結果顯示,運動后體脂百分比顯著下降,骨骼肌百分比和心肺機能顯著提升,這些改善可能與運動導致的代謝物變化有關。本文采用MarkerView v1.2.1 預處理后的數據,提取差異代謝物的離子強度,發現6個代謝物下調,10個代謝物上調(表3),結合代謝物的代謝通路和細胞內信號轉導情況,推導出HIIT干預后差異代謝物代謝通路網絡調控模型(圖5)。其中:中鏈脂肪酸、長鏈脂肪酸和甘油磷脂的分解代謝中間產物在HIIT 干預后增加,提示脂肪酸分解代謝增加;在HIIT干預后油酸、硬脂酸和棕櫚酸下降,提示脂肪酸合成代謝降低。這些結果可能與HIIT 干預后體脂百分比下降有關。多種途徑可調控脂肪代謝:HIIT干預后鞘脂代謝中間產物鞘氨醇含量提高,鞘氨醇可被催化為鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P),通過一系列信號轉導途徑激活一氧化氮(NO)、絲裂原活化蛋白激酶(MAPK)信號通路,實現對脂肪代謝的調控;HIIT 干預后花生四烯酸代謝中間產物異前列腺素-8 在尿中增加,異前列腺素-8 合成前列腺素F(PGF)的前體,而PGF 可通過激活GPCR 和AMPK 途徑實現對脂代謝的調控。另有研究[13]表明,HIIT可顯著增加腎上腺素、去甲腎上腺素和生長激素,刺激脂肪分解,促進骨骼肌氧化酶的表達或活性上調,提升骨骼肌氧利用效率,減輕脂質氧化程度和慢性炎癥。結果提示,8周HIIT干預超重/肥胖女大學生可通過提高其外周氧利用率、增加脂肪酸的氧化分解實現減脂目的。
3.2 脂肪酸分解與合成代謝通路
脂肪酸分解作用加強是運動減脂的基礎,本文結果顯示,長鏈、中鏈脂肪酸和甘油磷脂分解代謝的中間產物在HIIT后增加,長鏈脂肪酸氧化供能在長時間運動時具有重要作用,可通過長鏈酰基輔酶A(CoA)合成酶在細胞質中活化至長鏈酰基CoA,經線粒體內外膜轉位、催化生成酰基CoA,而后進入線粒體內進行 β-氧化[36-37]。長鏈酰基 CoA 可被催化產生 2-碳單位(Malonyl-CoA),Malonyl-CoA 是線粒體生物能(ATP、NADH、FADH2)的碳底物,也可進行糖異生,是脂肪酸分解的重要途徑[38]。研究[39]顯示,長期運動使小鼠肌肉中Malonyl-CoA 濃度下降可能是脂肪酸氧化增加的一個重要信號,但運動對人體骨骼肌組織Malonyl-CoA 的水平影響不大,通過觀察肉堿棕櫚酰轉移酶Ⅰ(CPTⅠ)對Malonyl-CoA 的敏感性改變,推斷運動使長鏈脂肪酸氧化加強[40]。本文結果顯示,8周HIIT后長鏈脂肪酸、中鏈脂肪酸和甘油磷脂的部分中間代謝產物增加,推測HIIT干預后脂肪酸氧化分解增加,使異位脂肪沉積減少,對脂代謝調控有積極作用。

圖5 HIIT干預前后差異生物標志物代謝通路網絡模型Figure 5 Models of metabolic pathways of different biomarkers before and after HIIT intervention
脂肪酸的合成和利用與肥胖發生密不可分,從新陳代謝的靈活性看,健康機體能適當調節氧化水平以適應各種代謝物的變化是新陳代謝健康的標志[41],然而,在人類和動物肥胖模型中發現脂肪酸運輸或氧化過程存在一定缺陷[42-43]。其中,過氧化物酶體增殖激活受體α(PPARα)在脂肪酸氧化中扮演重要角色[44]。肥胖、胰島素抵抗者在高脂飲食后,其骨骼肌PPARα無法上調,使骨骼肌利用脂肪酸能力下降[45];另外,PPARα 的下調可通過激活脂酰輔酶A 氧化酶(AOX)和細胞色素P450 4A(CYP4A)促進脂肪合成,導致脂肪堆積[46]。本文結果顯示,油酸、硬脂酸和棕櫚酸在HIIT 干預后下降,提示HIIT 干預可使脂肪酸合成降低,有利于減脂。運動可通過激活AMPK 影響PPARα 途徑,對能量代謝進行調控[47-48],AMPK 對細胞能量狀態敏感[44],當運動和能量缺乏(AMP/ATP 比率增加)時 AMPK 途徑被激活[49],調節多種代謝過程[50],如:AMPK/PPARα 途徑可介導 PGC-1 基因表達,使線粒體數量和功能增加,促進脂肪酸氧化分解過程,抑制脂肪酸合成過程[51-52]。本文結果顯示,HIIT 可降低油酸、硬脂酸和棕櫚酸合成,這可能是導致體脂下降的重要因素。
3.3 鞘脂代謝與S1P
鞘脂水解產物S1P 參與胰島素抵抗和慢性炎癥發展[53-54],并與肥胖發生和代謝紊亂有關[55]。本文結果顯示,8 周HIIT 對鞘氨醇有影響,鞘氨醇磷酸化的產物S1P 是重要的代謝調控因子,大約65%的S1P 與血漿脂蛋白結合,50%與高密度脂蛋白有關,其余部分與白蛋白結合。在哺乳動物中循環血濃度高于細胞間液濃度[56],但循環血S1P 水平似乎對代謝狀態的變化很敏感,如禁食、肥胖、運動、糖尿病等對血漿S1P的變化都有影響。
在本文中,超重/肥胖女大學生經過8 周HIIT 干預后,尿鞘氨醇升高,可能與運動后循環血中脂質通量增加引起血漿中S1P 濃度升高有關[57];紅細胞神經酰胺水平降低,使紅細胞釋放S1P 入血,也可引起血漿 S1P 濃度升高[58]。另外,有研究發現 S1P 可激活大鼠原代脂肪細胞的脂解作用[59],也可通過激活S1P 受體參與巨噬細胞的抗炎作用[60]。S1P在病理應激環境下具有改善細胞存活的作用,較高的血漿S1P 可能通過S1P 受體信號轉導調控肝臟、胰腺β 細胞和骨骼肌等組織功能,使組織減少脂質積累、對抗凋亡途徑[61]。血漿S1P 濃度的增加可能是運動改善心血管健康和胰島素敏感性的機制之一[58]。從這一角度看,HIIT對健康的收益與鞘氨醇代謝提高有關。
但也有報道顯示,高血漿S1P 不利于健康,如肥胖小鼠血漿中 S1P 增加[62],S1P 可影響胰島素受體的磷酸化[63],在人血漿中S1P 水平與空腹胰島素、HOMA-IR、HbA1c、總膽固醇和低密度脂蛋白膽固醇、BMI、腰圍和體脂百分比等心血管功能障礙臨床指標呈正相關[64]。S1P 導致 PAI-1、TNF-α、IL-6 和趨化因子基因表達增加,對脂肪細胞有促炎、促血栓作用,在肥胖介導的心血管和代謝疾病的發病機制中可能起主要作用[62],這些研究預示高血漿S1P 對健康產生不利影響。可見,S1P 在肥胖和代謝功能障礙中的作用非常復雜,學者推斷肥胖患者血漿S1P 水平的升高也可能是裂解酶降解S1P 下降所致,S1P 清除率的降低也可能是肥胖患者循環S1P 增加的原因[64]。因此,很難確定S1P 的增加對肥胖癥的形成有益還是有害。鞘脂代謝的協調以及S1P 產生和清除途徑的平衡是保持內穩態的基石。本文結果顯示,HIIT 干預后尿鞘氨醇濃度增加,推測運動可調節鞘脂代謝,提升S1P 清除率,促進機體機能提高。運動影響鞘脂在血液和細胞中代謝的作用機制尚需深入研究。
3.4 花生四烯酸
花生四烯酸(arachidonate acid)是人體必需的一種脂肪酸,是合成前列腺素的前體,而前列腺素對脂質代謝、血管彈性、免疫反應和血小板激活等具有重要的調節作用。本文結果顯示,運動后尿液異前列腺素-8 水平高于運動前。異前列腺素-8 是由自由基催化花生四烯酸過氧化生成的類前列腺素類化合物,主要分布于細胞膜的磷脂結構域和循環血中的脂蛋白,一旦被磷脂酶裂解,就會釋放到細胞外,并從尿液中排出。根據藥物動力學和代謝研究結果,異前列腺素-8 在人體內的半衰期約為16 min[65]。在氧化應激增加的條件下,血漿和尿液異前列腺素-8 水平升高,可反映抗氧化不足和氧化應激[66]。異前列腺素具有較低的日變異性,已被用作健康受試者氧化應激的可靠生物標志物[65]。研究顯示,肥胖成年人的異前列腺素濃度明顯升高[65],向心性肥胖人群異前列腺素-8水平升高與肥胖獨立相關[67]。
有關運動對異前列腺素影響的研究結果報道不一。未經訓練、久坐、血脂異常的非胰島素依賴型糖尿病患者進行8 周的小強度訓練(HR<100 次/min,或55%~65%VO2max)后,尿液異前列腺素無顯著變化[68]。對超重者進行為期12 個月的小強度訓練后異前列腺素水平有所降低[69]。也有研究結果顯示,一次急性運動后16 h,異前列腺素水平較運動前增加[54],對受試者進行2 周70%~85% HRmax強度運動后異前列腺素水平較運動前增加[70],對成年男性2 型糖尿病患者進行為期8 周的高于通氣閾運動(30 min),運動后異前列腺素水平較運動前增加[71]。總體而言,小強度運動后異前列腺素有下降趨勢[72],急性運動和中大強度運動后異前列腺素水平升高[70-71,73]。本文結果顯示,8周HIIT 后尿液異前列腺素-8 升高,與前人[70-71,73]研究結果一致,這一升高并不能表示運動后機體抗氧化能力下降,因為異前列腺素-8 變化不僅與抗氧化系統有關,還與應激狀況、飲食結構、生活方式等有關[74],高強度運動肌肉收縮以及應激激素的分泌可能是引起異前列腺素-8運動后升高的原因。
3.5 氨基酸代謝通路與葡萄糖醛酸化
5-aminopentanoic acid是腸道菌群的代謝產物[75],腸道菌群的變化是肥胖發生的重要機制之一[76],而運動可通過調整腸道菌群改善肥胖[77]。本文發現,對超重/肥胖女大學生進行8 周HIIT 干預后,其體內5-aminopentanoic acid 發生變化,推斷HIIT 提高身體機能、降低脂肪百分比可能與腸道菌群代謝有關。
5-aminopentanoic acid 也是賴氨酸、脯氨酸、精氨酸代謝的中間產物。脯氨酸可促進脂肪酸氧化,精氨酸可使肌肉合成增加,這些功能與本文顯示的降脂和增肌結果相吻合。另外,精氨酸是內皮型一氧化氮合酶(eNOS)/NO 通路的重要物質基礎,eNOS 由2 個還原結構域組成,參與氧化還原反應的還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)、黃素單核苷酸(FMN)、黃素腺嘌呤二核苷酸(FAD)和一些氧化酶在結構域上有其結合位點,eNOS 也參與氧化還原反應的調控,NO 是其催化產物,參與心血管構建,與心血管功能密切相關[78]。本文結果顯示,以精氨酸為物質基礎的eNOS/NO 信號通路可能參與HIIT 干預后的脂代謝調控和心血管構建,并與VO2max的提升有聯系。
葡萄糖醛酸化過程可幫助機體排泄有毒物質、藥物或其他不能用作能源的物質,重度肥胖對葡萄糖醛酸化有影響[79]。本文發現,對超重/肥胖女大學生進行8 周HIIT 干預后,葡萄糖醛酸化的產物cortolone-3-glucuronide 和11-beta-hydroxyandrosterone-3-glucuronide 顯著提高,提示HIIT 可增加超重/肥胖女大學生體內一些有害物質的排泄,對肝腎功能有保護作用,對代謝所需的內環境起穩定作用。
4 結論
超重/肥胖女大學生進行8 周HIIT 可有效減脂和提升身體機能。本文分析鑒定的16 種差異代謝物可能與減脂機制有關。HIIT 引起尿中葡萄糖醛酸化代謝物增加,有利于機體代謝廢物和毒素的排出,為脂代謝提供良好的內環境,而HIIT 引起的賴氨酸、脯氨酸、精氨酸和鞘氨醇的部分代謝產物變化可能參與脂肪酸的代謝調控,使受試者干預后脂肪酸分解過程加強,油酸、硬脂酸和棕櫚酸合成量降低,可能是HIIT減脂的重要途徑之一。

