鹽酸西替利嗪片人體生物等效性試驗
司鴿,郭建艷,張紅貞,高娟,鄭忠輝
(1.淄博職業學院,山東 淄博 255314;2.山東新華制藥股份有限公司,山東 淄博 255035;3.山東藥品食品職業學院基礎教學部,山東 淄博 255011)
鹽酸西替利嗪片為口服劑型的H1受體拮抗劑,為抗過敏類非處方藥,適應證為季節性鼻炎、常年性過敏性鼻炎、過敏性結膜炎及過敏引起的瘙癢及蕁麻疹的對癥治療。美國應變性鼻炎診療指南(2015)推薦西替利嗪為治療變應性鼻炎及非變應性鼻炎的一線口服抗組胺藥物[1-6]。鑒于鹽酸西替利嗪片的臨床作用,為增加臨床醫生和患者的用藥選擇,根據《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》(國辦發〔2016〕8號)要求,本研究選用新華制藥(高密)有限公司生產的鹽酸西替利嗪片為受試者制劑,UCB Farchim SA(瑞士)原研鹽酸西替利嗪片為參比制劑[7-8],開展人體生物等效性臨床試驗。
1 藥品、試劑和儀器
鹽酸西替利嗪片受試制劑[T,規格:10 mg /片,新華制藥(高密)有限公司,批號:1703001];鹽酸西替利嗪片參比制劑[R,規格:10 mg/片,UCB Farchim SA(瑞士),批號:170664]。對照品:鹽酸西替利嗪[新華制藥(高密)有限公司,批號:160611,純度/含量:99.6%(按干燥品計)]。內標:鹽酸氘代西替利嗪[(±)-Cetirizine-d4-Dihydrochloride),Toronto Research Chemicals,批號:24-GHZ-126-1,純度/含量:98%]。甲醇、乙腈、甲酸,均為色譜純,Merck公司生產;超純水為自制品;其他試劑均為分析純。
液相色譜串聯質譜(LC-MS/MS)系統:UFLC20-AD超快速液相系統(島津公司);AB Sciex Triple QuadTMAB SCIEX 5500串聯四極桿質譜儀(美國應用生物系統公司);色譜柱:Luna 5 μm HPLC 200A 100×2 mm,批號:H16-099554、H16-327417;數據采集/管理軟件為AnalystTM軟件1.6.2版、Thermo Watson 7.5實驗室信息管理系統。
2 試驗方法
2.1 受試者 本試驗經中國醫科大學附屬盛京醫院醫學倫理委員會批準,空腹和餐后共篩選128例受試者,年齡18~45歲,體重指數18.0~26.0 kg·(m2)-1,所有受試者均在充分了解本試驗的目的、方法及風險后,自愿簽署知情同意書,統一進行查體和實驗室檢測,經篩選合格并隨機納入空腹試驗的受試者24例,餐后試驗的受試者24例。
完成例數:空腹試驗完成24例,無脫落/剔除;餐后試驗完成22例,2名受試者因首個血藥濃度值為Cmax,未納入藥代動力學參數集(PKPS)及生物等效性集(BES)。
2.2 試驗設計[8-11]本試驗采用隨機、開放、單劑量、自身交叉設計,分空腹和餐后兩個研究進行,各入組24例受試者,男女兼有。試驗每周期給藥1次,給藥劑量為10 mg,健康受試者隨機分為兩組,每組人數相等,清洗期為5 d。
受試者于給藥前一天入住研究中心,分配隨機號,晚上統一進清淡飲食,然后禁食至少10 h。受試者于給藥前1 h內于前臂放置靜脈留置針。
空腹試驗:受試者于試驗當天上午空腹隨機接受單劑量口服給藥,240 mL水送服,給藥后4 h內禁食,給藥前后1 h內禁水。受試者分別于給藥前1 h內(作為0 h)及用藥后0.17、0.33、0.5、0.75、1、1.33、1.67、2、3、5、8、12、24、48 h采集血樣4 mL,共計15個采血點。
餐后試驗:受試者于試驗當天上午給藥前30 min時進食試驗餐,30 min內用餐完畢,在開始進餐后30 min時準時接受單劑量口服給藥,給藥后4 h進食標準午餐。受試者分別于給藥前1 h內(作為0 h)及用藥后0.5、1、1.5、2、2.5、3、3.5、4、5、8、12、24、48 h采集血樣4 mL,共計14個采血點。
樣品采集與處理[11]:每次個采血點所有受試者血樣于采集完畢后60 min內置低溫離心機內,在2~8 ℃、1 500~2 000 ×g(2 500~3 000 r·min-1)下離心10 min,分離獲得血漿分裝為2管,其中1管為測試管,1份為備份管,2 h內放置低溫冰箱(-20 ℃)中。所有樣品采集并處理后放置臨床研究單位低溫冰箱(約-70 ℃)中暫存,直至樣品轉運。
所有測試樣本分析完成后轉移至低溫冰箱(約-20 ℃)長期保存。
2.3 血漿樣品的處理與測定 取樣品,待其完全融化后,混勻約30 s,移取50 μL樣品(空白樣品和內標空白樣品加50 μL的空白人血漿)至96孔板中,隨后分別加10 μL的IS-W溶液[空白樣品加入10 μL甲醇∶水(1∶1)],渦旋均勻,之后再加入0.5 mL乙腈,渦旋3 min,3 200×g、4 ℃條件下離心5 min,最后,取200 μL上清液至新的96孔板中,40 ℃氮氣流吹干,吹干后加入200 μL復溶液,渦旋3 min,提交LC-MS/MS分析。
2.4 LC-MS/MS條件 色譜條件:Luna 5 μm HPLC 200A 100×2 mm色譜柱;流動相為乙腈:0.4%甲酸水溶液(氨水調節pH至3.2),95∶5等度洗脫;流速0.4 mL·min-1;柱溫40 ℃;進樣量2 μL;自動進樣器溫度4 ℃;運行時間3.0 min。
質譜條件:美國應用生物系統公司的API 5500三重四級桿質譜儀;離子化方式為(+)ESI;掃描模式為多反應監測模式;質譜參數:離子源噴霧電壓(IS)5 000 V,氣簾氣(SUR)20 psi,離子源溫度(TEM)500 ℃,入口電壓(EP)10 V,碰撞氣(CAD)6 unit,出口電壓(CXP)15 V,停留時間(Dwell)100 ms,離子源氣體1為50 psi,離子源氣體2為50 psi,用于定量的離子反應分別為m/z 389.2→201.1(西替利嗪)和m/z 393.2→201.1(西替利嗪-d4)。
3 分析方法驗證[12]
3.1 標準曲線和定量范圍 配置質量濃度為50.0、100、250、1 250、2 500、12 500、22 500和25 000 ng·mL-1的標準曲線工作液,按“2.3”項下操作:以待測物濃度為橫坐標,待測物與內標物的峰面積比為縱坐標,用加權最小二乘法(1/X2)進行回歸運算,得直線回歸方程為Y=0.024 5X+0.001 4,R2=0.998 8(見圖1)。結果顯示鹽酸西替利嗪的線性范圍為1.00~500 ng·mL-1,定量下限為1.00 ng·mL-1。

圖1 人血漿中待測物的典型校正曲線
3.2 準確度和精密度 考察3個分析批次的質控(QC)樣品,每批次各考察低(QCL)、中(QCM)、高(QCH)3個濃度水平的質控樣品各6份,結果如表1顯示批內及批間RE均在±15%之內且滿足CV≤15%。

表1 準確度和精密度
3.3 選擇性 分別考察6批基質的不含內標/含內標空白血漿樣品,結果如表2顯示批基質對分析物測定的干擾為0.00,均小于20%分析物定量下限,同時對內標測定的干擾為0.00,均小于5%內標峰面積均值。考察1份只含內標的混合血漿樣品,對分析物測定的干擾為0.00,小于20%分析物定量下限。考察含定量上限的混合血漿樣品,對內標測定的干擾為0.00,小于5%內標峰面積均值。

表2 選擇性
3.4 提取回收率和基質效應 提取回收率考察低、中、高3個濃度質控樣品,每個濃度6份樣品,對比混合基質提取后添加的質控樣品與相應質控純溶液樣品,結果如表3顯示待測物3個濃度水平的質控樣品平均回收率分別為81.24%、101.82%、93.90%,總體回收率為92.32%,總體變異%CV為11.27;內標3個濃度水平的質控樣品平均回收率分別為87.95%、108.28%、97.70%,總體回收率為97.98%,總體變異%CV為10.41。

表3 基質效應
基質效應考察6批基質高、低2個濃度點的基質效應,對比提取后添加的質控樣品與相應質控純溶液樣品,計算基質因子和內標歸一化的基質因子,結果顯示待測物基質效應因子、內標基質效應因子、內標歸一化基質效應因子的%CV均小于15%。
3.5 穩定性 分別考察待測物及內標的儲備液和工作溶液在室溫條件下的短期穩定性及冷凍條件下長期穩定性,結果顯示待測物室溫放置22 h穩定,內標工作液室溫放置19 h穩定,內標儲備液室溫放置17 h穩定;待測物儲備液和內標工作液在低溫冰箱(約-20 ℃或-70 ℃)儲存55 d穩定。
4 數據處理與生物等效性分析[8,10]
4.1 藥動學參數 用于評價的主要藥動學參數包括:Cmax、AUC0~t、AUC0~∞、Tmax、t1/2、λZ。
藥代動力學參數計算由WinNonlin8.0版本完成,方差分析、等效性結果分析、人口學與安全性數據分析使用SAS 9.4版本軟件分析。受試者單次空腹或餐后口服鹽酸西替利嗪片受試制劑和參比制劑的藥動學參數如表4和表5所示。

表4 受試者單次空腹口服鹽酸西替利嗪片T、R的藥動學參數
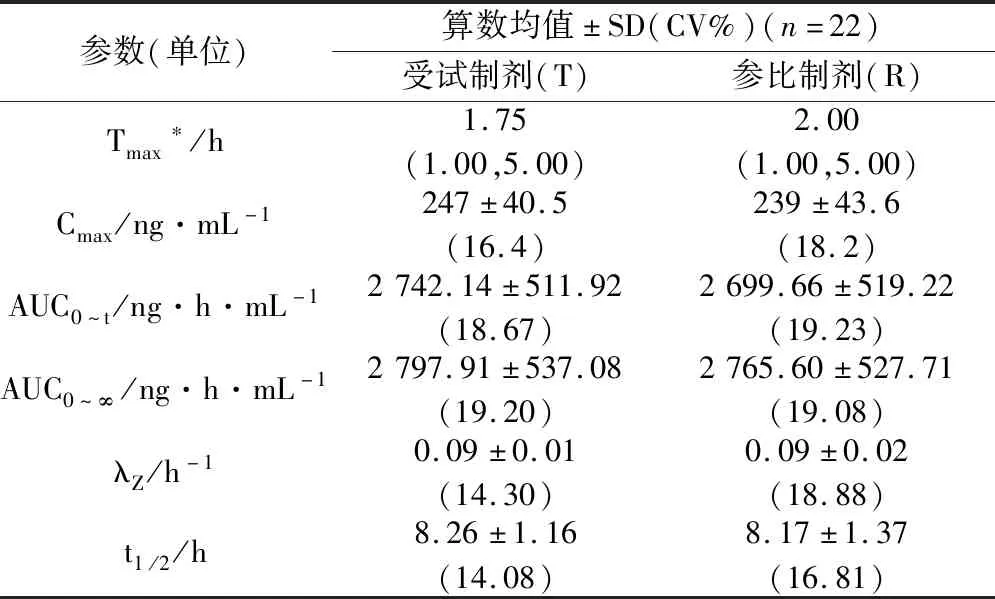
表5 受試者單次餐后口服鹽酸西替利嗪片T、R的藥動學參數
4.2 等效性判斷 采用西替利嗪的藥代動力學數據進行生物等效性評價。
藥物經時濃度數據采用實測值進行描述。將受試制劑與參比制劑的藥代動力學參數Cmax、AUC0~t、AUC0~∞經對數轉換后進行多因素方差分析在α=0.05水平上進行雙向單側t檢驗,對Tmax進行非參數檢驗。采用Cmax、AUC0~t、AUC0~∞幾何均值比的90%的置信區間,按照不低于80.00%,不高于125.00%,對兩種制劑空腹和餐后的生物等效性進行評價。
5 結果
空腹BE試驗:24名健康受試者分別單次空腹服用受試制劑和參比制劑10 mg后,Cmax、AUC0~t、AUC0~∞幾何均數的比值分別為100.18%、96.37%、96.00%,其90%置信區間分別為95.72%~14.84%、92.37%~100.55%、91.77%~100.42%,均落在等效區間80.00%~125.00%之間,藥動學參數的統計分析結果見表6,平均藥時曲線見圖2。

圖2 24名受試者分別空腹口服T、R后西替利嗪的平均藥時曲線

表6 藥動學參數的統計分析結果(空腹)
餐后BE試驗:22名健康受試者分別單次餐后服用受試制劑和參比制劑10 mg后,Cmax、AUC0~t、AUC0~∞幾何均數的比值分別為103.98%、102.19%、101.58%,其90%置信區間分別為98.31%~109.97%、98.33%~106.20%、98.07%~105.20%,均落在等效區間80.00%~125.00%之間,藥動學參數的統計分析結果見表7,平均藥時曲線見圖3。

表7 藥動學參數的統計分析結果(餐后)
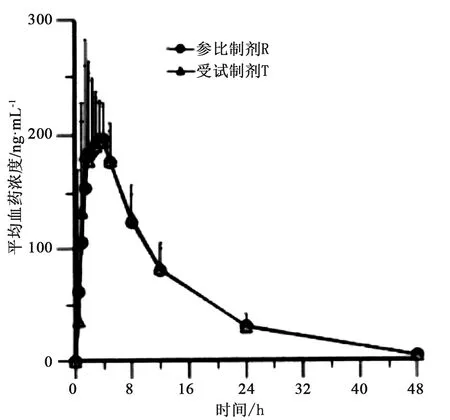
圖3 22名受試者分別餐后口服T、R后西替利嗪的平均藥時曲線
6 結論
研究表明,健康受試者空腹和餐后條件下單劑量服用鹽酸西替利嗪片受試制劑與參比制劑在人體內的藥代動力學參數AUC、Tmax、t1/2、Tmax均無顯著性差異,兩制劑具有生物等效性。
健康受試者單次空腹和餐后服用鹽酸西替利嗪片受試制劑與參比制劑的安全性一致且較好

