N-甲基咪唑氟硼酸鹽基低共熔溶劑的制備及其氧化脫硫性能
劉昊然,陳思宇,李秀萍,趙榮祥,毛 微
(遼寧石油化工大學 化學化工與環境學部,遼寧 撫順 113001)
燃燒含硫燃料會造成陰霾天氣和酸雨[1]。隨著環境法規的日益嚴格,生產超低硫的燃料油已成為煉油行業迫切需要解決的問題[2]。加氫脫硫技術(HDS)作為一種成熟的脫硫工藝,已在世界范圍內得到了廣泛的應用。然而,加氫脫硫需要高壓、高溫、大量的氫和高活性加氫催化劑[3]。同時,由于受到空間位阻效應的影響,在常規條件下加氫脫硫技術很難實現對噻吩類等芳香族有機硫化物的高效去除[4]。為了克服加氫脫硫的缺陷,許多非加氫脫硫技術(NHDS),如萃取脫硫、吸附脫硫、光催化脫硫和氧化脫硫[5-9]等獲得了廣泛的關注。由于氧化脫硫工藝具有不消耗氫氣、反應條件溫和及對于芳香族硫化物高脫除率等優點,因此被視為最有發展前景的技術之一。離子液體(ILs)是一種具有較低蒸氣壓的低溫熔鹽,可以作為綠色溶劑來代替傳統的揮發性有機溶劑[10-11]。到目前為止,許多學者都致力于設計復雜的ILs,以提高燃料的脫硫效率[12-14]。雖然ILs由于其獨特的物理化學性質似乎是一種理想的萃取劑,但是其存在生物降解性低、成本較高、合成過程復雜等缺點,阻礙了其工業應用[15]。
為了克服ILs的缺點,在21世紀初出現了新一代溶劑,稱為低共熔溶劑(DESs)[16]。DESs是由兩種或兩種以上成分通過氫鍵作用組成的共熔混合物,具有與離子液體相似的特性,其突出的優點是價格低廉,可生物降解,且不需要純化[17]。近年來,越來越多的學者將低共熔溶劑應用到油品的深度脫硫中。Hao等[18]合成了L-脯氨酸/對甲苯磺酸型低共熔溶劑并將其應用于氧化脫硫,在最佳條件下,L-脯氨酸/對甲苯磺酸對二苯并噻吩的去除率達到99%。Lü等[19]制備了TBAC/2C2H2O4型低共熔溶劑,并研究了其氧化脫硫性能,最佳條件下,油品脫硫率達到了98%。侯良培等[20]以甲基咪唑鹽酸鹽和草酸為原料,合成了[HMIM]Cl/H2C2O4型低共熔溶劑并將其應用于氧化脫硫,在反應溫度為40 ℃、反應時間為140 min的條件下,油品脫硫率可以達到92.2%。Chen等[21]用[Hnmp]Cl/ZnCl2型低共熔溶劑作為催化劑應用于柴油的氧化脫硫,最佳條件下柴油的脫硫率高達99.9%。Mao等[22]以ChCl/1.5CF3SO3H(CF3SO3H和ChCl的摩爾比為1.5)為催化劑和萃取劑,H2O2為氧化劑,研究了模型油的氧化脫硫性能,最佳條件下,模型油的脫硫率達到了98.65%。由此可見,低共熔溶劑對油品的深度脫硫展現了優良的效果,進一步開發此類低共熔溶劑具有重要的意義。
[HMIM]BF4是一種常規的離子液體,Lu等[23]考察了其氧化脫硫活性,在氧化脫硫過程中,其擔當了催化劑和萃取劑的雙重作用。結果表明,該離子液體只有在較高的反應溫度(90 ℃)和較高的氧/硫摩爾比(n(H2O2)/n(S)=10)條件下才表現出強的氧化脫硫活性。筆者所在課題組先前的工作中,以苯丙酸為氫鍵的供體,以氯化鋅為氫鍵的受體,合成了一種苯丙酸型低共熔溶劑。研究表明,該低共熔溶劑具有較好的氧化脫硫活性[24]。
筆者以N-甲基咪唑氟硼酸鹽([HMIM]BF4)和苯丙酸(C9H10O2)作為氫鍵配體,通過簡單加熱合成了一系列[HMIM]BF4/C9H10O2型酸性低共熔溶劑。將該酸性低共熔溶劑作為萃取劑和催化劑、雙氧水作為氧化劑,組成萃取-氧化脫硫系統,并將其應用于脫除模擬油中硫化物。分別考察了n(C9H10O2)/n([HMIM]BF4)、反應溫度、n(H2O2)/n(S)、低共熔溶劑的加入量和不同含硫化合物對脫硫率的影響和催化劑的回收利用,并探討了萃取-氧化脫硫反應的機理。
1 實驗部分
1.1 試劑及儀器
N-甲基咪唑(質量分數98%),浙江凱樂化工廠產品;氟硼酸(質量分數40%)、苯丙酸(質量分數98.5%)、正辛烷(質量分數98%),國藥集團化學試劑有限公司產品;四氯化碳(質量分數99%),天津市大茂化學試劑廠產品;二苯并噻吩(DBT,質量分數98%)、苯并噻吩(BT,質量分數97%)、4,6-二甲基二苯并噻吩(4,6-DMDBT,質量分數99%),阿拉丁試劑有限公司產品;H2O2(質量分數30%),遼寧泉瑞試劑有限公司產品。
微庫侖綜合分析儀(WK-2D),江蘇江分電分析儀器有限公司產品;傅里葉變換紅外光譜儀(FT-IR,NEXUS 870),美國尼高力儀器公司產品;AV-400型核磁共振儀(CH3OD為溶劑,TMS為內標),德國Bruker公司產品;旋轉蒸發器(RE-52),鞏義市予華儀器有限責任公司產品。
1.2 [HMIM]BF4/C9H10O2型低共熔溶劑的合成
[HMIM]BF4/C9H10O2型低共熔溶劑的合成過程如下:首先稱量等摩爾的N-甲基咪唑和氟硼酸,將氟硼酸逐滴加入N-甲基咪唑中,攪拌均勻,然后將混合液置于60 ℃水浴鍋中磁力攪拌1 h,用旋轉蒸發儀將混合液中的水分蒸出,最后得到的淡黃色黏稠液體即為[HMIM]BF4。將C9H10O2和[HMIM]BF4分別按照摩爾比0.5、1和2置于 100 mL 燒杯中,在90 ℃下加熱攪拌至完全熔融狀態,最終得到[HMIM]BF4/xC9H10O2(x=0.5、1、2)型低共熔溶劑。圖1為[HMIM]BF4/C9H10O2的合成路線。
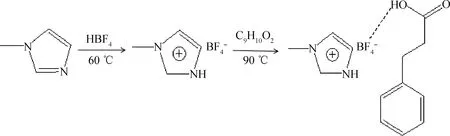
圖1 [HMIM]BF4/C9H10O2的合成
1.3 氧化脫硫過程
將一定量的DBT、4,6-DMDBT、BT分別溶入到體積均為500 mL的正辛烷中,配制成硫質量分數均為500 μg/g的模擬油。分別將5 mL模擬油、一定量的低共熔溶劑和H2O2加入到100 mL三角瓶中,然后將其與冷凝裝置連接,保證密封良好,在一定溫度的水浴和磁力攪拌的條件下進行氧化脫硫反應。總反應時間為180 min,每隔20 min吸取少量上層的油相作為待測樣品。利用WK-2D微庫侖綜合分析儀測定其硫含量,按式(1)計算脫硫率η。
η=[(w0-wt)/w0]×100%
(1)
式(1)中,w0和wt為反應前、反應后油品中硫的質量分數,%;η為油品中硫化物的脫除率,%。
1.4 催化劑的回收
在氧化脫硫實驗完成后,利用傾倒法將上層油相與下層的DESs相分離。然后用等體積的CCl4對DESs相進行2次反萃取,采用旋轉蒸發儀將殘留在低共熔溶劑相中的CCl4蒸出,得到的淡黃色黏稠液體即是回收的DESs。將模擬油、H2O2和回收的DESs加入到100 mL錐形瓶中,在最優的條件下進行氧化脫硫循環實驗。
2 結果與討論
2.1 低共熔溶劑的表征結果
2.1.1 紅外分析和1H NMR分析
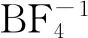
圖2 低共熔溶劑(DESs)的FTIR譜圖和1H NMR譜圖
為了進一步確定[HMIM]BF4和C9H10O2之間是否形成了氫鍵,分別對[HMIM]BF4、C9H10O2和[HMIM]BF4/0.5C9H10O2進行了1H NMR分析,結果如圖2(b)所示。由圖2(b)可知:C9H10O2在化學位移7.22、2.93和2.69處存在3個氫峰;[HMIM]BF4在化學位移8.58、7.40、4.69和3.90處存在4個相對較強的氫峰;在[HMIM]BF4和C9H10O2形成低共熔溶劑后,相比于[HMIM]BF4和C9H10O2,在化學位移4.69處的氫峰未發生移動,其他位置均發生了輕微的移動。由此可以證明[HMIM]BF4和C9H10O2之間產生了氫鍵作用[27]。
2.1.2 熱重分析
為了探究低共熔溶劑的熱穩定性,分別對C9H10O2、[HMIM]BF4和[HMIM]BF4/0.5C9H10O2進行熱重分析(TGA),結果如圖3所示。由圖3可以看出,在溫度達到100 ℃時,C9H10O2幾乎沒有質量損失,而[HMIM]BF4和[HMIM]BF4/0.5C9H10O2略有損失,分別為4.4%和3.5%。這可能是因為[HMIM]BF4和[HMIM]BF4/0.5C9H10O2中所含有的少量的水蒸發造成的。同時發現,在溫度低于158 ℃時,[HMIM]BF4/0.5C9H10O2的熱穩定性略好于[HMIM]BF4,可能是因為[HMIM]BF4與C9H10O2之間形成的氫鍵提高了其熱穩定性[28]。當溫度高于158 ℃時,C9H10O2、[HMIM]BF4和[HMIM]BF4/0.5C9H10O2的質量損失速率逐漸提高。對于氧化脫硫反應,一般反應溫度均小于100 ℃,[HMIM]BF4/0.5C9H10O2在此溫度范圍具有較好的熱穩定性,因此適用于氧化脫硫反應。
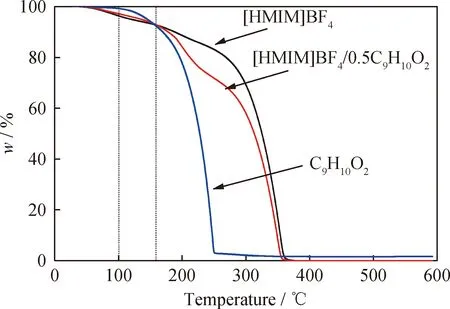
圖3 低共熔溶劑的熱重分析圖
2.2 低共熔溶劑的酸度對DBT脫除率的影響
合成的一系列[HMIM]BF4/C9H10O2型低共熔溶劑中C9H10O2與[HMIM]BF4的摩爾比(n(C9H10O2)/n([HMIM]BF4))決定著DESs的酸度,對其氧化脫硫性能有著顯著的影響。以[HMIM]BF4離子液體作為對比,探討C9H10O2的加入量對催化劑脫除DBT性能的影響,結果如圖4所示。由圖4看到,當僅加入[HMIM]BF4離子液體作為催化劑時油品的脫硫率比較低,反應 180 min 時僅為20%。當n(C9H10O2)/n([HMIM]BF4)為0.5時,反應180 min,油品的脫硫率可迅速升至84.8%。這表明[HMIM]BF4與C9H10O2混合而成的低共熔溶劑具有較好的脫硫性能。然而,當n(C9H10O2)/n([HMIM]BF4)分別為1和2時,反應180 min油品的脫硫率卻分別降到82%和75%。這可能是因為隨著C9H10O2量的不斷增加,導致催化劑的酸性過強,加快了H2O2的分解反應,抑制了氧化脫硫的進行,從而降低了油品的脫硫率[29]。因此,下面將選擇[HMIM]BF4/0.5C9H10O2作為最佳低共熔溶劑進行討論。
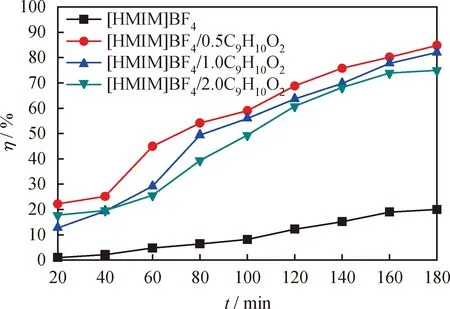
圖4 不同酸度的低共熔溶劑[HMIM]BF4/xC9H10O2(x=0.5、1、2)對DBT的脫除率(η)隨反應時間的變化曲線
2.3 氧化脫硫反應中影響油品脫硫率的主要因素
2.3.1 溫度的影響
圖5為不同反應溫度下[HMIM]BF4/0.5C9H10O2對DBT的脫除率隨反應時間的變化曲線。由圖5可知,[HMIM]BF4/0.5C9H10O2在不同溫度下對DBT的脫除率存在較大差異。當溫度從40 ℃升到60 ℃時,反應180 min時DBT的脫除率由13%增加到82.8%。這是因為低共熔溶劑的黏度隨著溫度的升高而降低,黏度降低會增加系統的傳質速率,從而提高了系統的脫硫率[30],此外,從熱力學角度分析,提高反應溫度也可增加氧化脫硫反應速率。然而,當溫度繼續升高到70 ℃,反應180 min時油品的脫硫率卻降到72.4%。這是因為H2O2在氧化脫硫過程中既有氧化反應也有分解反應,這是兩個相互競爭的反應,較高的溫度會增加H2O2的分解,從而降低了油品的脫硫率[18]。綜上所述,選擇 60 ℃ 作為最佳的反應溫度。
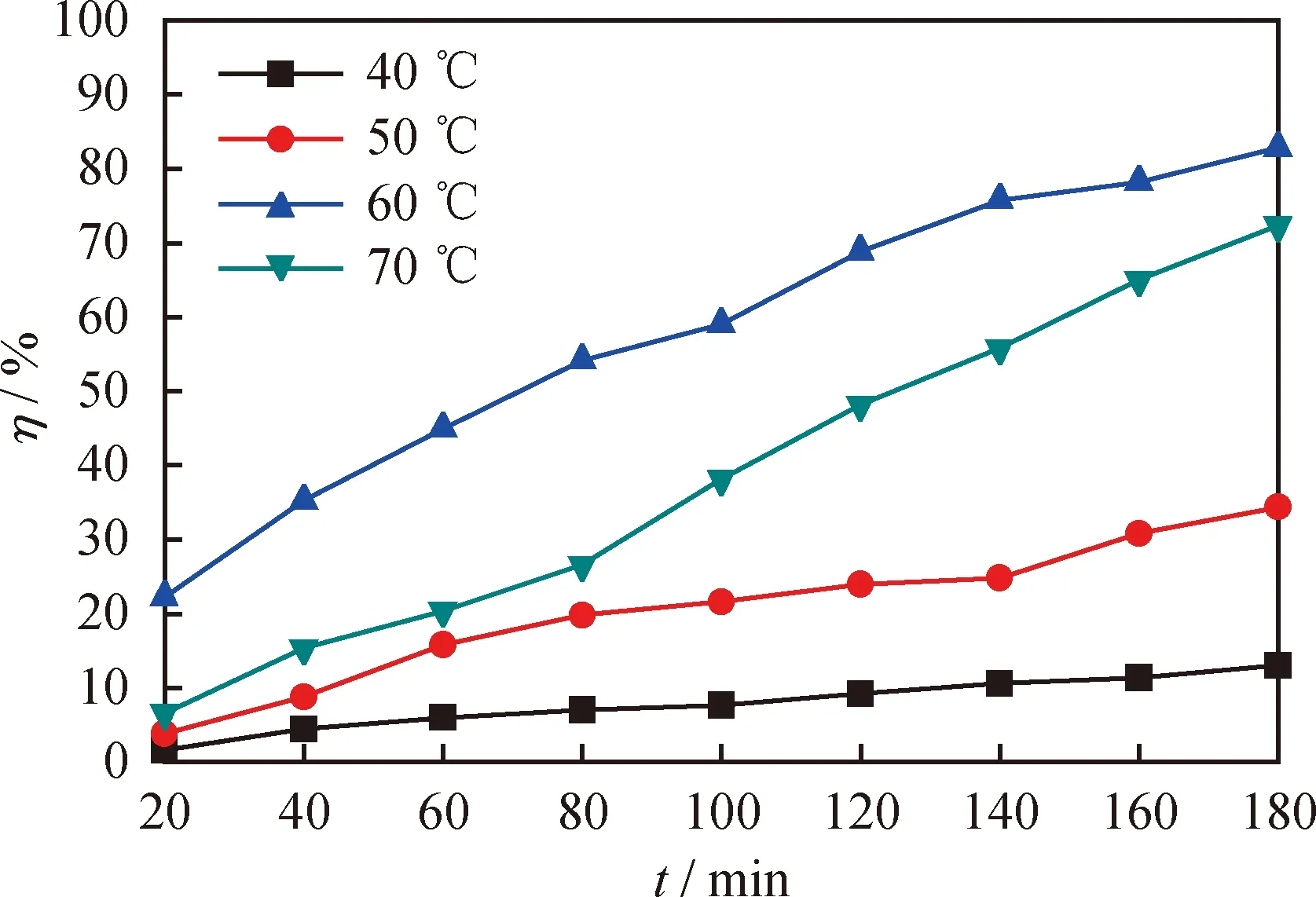
圖5 不同反應溫度下[HMIM]BF4/0.5C9H10O2對DBT的脫硫率(η)隨反應時間的變化曲線
2.3.2n(H2O2)/n(S)的影響
在氧化脫硫反應中,H2O2作為氧化劑,其加入量直接影響氧化脫硫的效果。不同n(H2O2)/n(S)對體系脫硫率的影響見表1。由表1可知,當n(H2O2)/n(S)為0時,模擬油的脫硫率僅為9.6%,這是因為此時反應體系中僅有模擬油和低共熔溶劑,屬于萃取脫硫系統,脫硫效果較差。當n(H2O2)/n(S)從2增加到8時,模擬油的脫硫率從52.6%增至98.4%,脫硫效果改善明顯。這是因為在氧化脫硫反應中,隨著H2O2用量的不斷增加,H2O2會持續地促進過氧化物的生成,從而促進了氧化脫硫反應的進行[31]。當繼續增加n(H2O2)/n(S)到10時,模擬油的脫硫率下降到88.6%。這是因為隨著H2O2的持續增加,體系中的水也會持續增加,水的存在會抑制氧化脫硫反應的進行,從而導致了模擬油的脫硫率降低[32]。因此,最適宜的n(H2O2)/n(S)為8。
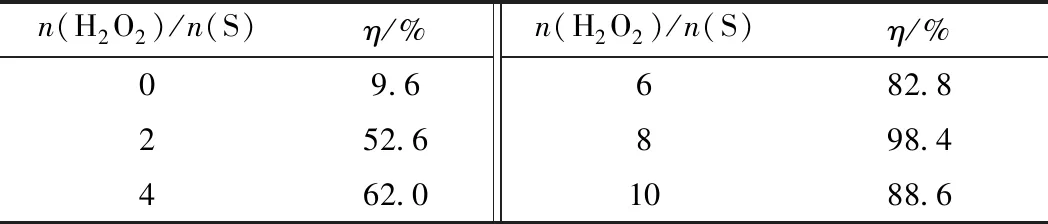
表1 不同n(H2O2)/n(S)下[HMIM]BF4/0.5C9H10O2對DBT的脫除率(η)
2.3.3 [HMIM]BF4/0.5C9H10O2加入量的影響
低共熔溶劑的加入量是影響氧化脫硫效果的重要因素之一,考察了[HMIM]BF4/0.5C9H10O2加入量分別為0.5、1.0、1.5和2.0 mL的條件下對DBT的氧化脫硫效果對比,結果見圖6。從圖6可以看出,當[HMIM]BF4/0.5C9H10O2的加入量由0.5 mL升高到1.0 mL時,反應180 min,對應模型油的氧化脫硫率由57.2%升高到98.4%。這是因為隨著[HMIM]BF4/0.5C9H10O2加入量的不斷增加,導致系統的萃取能力不斷提高,有利于將油相的DBT萃取到DESs相中,從而使更多的DBT參與氧化反應,提高了系統的氧化脫硫效率[33]。然而,當繼續增加[HMIM]BF4/0.5C9H10O2的加入量到1.5 mL和2.0 mL時,反應180 min,模型油氧化脫硫率分別降到90.6%和86.8%。這是因為在H2O2加入量恒定的條件下,持續增加 [HMIM]BF4/0.5C9H10O2的加入量會不斷地將DBT萃取到DESs相中,導致DESs相中的n(H2O2)/n(S)相應降低,從而導致DBT的脫除率降低[34]。綜合考慮,[HMIM]BF4/0.5C9H10O2的最佳加入量為1.0 mL。
2.3.4 不同硫化物的影響
由于實際油品中所含有的硫化物較為復雜,因此考察了[HMIM]BF4/0.5C9H10O2對不同硫化物的脫除效果,結果見圖7。由圖7可知,[HMIM]BF4/0.5C9H10O2對DBT、4,6-DMDBT和BT的脫除率有所差異,反應180 min時分別為98.4%、93%、89.6%。這主要是因為不同硫化物上S原子的電子云密度各不相同,4,6-DMDBT、DBT、BT上S原子的電子云密度分別為5.760、5.758、5.739,電子云密度越大則活性越高,越有利于硫化物的脫除[35]。然而,[HMIM]BF4/0.5C9H10O2對DBT的脫除率卻高于對4,6-DMDBT的,主要是因為4,6-DMDBT苯環上的2個甲基增加了其空間位阻,降低了S原子的活性,從而增大了氧化脫硫難度[36]。
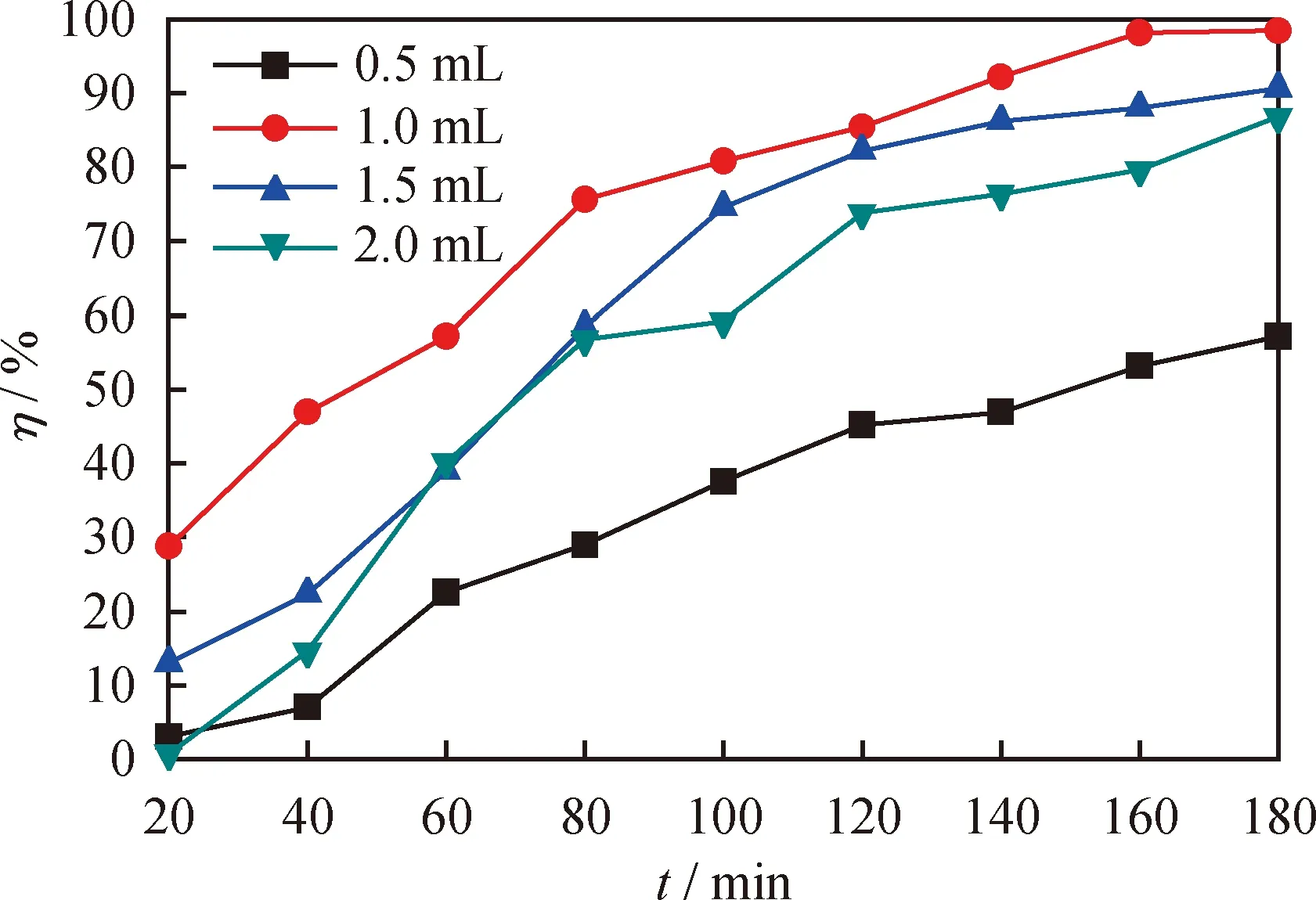
圖6 不同[HMIM]BF4/0.5C9H10O2加入量對DBT的脫除率(η)隨反應時間的變化曲線
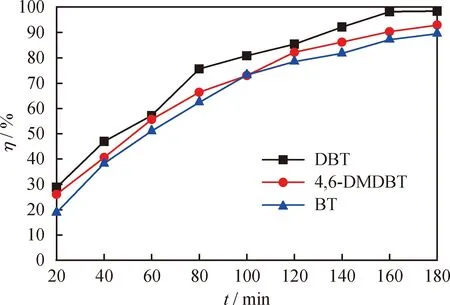
圖7 [HMIM]BF4/0.5C9H10O2對不同硫化物的脫除率(η)隨反應時間的變化曲線
2.4 不同硫化物脫除的動力學研究
研究表明,氧化脫硫過程符合偽一級動力學方程[37]。因此,可以用一級動力學方程式(2)進行模擬計算。
ln(w0/wt)=kt
(2)
式(2)中,k為反應速率常數,min-1;t為反應時間,min。
圖8為不同硫化物氧化脫除的動力學分析。由圖8可知,DBT、4,6-DMDBT、BT的動力學方程相關系數R2分別為0.97、0.99、0.99,均大于0.95,線性相關性良好,符合理論要求。不同硫化物對應的反應速率常數k分別為kDBT=0.017 min-1、k4,6-DMDBT=0.014 min-1、kBT=0.012 min-1,即kDBT>k4,6-DMDBT>kBT。由于斜率越大,反應速率越高,因此DBT最容易被氧化脫除,4,6-DMDBT次之,BT最差。這與實驗結果[HMIM]BF4/0.5C9H10O2低共熔溶劑對DBT、4,6-DMDBT、BT的脫除率排序(98.4%>93%>89.6%)一致。
2.5 氧化脫除DBT的表觀活化能
在化學反應中,活化能代表發生反應所需要的最低能量,其大小代表著反應進行的難易程度。通過一級動力學方程和Arrhenius方程[38]模擬計算氧化脫除DBT的活化能,結果如圖9所示。由圖9(a)可知,當反應溫度分別為40、50、60 ℃時,反應速率常數分別為0.0007、0.0022、0.0470。根據Arrhenius方程式(3)計算[HMIM]BF4/0.5C9H10O2低共熔溶劑氧化脫除模擬油中DBT所需的活化能(Ea)。
(3)
式(3)中,R為摩爾氣體常數,kJ/(mol·K);T為熱力學溫度,K;k為反應速率常數,min-1;A為指數前因子,min-1;Ea為表觀活化能,kJ/mol。由圖9(b)可見,在該萃取-氧化脫硫體系下脫除DBT的表觀活化能Ea=11.4 kJ/mol。較小的活化能表明低共熔溶劑具有較強的氧化脫硫活性。
2.6 [HMIM]BF4/ 0.5C9H10O2的回收利用
催化劑的回收利用可以作為衡量其穩定性的重要指標。表2為低共熔溶劑的循環使用對脫硫率的影響。由表2可知,[HMIM]BF4/0.5C9H10O2低共熔溶劑循環使用5次后,其脫硫率下降到90.2%。這可能是因為在回收[HMIM]BF4/0.5C9H10O2的過程中積累了二苯并噻吩砜等雜質,同時,[HMIM]BF4/0.5C9H10O2在回收過程中會有部分損失,從而導致了脫硫率的下降[39]。
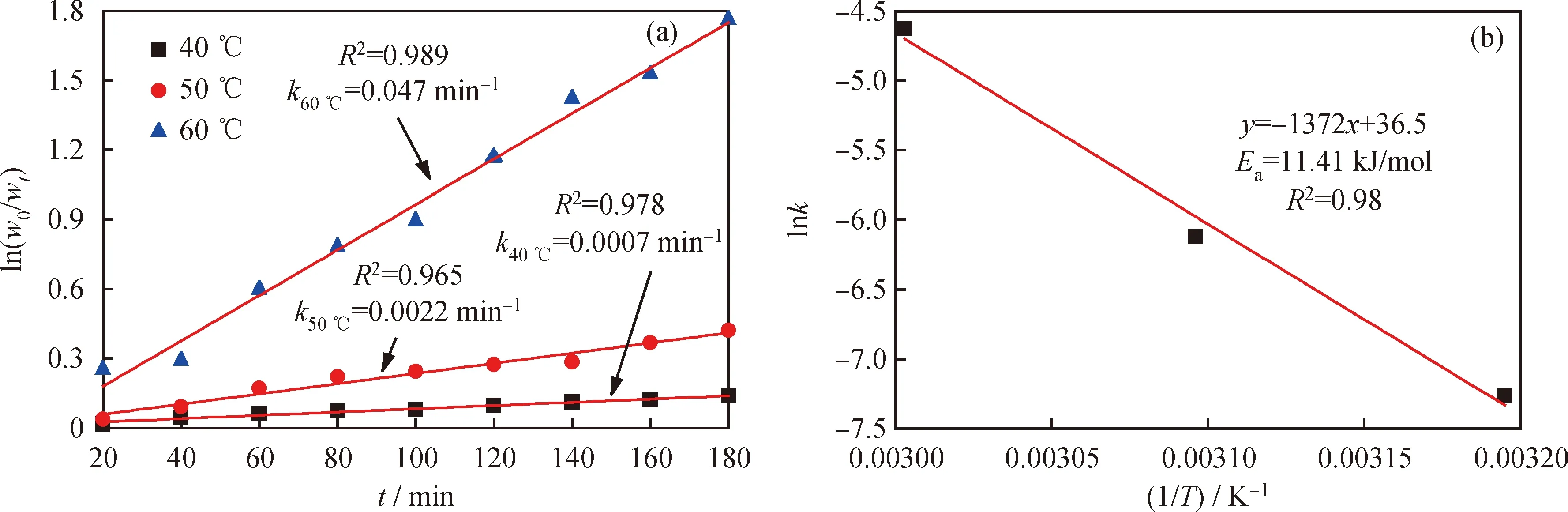
圖9 低共熔溶劑[HMIM]BF4/0.5C9H10O2氧化脫除模擬油中DBT的一級動力學反應模型和所需的表觀活化能
2.7 DBT氧化產物的紅外表征
為了進一步探究氧化脫硫反應中氧化產物的形式,分別對DBT及其氧化產物進行紅外表征,結果如圖10所示。由圖10可以看出,相比于DBT的紅外譜圖,氧化產物分別在1292、1166和1045 cm-1處形成了DBTO2(二苯并噻吩砜)和DBTO(二苯并噻吩亞砜)的特征吸收峰[40]。這說明在此萃取-氧化脫硫體系中,DBT被氧化成了DBTO2和DBTO。
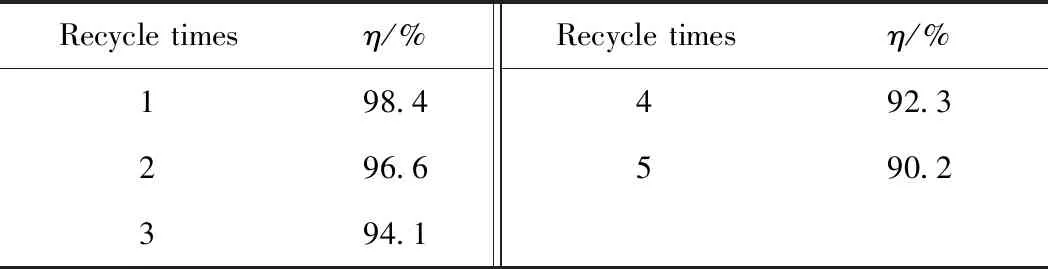
表2 低共熔溶劑[HMIM]BF4/0.5C9H10O2的循環使用對DBT脫除率(η)的影響
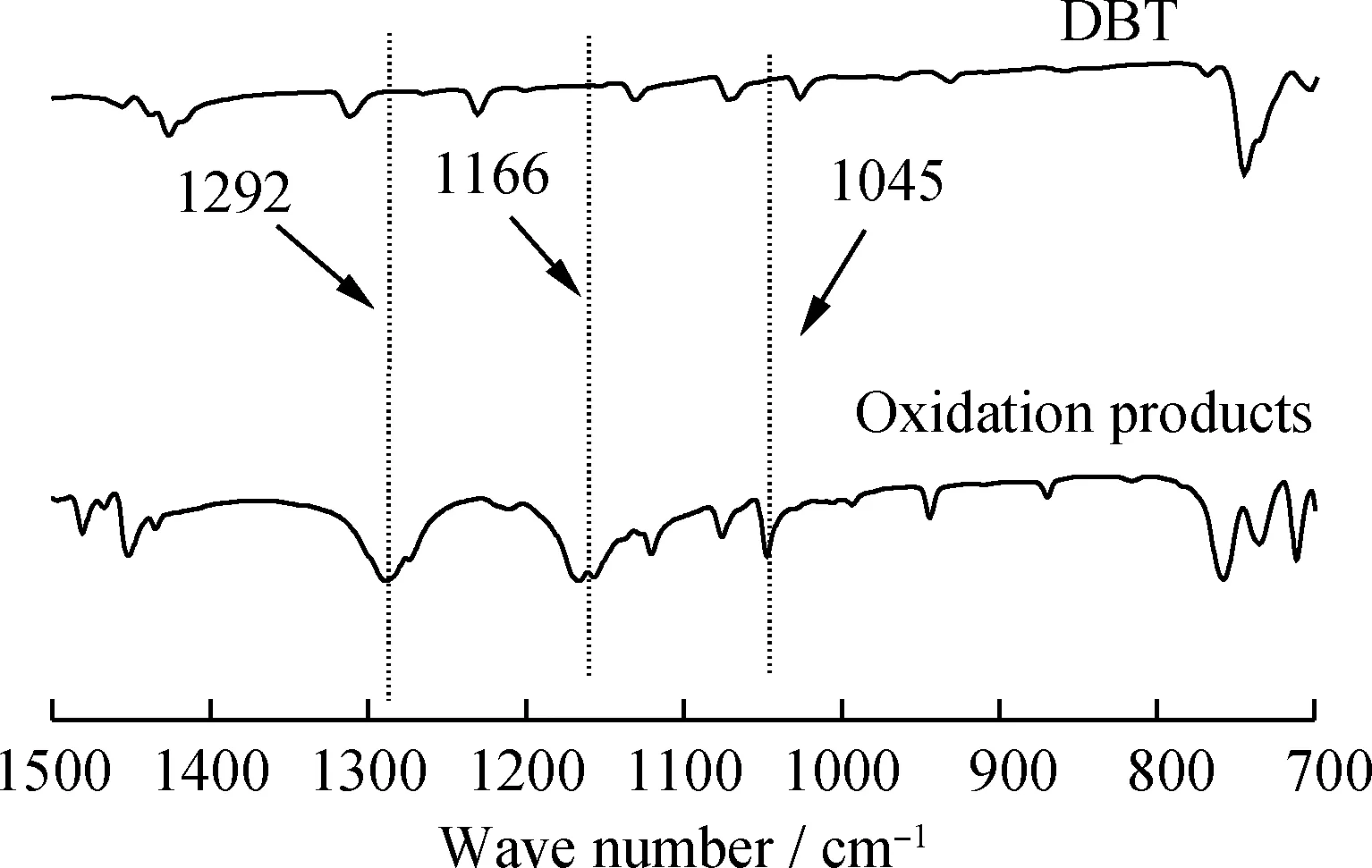
圖10 氧化脫硫反應中DBT和氧化產物的紅外譜圖
2.8 低共熔溶劑萃取-氧化脫硫機理
為了分析[HMIM]BF4/0.5C9H10O2對DBT氧化脫硫反應的萃取-氧化脫硫機理,分別對[HMIM]BF4/0.5C9H10O2、[HMIM]BF4/0.5C9H10O2-DBT(摩爾比1∶1) 和DBT進行紅外表征,結果見圖11。由圖11可知,DBT在1131、1067、743和702 cm-1的4個吸收峰在[HMIM]BF4/0.5C9H10O2-DBT 的紅外譜圖中發生了不同程度的衰退和消失,表明[HMIM]BF4/0.5C9H10O2與DBT之間發生了強烈的反應,導致DBT的結構發生“畸變”,從而降低了DBT的芳香性,使其更容易被氧化[41-42]。此外,[HMIM]BF4/0.5C9H10O2中的 C9H10O2可以被 H2O2氧化成相應的過氧化物形式 C9H10OO2,其具有將DBT氧化成DBTO2和DBTO的作用。
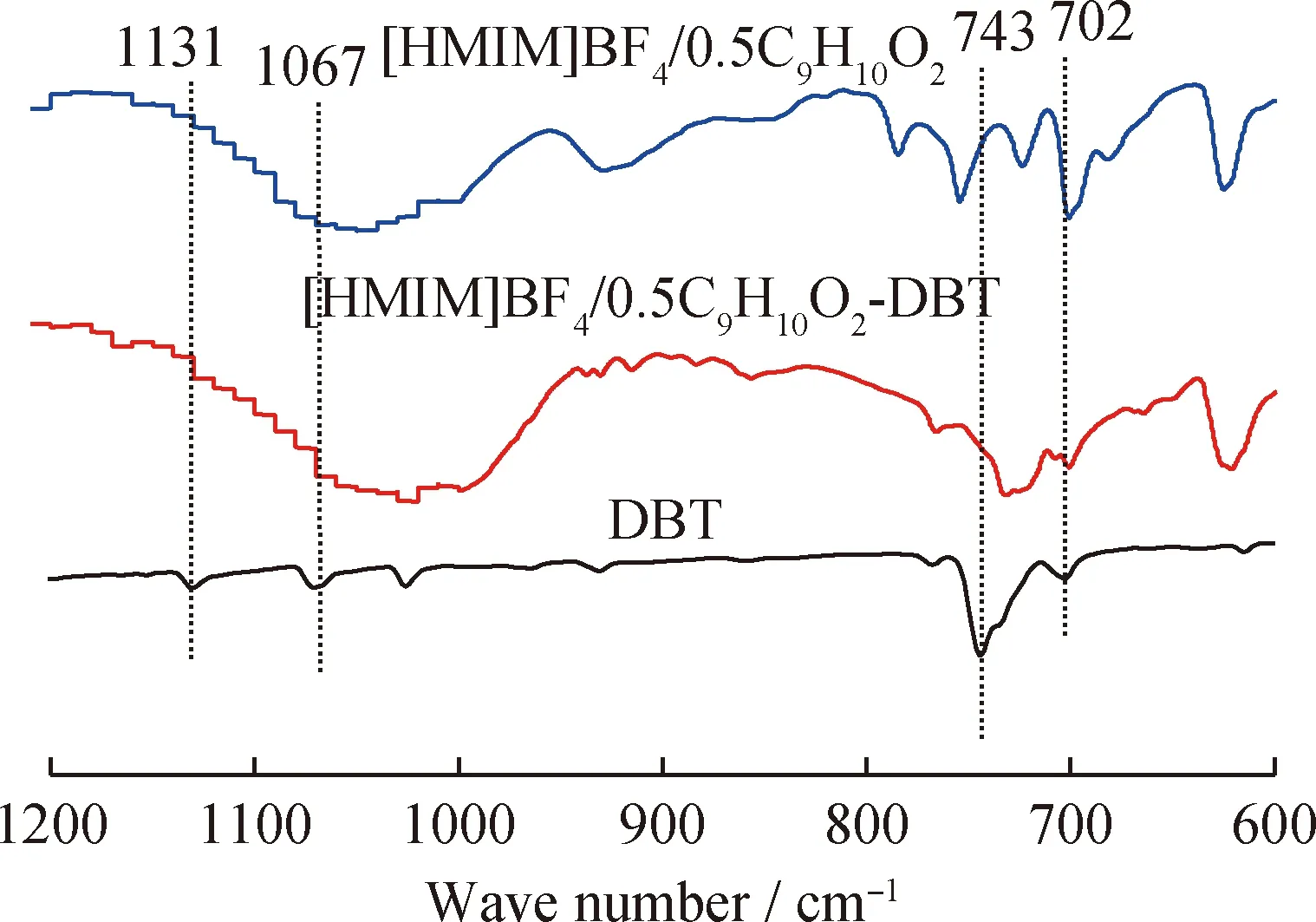
圖11 [HMIM]BF4/0.5C9H10O2、 [HMIM]BF4/0.5C9H10O2-DBT(摩爾比1∶1)和DBT的紅外譜圖
根據以上的分析,[HMIM]BF4/0.5C9H10O2的萃取-氧化脫硫機理如圖12所示。由于噻吩和咪唑都是五元環,因此[HMIM]BF4/0.5C9H10O2與DBT之間存在π-π共軛效應。[HMIM]BF4/0.5C9H10O2先將DBT從油相萃取到DESs相;被萃取到DESs相的DBT進一步與[HMIM]BF4/0.5C9H10O2相互作用,使得DBT的結構發生“畸變”;同時在H2O2的作用下,[HMIM]BF4/0.5C9H10O2會被H2O2氧化成相應的過氧化物[HMIM]BF4/0.5C9H10OO2,然后[HMIM]BF4/0.5C9H10OO2將“畸變”的DBT氧化成相應的砜。由于油相與DESs相之間的DBT存在濃度差,[HMIM]BF4/0.5C9H10O2可以持續地將油相中的DBT萃取到DESs相中。在氧化反應的進程中,[HMIM]BF4/0.5C9H10OO2還原后會再次被H2O2氧化,直至H2O2完全消耗或硫化物完全氧化。
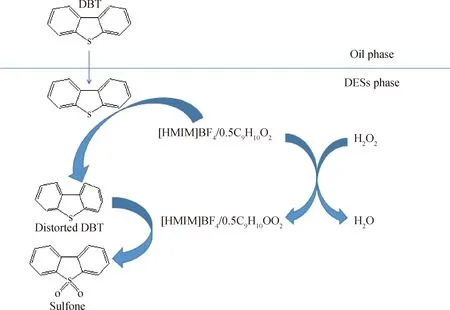
圖12 [HMIM]BF4/0.5C9H10O2脫除DBT的萃取-氧化脫硫機理
3 結 論
(1)對合成的不同配比的[HMIM]BF4/xC9H10O2(x=0.5、1、2)型低共熔溶劑進行FT-IR和1H NMR表征,結果表明[HMIM]BF4與C9H10O2存在氫鍵作用,TGA表征表明[HMIM]BF4/0.5C9H10O2在氧化脫硫反應溫度范圍內具有較好的熱穩定性。
(2)在模擬油體積為5 mL、n(C9H10O2)/n([HMIM]BF4)=0.5、反應溫度為60 ℃、反應時間180 min、n(H2O2)/n(S)=8、[HMIM]BF4/0.5C9H10O2的加入量為 1 mL 的最佳反應條件下,[HMIM]BF4/0.5C9H10O2對DBT的脫除率達到98.4%。同時,此低共熔溶劑具有較強的再生能力,循環5次使用后,模型油脫硫率仍高達90.2%。
(3)低共熔溶劑[HMIM]BF4/0.5C9H10O2與DBT之間存在相互作用,可促進氧化脫硫的進程。

