不同生態環境對羊肚菌非揮發性呈味物質的影響
謝麗源,蘭秀華,彭衛紅,甘炳成,*
(1.四川農業科學院土壤肥料研究所,四川成都 610066;2.電子科技大學生命科學與技術學院信息生物學研究中心,四川成都 610054)
羊肚菌(Morchellaspp.),隸屬子囊菌門(Ascomycota)、盤菌綱(Pezizomycetes)、羊肚菌科(Morchellaceae)、羊肚菌屬(Morchella)[1],是一種珍稀名貴食(藥)用菌,由于其菌蓋表面有不規則多面凹陷皺褶似羊肚而得名。羊肚菌因含有5′-核苷酸、有機酸、可溶性糖和氨基酸等多種非揮發性呈味物質,使其味道鮮美[2],同時,羊肚菌也是重要的藥用菌,含有多糖、生物酶類、鈣、鋅、鐵等多種礦物質等[3-4],具有抗氧化[5-8]、調節機體免疫力[9]、抗疲勞[9-10]、抑制腫瘤[9-10]、抗菌[11-12]、降血脂[13]等多種功效。
隨著羊肚菌馴化栽培技術的日趨成熟,羊肚菌種植區域范圍越來越廣,而不同的生態條件、種植方式,以及不同的基因型品種等都是影響羊肚菌等食用菌呈味物質的關鍵因素[3,6],而目前對羊肚菌非揮發呈味物質研究鮮有報道,對于不同生態條件對呈味物質的影響在食用菌尤其羊肚菌中研究更為少見。
本研究以同一遺傳背景、相同配套栽培方式,在四川不同生態環境馴化栽培的羊肚菌樣品為研究對象,分析不同產地羊肚菌非揮發呈味物質間的差異,并通過主成分分析(Principal cluster analysis,PCA)和聚類分析(Cluster analysis,CA)表征生態環境對羊肚菌品質差異,旨在為不同產區樣品的辨別和評價提供科學依據。
1 材料與方法
1.1 材料與儀器
羊肚菌 分別采集不同生態環境、相同遺傳背景(梯棱羊肚菌)、同一栽培基質(麥粒30%(下層)、木屑與土壤(體積比1∶1混合)70%(上層))和栽培方式(水旱輪作),來源見表1;可溶性糖、糖醇、有機酸、5′-核苷酸、混合氨基酸標準品 Sigma公司;乙腈、甲醇 均為色譜純,奧克生物科技有限公司。
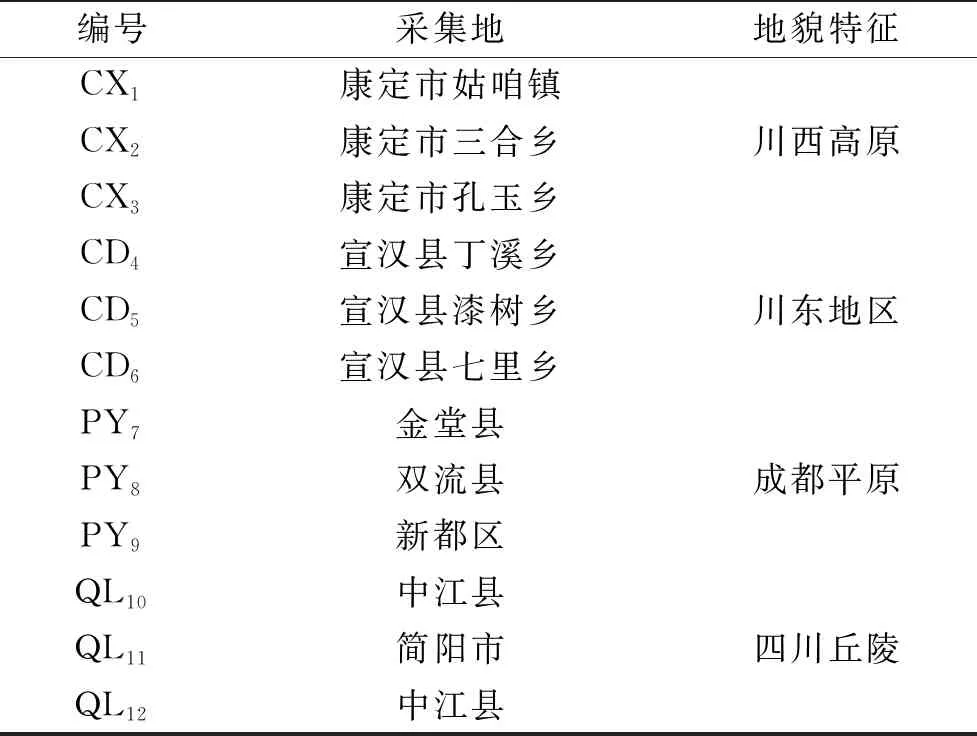
表1 樣品來源
Fw-80高速粉碎機 北京啟宏瑞達科技有限公司;DZF-6020真空干燥箱 上海精宏實驗設備有限公司;超純水裝置 Millipore公司;L-8900氨基酸自動分析儀 日本Hitachi公司;ALC-Z10.3電子天平 北京賽多利斯天平有限公司;UV1800分光光度計、LC-20 高效液相色譜儀 日本島津公司;ICS2500離子色譜儀、CarboPac PA-20陰離子交換分析柱、CarboPac MA1陰離子交換柱,美國Dionex公司 Green ODS-AQ C18色譜柱,上海易創儀器分析有限公司。
1.2 實驗方法
1.2.1 樣品處理 羊肚菌采集后經過挑選、烘干,粉碎后密封待用。
1.2.2 氨基酸測定 稱取100 mg樣品粉末加入水解管中,加入100 mL 6 mol/L的鹽酸,封管后,于100 ℃水解24 h,水解后樣品經處理后通過氨基酸自動分析儀進行氨基酸分析[14],測定3次。
1.2.3 可溶性糖、糖醇含量的測定 可溶性糖提取:取500 mg羊肚菌粉末,加入50 mL 80%乙醇,搖勻后于30 ℃搖床振搖45 min,抽濾。將濾渣用80%乙醇沖洗3次,取濾液于55 ℃真空旋轉蒸發去除乙醇,超純水定容至10 mL。將樣品12000 r/min離心10 min后進行一定濃度的稀釋,上清液過0.22 μm微孔濾膜,過離子色譜儀進行檢測[15-16],測定3次。
可溶性糖的檢測條件:單糖:CarboPac PA20陰離子交換分析柱(150 mm×3 mm);柱溫30 ℃;流動相為0.25 mol/L NaOH,流速為0.45 mL/min,進樣量25 μL;可溶性糖醇:CarboPac MA1陰離子交換柱(4 mm×250 mm);柱溫30 ℃;流動相為0.48 mol/L NaOH,流速為0.4 mL/min,進樣量25 μL,測定3次。
1.2.4 有機酸檢測 準確稱取500 mg羊肚菌干粉,加入50 mL 0.1 mol/L鹽酸,60 ℃、120 r/min振搖60 min提取有機酸。待冷卻后將提取液12000 r/min離心15 min,上清液過0.22 μm微孔濾膜由高效液相色譜儀檢測。色譜條件:Green ODS-AQ C18色譜柱(250 mm×4.6 mm);流動相為10 mmol/L KH2PO4緩沖鹽,pH2.8,流速1.0 mL/min;紫外檢測波長為210 nm;柱溫30 ℃;進樣量10 μL[15],測定3次。
1.2.5 5′-核苷酸檢測 取羊肚菌干品1 g,加入25 mL蒸餾水,煮沸1 min,冷卻至室溫后于12000 r/min 離心15 min,取出上清液,廢渣以相同方法重提一次,合并上清液,定容至50 mL。取上清液過0.22 μm微孔濾膜,高效液相色譜儀進行檢測。色譜條件:C18柱(250 mm×4.6 mm),流動相:KH2PO4緩沖液 0.5 mL/min,259 nm紫外掃描檢測,柱溫30 ℃;進樣量10 μL[17-18],測定3次。
1.2.6 等鮮濃度值計算 等鮮濃度值(equivalent umami concentration,EUC)常用來表征食品的鮮味程度,指在100 g干重的食物中,以谷氨酸鈉(MSG)的量來表示呈鮮物質的總量[19-21],計算公式為:
Y=∑aibi+1218(∑aibi)(∑ajbj)
式中:Y:EUC值,單位是g MSG/100 g;ai:呈鮮氨基酸(天冬氨酸Asp和谷氨酸Glu)的質量分數,%;aj:呈鮮核苷酸[5′-肌苷酸(5′-IMP)、5′-鳥苷酸(5′-GMP)、5′-黃苷酸(5′-XMP)、5′-腺苷酸(5′-AMP)]的質量分數,%;bi:呈鮮氨基酸相對MSG的鮮味程度值(Glu=1,Asp=0.077);bj:呈味核苷酸相對5′-核苷酸的值(5′-IMP=1、5′-GMP=2.3、5′-XMP=0.61、5′-AMP=0.18);1218:協同作用常數,g/100 g。
1.3 數據處理
采用IBM SPSS Statistics 22.0 對羊肚菌呈味物質進行顯著性分析、主成分分析和聚類分析。
2 結果與分析
2.1 不同生態環境羊肚菌鮮味游離氨基酸含量
天門冬氨酸和谷氨酸是食用菌鮮味的基本組成成分。食用菌所產生的鮮味是由谷氨酸鹽和呈味核苷酸共同作用的結果,它們使食用菌產生了各自特有的味道。不同生態環境羊肚菌子實體兩種氨基酸測定結果如表2所示。從表2中可以看出不同生態環境條件下馴化栽培羊肚菌游離氨基酸含量差異較大,天門冬氨酸含量為1.168%~2.828%,谷氨酸含量為2.307%~5.505%,且含量變化沒有隨著生長環境不同呈現一定規律性。

表2 不同生態環境條件下羊肚菌子實體中Glu和Asp的含量(%)
2.2 不同生態環境羊肚菌樣品可溶性糖、糖醇含量
食用菌中小分子可溶性糖和糖醇是其甜味的主要來源,其含量直接影響著食用菌的滋味和口感。由表3可知,12個羊肚菌樣品中檢測到8種可溶性糖和1種糖醇,其中海藻糖和甘露醇含量較高,且甘露醇是唯一檢測到的糖醇,含量在22.592~79.560 μg/g之間。由此可見,甘露醇和海藻糖是羊肚菌中可溶性糖和糖醇的主要成分,賦予羊肚菌爽口的甜味。

表3 不同羊肚菌樣品可溶性糖和糖醇含量(μg/g)
2.3 不同生態環境羊肚菌樣品有機酸含量
12個羊肚菌樣品共檢測到草酸、酒石酸、蘋果酸、甲酸、乙酸、檸檬酸、富馬酸、琥珀酸8種有機酸(表4),其中蘋果酸和乙酸是含量最為豐富的有機酸,含量范圍分別為1158.459~1785.933和1652.879~7976.853 μg/g,其次含量較高的是檸檬酸,含量范圍為174.581~831.232 μg/g,其余有機酸含量較低。

表4 不同羊肚菌樣品有機酸含量(μg/g)
2.4 不同生態環境羊肚菌5′-核苷酸差異分析
菌類食品中含有豐富的三磷酸腺苷,在各種特定生物酶的作用下可以發生降解反應,最終分解成相應的核苷酸。其中5′-核苷酸是典型的呈鮮味物質,這些呈味核苷酸不僅具有顯著的增鮮作用,而且對于動物性食品的各種滋味也有一定的增減作用[15,19]。對不同羊肚菌樣品進行5′-核苷酸檢測,結果如表5所示。羊肚菌樣品均檢出5種核苷酸5′-CMP、5′-AMP、5′-IMP、5′-GMP和5′-XMP,且5′-CMP、5′-AMP和5′-IMP含量較高,5′-GMP和5′-XMP含量較低。從單個核苷酸看,不同羊肚菌樣品沒有明顯的規律性,PY7、PY8的5′-CMP含量顯著高于其他菌株(P<0.05);CX1的5′-GMP含量最高(P<0.05),CX2、CX3和PY8其次,顯著高于其他菌株(P<0.05);QL10、QL12、QL11的5′-IMP含量依次降低,且顯著高于其余菌株(P<0.05);CX3的5′-XMP含量顯著高于其他菌株(P<0.05);5′-AMP含量較高的為QL11和QL12,且顯著高于其余菌株(P<0.05)。從總核苷酸含量看,不同生態環境的羊肚菌樣品沒有存在一定的規律性。

表5 羊肚菌子實體中5′-核苷酸的含量(μg/g)
2.5 等鮮濃度計算結果分析
研究表明,食用菌令人稱道的鮮味主要來源于5′-核苷酸及呈鮮氨基酸,表征食用菌鮮味的等鮮濃度值(EUC)是由此兩類物質計算而得,用以客觀評價食物的呈鮮作用[21]。12個羊肚菌樣品的EUC值如圖1所示。由圖1可知,12個羊肚菌樣品的EUC值為145.249~885.245 g MSG/100 g,其中QL12的EUC值最大為885.245 g MSG/100 g,其次為QL10和QL11,而PY7EUC值最小為145.249 g MSG/100 g。Tsai等[22]對EUC值劃分為四個水平:第一水平為EUC>1000 g MSG/100 g干重,第二水平為100 g MSG/100 g 圖1 不同羊肚菌樣品等鮮濃度 通過SPSS 22.0軟件對12個不同生態環境羊肚菌樣品的非揮發性呈味物質的相對含量進行主成分分析,分析得到各主成分的特征值、方差貢獻率、累積方差貢獻率。從表6可知,特征值大于1的共7個主成分,總方差94.169%,其方差貢獻率依次為32.978%、20.096%、13.911%、9.122%、7.986%、5.880%、4.196%,說明7個主成分反映了原始變量的絕大部分信息。因此構成羊肚菌非揮發性呈味物質由初始的24個降到7個不相關的主成分,成功達到了降維目的。 表6 非揮發性呈味物質主成分分析 通過PCA分析,得到羊肚菌樣品的主成分3D得分圖。由圖2可知,12個羊肚菌樣品可區分為3類,其中樣品QL10、QL11、QL12歸為1個集群,樣品CX1、CX2、CX3歸為1個集群,樣品PY7、PY8、CD4、CD5、CD6、PY9歸為1個集群。同一個集群樣品的非揮發性呈味物質成分相似。 圖2 12個羊肚菌樣品的主成分3D得分圖 采用系統聚類分析法,度量標準為平方Euclidean距離,通過組間連接方式,以有機酸、可溶性糖、糖醇、5′-核苷酸、呈味氨基酸等24個羊肚菌非揮發性呈味物質作為變量,對12個樣品的非揮發性物質進行聚類分析。由圖3可知,當刻度為5時,12個羊肚菌樣品可分為2個集群,樣品CX1、CX2、CX3聚為一個集群,剩下的9個樣品歸為1個集群;刻度為2.5時,9個樣品又可分為2個集群,樣品QL10、QL11、QL12為1個集群,樣品PY7、PY8、CD4、CD5、CD6、PY9歸為1個集群。CA與PCA的結果一致,說明二者的分析均可對12個羊肚菌樣品進行分類。通過分類結果可見,川西高原樣品CX1、CX2、CX3和丘陵地區樣品QL10、QL11、QL12分別聚為1類,成都平原和川東山區樣品PY7、PY8、CD4、CD5、CD6、PY9較為相似,聚為1類,說明成都平原和川東山區具有相似的栽培環境,由此可見相似生境馴化栽培的樣品聚為1類。 圖3 羊肚菌樣品聚類分析樹狀圖 隨著食用菌產業的不斷發展,人們對食用菌品質提出了更高的要求。由于食用菌的產量和品質不存在一定的正相關,有些品種產量高,而其成分品質往往低下。因此,不能僅僅從產量作為指標來評價食用菌優劣,成分分析更有利于食用菌品質評價。菌菇類的風味是由非揮發性成分和揮發性成分組成,揮發性成分是蘑菇致香物質的主體,而非揮發性成分決定了食用菌的味道,基本上都是由水溶性物質組成,包括5′-核苷酸、游離氨基酸、可溶性糖、糖醇、有機酸等。食用菌風味的差異是由風味成分的差異造成,而羊肚菌的獨特滋味主要也是源于這些非揮發性呈味物質成分的差異,這些物質具有的鮮味、甜味和酸味的共同作用賦予了羊肚菌獨有的口感和味道。 隨著羊肚菌種植技術成熟,種植區域范圍越來越廣,而各產地氣候、土壤等生態環境差異大,使得呈味物質特征表現形式多樣化,體現在主要組成物質的含量和比例不盡相同。這可能是在遺傳背景一致情況下,氣候、土壤、水質等環境條件會影響呈味物質的初級和次級代謝,使得積累的代謝產物在含量上存在一定差異。因此,生態環境是決定樣品代謝特征的重要因素。 食物的鮮味是氨基酸類鮮味物質和呈味核苷酸物質共同作用的結果。5′-核苷酸對甜味、肉味有增效作用,對咸、酸、苦味及腥、焦味有抑制作用。同時,5′-核苷酸可以增加蘑菇的鮮味,并且與MSG共同存在時,鮮味協同增強[23-27]。本研究表明,羊肚菌含有豐富的谷氨酸和天冬氨酸,且5′核苷酸種類齊全,包括了5個單核苷酸,5′-CMP、5′-AMP、5′-IMP、5′-GMP和5′-XMP。通過對不同羊肚菌樣品等鮮濃度值分析,不同羊肚菌樣品的等鮮濃度差別較大,但均屬于第二水平(100 g MSG/100 g 由于影響羊肚菌風味口感的非揮發性呈味物質指標種類多樣,且含量間不存在一定規律性,無法直接通過這些成分和含量對相似樣品進行判定、區分和聚集。因此,通過PCA和CA可以對不同羊肚菌樣品的非揮發性呈味物質進行綜合評價,將類似的對象組成多個聚類,為非揮發性呈味物質相似樣品的分類、聚集提供了理論依據,同時避免單一指標的片面性和不穩定性[28-30]。本研究通過PCA和CA統計分析發現,兩種方法得到的結果一致,相似生境馴化栽培樣品可以聚為1類,聚集一起的樣品滋味相似,可見不同生境條件一定程度上會影響呈味物質的代謝積累,從而使樣品存在差異。因此,PCA和CA可用于表征不同生境栽培馴化樣品非揮發呈味物質的差異,且2種方法可以相互檢驗。 不同生態環境下羊肚菌樣品均檢測到8種可溶性糖、1種糖醇及8種有機酸,種類豐富,含量不同,不存在一定規律性;羊肚菌中5′-核苷酸種類齊全,鮮味氨基酸含量豐富,等鮮濃度均處于第二水平(100 g MSG/100 g
2.6 羊肚菌非揮發性物質PCA


2.7 羊肚菌非揮發性物質CA

3 討論
4 結論

