QuEChERS-同位素稀釋-氣相色譜-串聯質譜同時測定植物油中16 種鄰苯二甲酸酯
曾少甫,胡長鷹,馮志強
(1.廣東省食品工業研究所有限公司,廣東 廣州 511442;2.廣東省食品質量監督檢驗站,廣東 廣州 511442;3.暨南大學食品科學與工程系,廣東 廣州 510632)
鄰苯二甲酸酯(phthalate esters,PAEs)通常簡稱為塑化劑。由于PAEs可提高塑料聚合物的柔韌性和耐久性[1],被大量的添加在塑料中改善塑料特性[2-3],是塑料中最常用、使用量最大的增塑劑。從結構上看,PAEs僅通過與聚合物鏈的弱二次分子相互作用增加其柔韌性,未與乙烯基聚合物基質共價結合,易從高聚物母體中遷移出來,如從塑料中遷移到土壤和水中,間接影響作物;或直接從食品接觸材料遷移進入食物和飲料中,對人體產生安全隱患[4-5]。迄今為止,PAEs已造成一定的環境污染,同時也成為食品的主要污染來源之一[6-8]。許多研究已表明,PAEs可能有生殖毒性、致癌作用、心臟毒性、肝毒性和腎毒性[9-12],同時,也被國際癌癥組織劃分為2B類致癌物。
食用油是人類飲食中最重要的一部分,由于PAEs具有親脂性[13],因此油脂在生產加工過程中易受到PVC管、塑料貯存容器和包裝材料的容器中PAEs的污染[14-15],這些污染給人們健康造成了嚴重的風險。歐盟現已制定了法規,對食品接觸材料內PAEs類向食品中的遷移限量要求,其最大殘留限量為鄰苯二甲酸二(2-乙基己基)酯(bis(2-ethylhexyl) phthalate,DEHP)1.5 mg/kg、鄰苯二甲酸二丁酯(dibutyl phthalate,DBP)0.3 mg/kg、鄰苯二甲酸芐基丁基酯(butyl benzyl phthalate,BBP)30 mg/kg和己二酸二(2-乙基己基)酯18 mg/kg[16]。根據衛生部增塑劑限量通知[17],我國現有標準規定僅將DEHP、DBP和鄰苯二甲酸二異壬酯的最高殘留量分別設定為1.5、0.3、9.0 mg/kg,相關法律法規需要進一步完善。
目前,針對PAEs的前處理方法主要有固相萃取法(solid-phase extraction,SPE)和凝膠色譜法。Guo Zhiyong等[18]采用SPE法結合氣相質譜測定火腿腸中6 種PAEs。Cavaliere等[6]使用氣相質譜-串聯質譜法,配合凝膠色譜法檢測橄欖油中6 種PAEs。但是,2 種操作過程均較繁瑣、耗時長、有損失,且塑料SPE小柱有潛在的塑化劑污染。QuEChERS(quick, easy, cheap, effective, rugged,and safe)最早由Anastassiades等[19]提出,其方法提高了提取的質量和實驗效率,基質適用范圍廣[7,20-21],現已廣泛應用于食品安全檢測,取得良好的效果[22]。董蔚等[23]采用QuEChERS,結合氣相色譜-質譜聯用技術檢測大麥中14 種PAEs類。Socas-Rodríguez等[24]用氣相色譜-串聯質譜法測定不同嬰兒食品中PAEs的含量。但是,迄今為止針對檢測食用油中PAEs的QuEChERS檢測方法的報道還相對較少。本研究利用QuEChERS對樣品前處理凈化方面進行優化,內標法定量,建立氣相色譜-串聯質譜法,檢測食用油中16 種PAEs,并對方法中食用油的基質效應(matrix effect,ME)影響進行評估,以期為植物油中PAEs類檢測提供依據。
1 材料與方法
1.1 材料與試劑
玉米油、花生油、葵花籽油均購自某油脂公司,經檢測為陰性樣品。
16 種PAEs標準品:鄰苯二甲酸二甲酯(dimethyl phthalate,DMP,純度99.0%)、鄰苯二甲酸二乙酯(diethyl phthalate,DEP,純度≥99.0%)、鄰苯二甲酸二異丁酯(diisobutyl phthalate,DIBP,純度≥98.5%)、DBP(純度≥99.0%)、鄰苯二甲酸二(2-甲氧基)乙酯(bis(2-methoxyethyl) phthalate,DMEP,純度≥98.0%)、鄰苯二甲酸二(4-甲基-2-戊基)酯(bis(4-methyl-2-pentyl) phthalate,BMPP,純度≥99.0%)、鄰苯二甲酸二(2-乙氧基)乙酯(bis(2-ethoxyethyl)phthalate,DEEP,純度≥99.0%)、鄰苯二甲酸二戊酯(dipentyl phthalate,DPP,純度≥97.0%)、鄰苯二甲酸二己酯(dihexyl phthalate,DHXP,純度≥98.0%)、BBP(純度≥98.0%)、鄰苯二甲酸二(2-丁氧基)乙酯(bis(2-butoxyethyl) phthalate,DBEP,純度≥99.5%)、鄰苯二甲酸二環己酯(dicyclohexylphthalate,DCHP,純度≥99.9%)、DEHP(純度≥98.0%)、鄰苯二甲酸二苯酯(diphenyl phthalate,DPHP,純度≥99.9%)、鄰苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP,純度≥99.0%)、鄰苯二甲酸二壬酯(dinonyl phthalate,DNP,純度≥97.0%) 北京曼哈格生物科技有限公司。
16 種PAEs氘代同位素:氘代鄰苯二甲酸二甲酯(dimethyl phthalate-3,4,5,6-D4,D4-DMP,純度98.6%)、氘代鄰苯二甲酸二乙酯(diethyl phthalate-3,4,5,6-D4,D4-DEP,純度99.8%)、氘代鄰苯二甲酸二異丁酯(di-iso-butyl phthalate-3,4,5,6-D4,D4-DIBP,純度99.0%)、氘代鄰苯二甲酸二正丁酯(di-n-butyl phthalate-3,4,5,6-D4,D4-DBP,純度99.0%)、氘代鄰苯二甲酸二(2-甲氧基)乙酯(bis(2-methoxyethyl) phthalate-3,4,5,6-D4,D4-DMEP,純度99.7%)、氘代鄰苯二甲酸二(4-甲基-2-戊基)酯(bis(4-methyl-2-pentyl)phthalate-3,4,5,6-D4,D4-BMPP,純度99.0%)、氘代鄰苯二甲酸二(2-乙氧基)乙酯(bis(2-ethoxyethyl) phthalate-3,4,5,6-D4,D4-DEEP,純度99.1%)、氘代鄰苯二甲酸二戊酯(di-n-pentyl phthalate-3,4,5,6-D4,D4-DPP,純度99.6%)、氘代鄰苯二甲酸二己酯(di-n-hexyl phthalate-3,4,5,6-D4,D4-DHXP,純度99.8%)、氘代鄰苯二甲酸丁基芐基酯(benzyln-butyl phthalate-3,4,5,6-D4,D4-BBP,純度99.0%)、氘代鄰苯二甲酸二(2-丁氧基)乙酯(bis(2-butoxyethyl)phthalate-3,4,5,6-D4,D4-DBEP,純度98.6%)、氘代鄰苯二甲酸二環己酯(dicyclohexyl phthalate-3,4,5,6-D4,D4-DCHP,純度99.0%)、氘代鄰苯二甲酸二(2-乙基)己酯(di-(2-ethylhexyl)phthalate-3,4,5,6-D4,D4-DEHP,純度98.8%)、氘代鄰苯二甲酸二苯酯(diphenyl phthalate-3,4,5,6-D4,D4-DPhP,純度99.0%)、氘代鄰苯二甲酸二正辛酯(di-n-octyl phthalate-3,4,5,6-D4,D4-DNOP,純度99.0%)、氘代鄰苯二甲酸二壬酯(di-n-nonyl phthalate-3,4,5,6-D4,D4-DNP,純度97.1%) 北京曼哈格生物科技有限公司。
乙腈、正己烷(均為色譜純) 美國Honeywell公司;丙酮(色譜純) 天津市康科德科技有限公司;乙二胺-N-丙基硅烷(ethylenediamine-N-propylsilane,PSA:40~60 μm) 天津博納艾杰爾科技有限公司;十八烷基硅烷鍵合硅膠(octadecyl bonded silica gel,C18:40~63 μm) 德國CNW科技公司;無水硫酸鎂廣州化學試劑廠;中性氧化鋁(層析用) 上海五四化學試劑有限公司。
凈化劑為PSA、C18、中性氧化鋁按照比例搭配,在使用前需要在150 ℃烘箱中烘烤4 h,冷卻至室溫后密封保存備用。
1.2 儀器與設備
7890 B-5977B氣相色譜-質譜儀 美國安捷倫科技有限公司;MS3 basic渦旋振蕩器 德國IKA公司;3K15離心機 德國Sigma公司;Research plus移液器 德國Eppendorf公司。
1.3 方法
1.3.1 標準溶液的配制
1 mg/mL PAEs標準儲備液:根據純度分別準確稱取16 種PAEs標準品各10 mg(精確至0.01 mg),用乙腈溶解定容至10.0 mL,于-18 ℃冰箱避光保存。
10 μg/mL PAEs標準工作液:準確量取PAEs標準儲備液100.0 μL,用乙腈定容至10.0 mL,于-18 ℃冰箱避光保存。
10 μg/mLD4-PAEs內標工作液:根據純度分別準確稱取D4-PAEs標準品各10 mg(精確至0.01 mg),用乙腈溶液分別溶解定容至10.0 mL配制成1 mg/mL的內標標準儲備液,準確量取100.0 μL內標儲備液,用乙腈配溶液容至10.0 mL制成10 μg/mL的內標工作液,-18 ℃冰箱保存。
混合標準工作系列溶液配制:準確量取PAEs標準工作液,用乙腈溶液提取的樣品空白基質提取液稀釋成5、10、25、50、100、250、500 μg/L系列質量濃度的標準混合工作溶液,加入內標工作液,使內標質量濃度均為0.10 μg/mL,用于制作標準曲線。
1.3.2 氣相色譜條件
色譜柱:Agilent HP-5MS(30 m×250 μm,0.25 μm);升溫程序:起始溫度60 ℃,保持1 min,以20 ℃/min的速率升溫至220 ℃,保持1 min,再以5 ℃/min的速率升溫至270 ℃,保持5 min,再以30 ℃/min的速率升溫至290 ℃;進樣方式為無分流進樣,進樣量為1 μL;進樣口溫度為260 ℃;輔助加熱區為290 ℃;載氣為氦氣(純度≥99.999%),流速1.0 mL/min;溶劑延遲6 min。
1.3.3 質譜條件
離子源溫度230 ℃;四極桿溫度150 ℃;電離方式為電子電離(高靈敏度源Xtr EI源);電子轟擊能量為70 eV;掃描方式采用選擇離子掃描(selected ion monitor,SIM)模式;定量方式為峰面積內標法定量,定量及定性離子見表1,SIM圖譜見圖1、2。
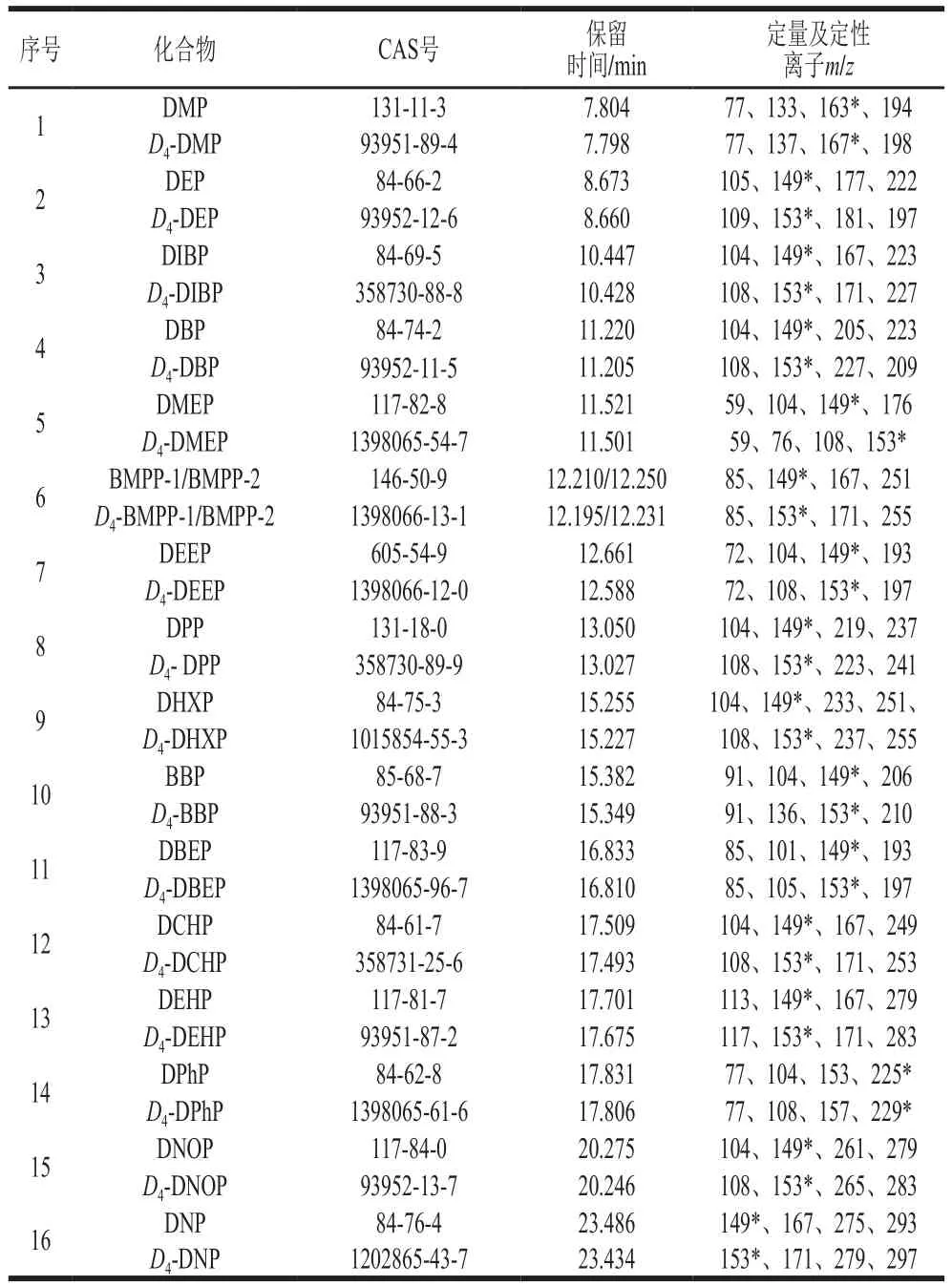
表1 16 種PAEs類化合物及氘代同位素內標保留時間和SIM參數Table 1 Retention times and SIM parameters for 16 PAEs and isotope internal standards
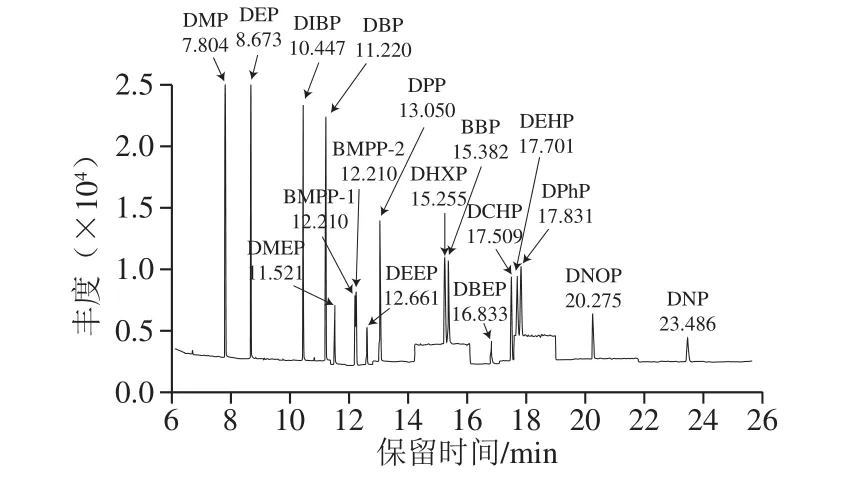
圖1 16 種PAEs類化合物的SIM圖譜(0.01 μg/mL乙腈)Fig.1 SIM chromatograms of 16 PAEs in acetonitrile (0.01 μg/mL)
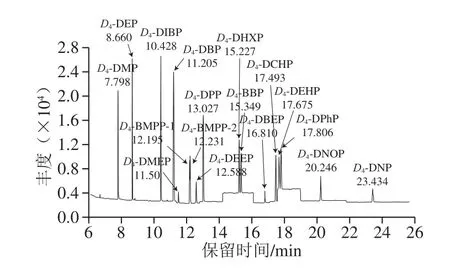
圖2 16 種PAEs類同位素化合物的SIM圖譜(0.01 μg/mL乙腈)Fig.2 SIM chromatograms of 16 PAE isotope compounds in acetonitrile (0.01 μg/mL)
1.3.4 QuEChERS樣品前處理
為了避免塑化劑的干擾,實驗過程中使用玻璃器皿,在洗凈后,需用丙酮浸泡3 h,再將玻璃器皿在150 ℃烘箱中烘烤4 h,冷卻至室溫備用。
均勻稱取樣品0.5 g(精確到0.01 g)于10 mL具塞玻璃離心管中,加入10 μL內標工作液,充分混勻,加入2 mL正己烷(與乙腈飽和)溶解樣品,渦旋30 s后加入4 mL乙腈(與正己烷飽和)提取,渦旋振蕩一定時間,超聲10 min,4 500 r/min離心5 min。棄去正己烷層,以乙腈層作為待凈化液。
將待凈化液轉移到玻璃凈化管中,依次加入無水MgSO4、凈化劑。渦旋充分混勻1 min,然后在4 500 r/min離心5min,取上清液于1 mL進樣瓶中,進行氣相色譜質譜分析。
1.3.5 提取效果評價
以加標回收的回收率作為指標評價提取效果[25]。
1.3.6 ME評價
由于基質組分在色譜柱中的與待測組分的共洗脫可以抑制或增強分析物信號,進而影響定量結果。在該研究中,為了評估ME,將在基質匹配校準中獲得的斜率與在標準溶液校準中獲得的斜率進行比較,并計算每種PAEs的基質/溶劑的斜率比[21]。使用下式計算ME:
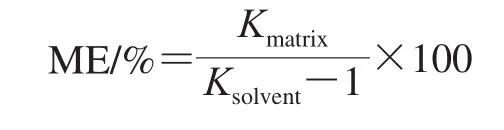
式中:Kmatrix為植物油基質匹配標準曲線斜率;Ksolvent為純乙腈溶液配制的標準曲線斜率。
1.4 數據統計分析
Agilent GC-MS MassHunter工作站進行數據分析,實驗數據統計分析采用SPSS(Version 19.0)進行進行數據處理。Duncan多重比較檢驗法進行顯著性分析(P<0.05)。采用OriginPro 8.0作圖,結果以 ±s表示。
2 結果與分析
2.1 提取試劑的優化
根據已有文獻研究[13,26-27],PAEs可用二氯甲烷、正己烷、乙腈和丙酮提取。本實驗使用乙腈(飽和正己烷)提取PAEs,這是基于脂肪在乙腈中的弱溶解度,分層效果好,同時一些干擾物質從植物油中被提取出來,例如甘油三酯、脂肪酸、色素等[28],因此提取物需要進一步凈化。由于植物油中甘油三酯占比大,用乙腈提取會造成共萃物多,干擾嚴重,而正己烷易于溶解甘油三酯,是最常用的去油脂溶劑,因此在乙腈提取前先加入正己烷(飽和乙腈),再通過高速離心減弱乙腈相中的甘油三酯,達到一定的凈化效果。
2.2 提取時間的優化
渦流攪動能加速萃取溶劑分散到液體樣品中,從而提高了提取效率[29]。依照1.3.4節的步驟做加標回收實驗(加標量為0.3 mg/kg),在旋轉速率3 000 r/min下研究了不同的渦旋時間(0.5、1.0、2.0、4.0 min)的加標回收效果。如圖3所示,在0.5~2 min時間內,隨著渦旋時間的延長,回收率增加,并在2 min后趨于穩定。當渦旋時間為2 min時,16 種PAEs的回收率保持在90.56%~100.97%,當到4 min時,回收率達到90.03%~100.86%,已平衡穩定。因此選擇2 min作為最佳渦旋時間。
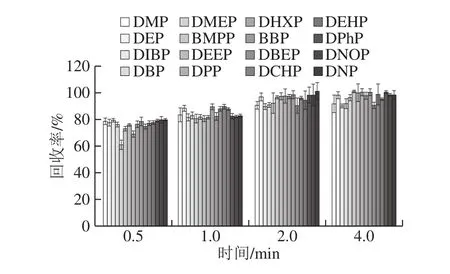
圖3 提取時間對玉米油中16 種PAEs回收率的影響(n=6)Fig.3 Effect of extraction duration on the recoveries of 16 PAEs from corn oil (n = 6)
2.3 提取溶劑體積的優化
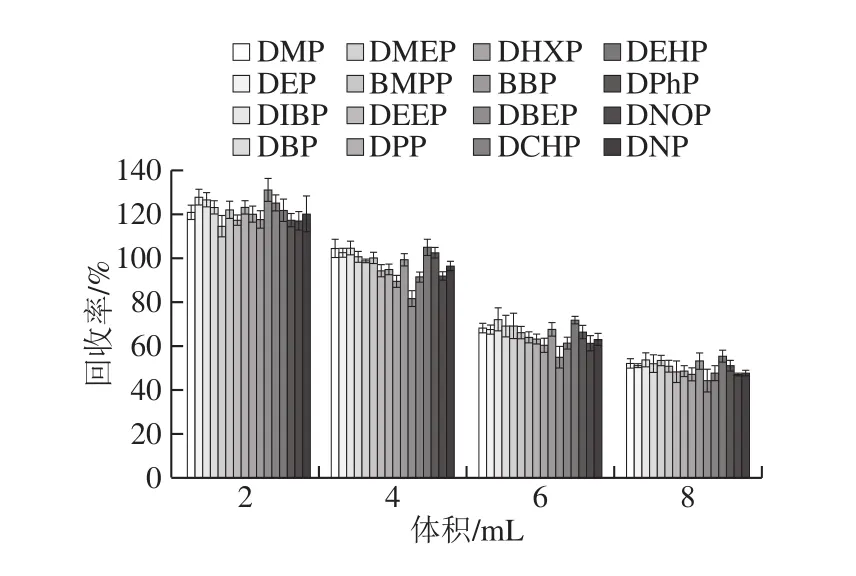
圖4 提取溶劑體積對玉米油中16 種PAEs回收率的影響(n=6)Fig.4 Effect of extraction solvent volume on the recoveries of 16 PAEs from corn oil (n = 6)
如圖4所示,隨著乙腈用量增加,各PAEs的回收率顯著降低(P<0.05)。當乙腈用量為2 mL時,其回收率高達為114.45%~130.90%。當用量為8 mL時,其回收率僅為44.26%~55.51%。提取溶劑體積4 mL獲得最佳回收率,在81.78%~104.90%之間。
2.4 凈化劑的選擇
如果乙腈提取物未經進一步凈化,其中的脂肪酸,多酚化合物和色素會干擾PAEs的測定,并且隨著注射次數的增加,柱效會降低,色譜峰也會拖尾,儀器靈敏度會下降[28]。目前QuEChERS方法的凈化劑有C18吸附劑、PSA、中性氧化鋁等。按1.3.4節方法進行QuEChERS前處理提取,樣品加標量為0.3 mg/kg。分別使用PSA(100 mg/mL)、C18(100 mg/mL)、PSA+C18(50+50 mg/mL)和中性Al2O3(100 mg/mL)并結合100 mg/mL MgSO4的4 種不同組合方式進行凈化,比較不同組合方式16 種PAEs的回收率作來確認最佳的吸附劑。如圖5所示,C18的PAEs回收率在76.49%~129.31%,PSA回收率為60.21%~127.75%,Al2O3回收率為51.72%~121.87%,當使用PSA+C18萃取效率最高,16 種PAEs的回收率在76.56%~108.84%之間,滿足檢測要求。因此選擇PSA+C18作為最優凈化劑。
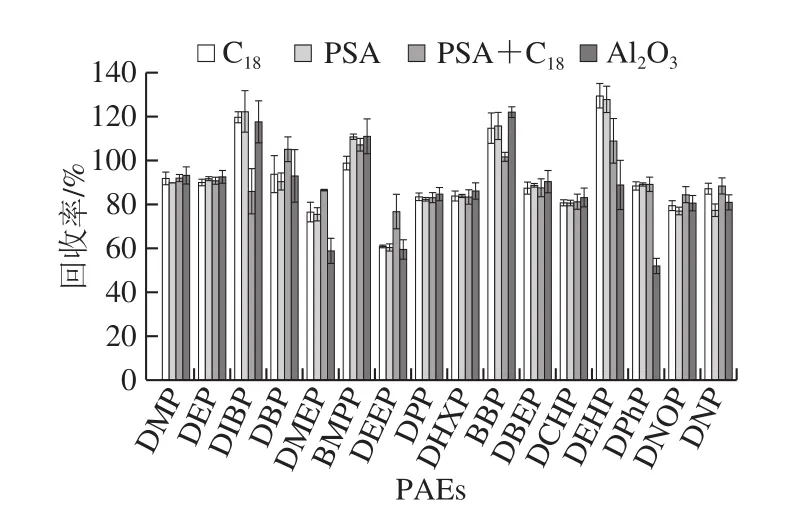
圖5 凈化劑的選擇對回收率的影響(n=6)Fig.5 Effect of purification adsorbents on the recoveries of 16 PAEs (n = 6)
同時,取未加標的玉米油樣乙腈提取物1 mL分別進行了25+25、50+50、100+100 mg比例的PSA+C18的凈化,以全掃描模式進行分析和對比凈化效果,其總離子流色譜圖如圖6所示。
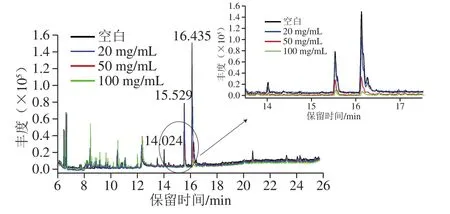
圖6 不同比例PSA+C18凈化后的玉米油樣乙腈提取物的總離子色譜圖Fig.6 Total ion current chromatograms of the purified corn oil acetonitrile extracts with different ratios of PSA + C18
主要峰在13.0~17.0 min被洗脫出來,通過NIST譜圖搜索匹配,發現主要有2,3-丙三醇脂十八碳烯酸異酯(14.024 min)、單亞油酸甘油酯(15.529 min)、亞油酰甘油(16.435 min)。隨著PSA和C18用量的增加,降低了玉米油乙腈提取物中的主要基質峰(保留時間13.0~17.0 min)(圖6),說明PSA+C18對于洗脫出來的3 種酯類有一定的凈化作用。根據相關文獻,由于PSA具有伯胺和仲胺2 個基團,比其他氨基功能團吸附劑碳載量高,與含有羥基或羧基的化合物形成氫鍵,能有效地去除脂肪酸和非極性脂質共提取物[19-20]。而C18凈化劑疏水性極強,能夠有效去除脂肪酸和色素,同時對非極性化合物具有較強的吸附作用[30]。
2.5 凈化劑用量的優化
吸附劑的量對凈化的效果及目標物的回收率有不同影響(加標量為0.3 mg/kg)。本研究分別考察25、50、100、150 mg的PSA及C18凈化每毫升玉米油乙腈提取物對16 種PAEs回收率的影響,結果如圖7、8所示。
隨著C18用量增加,各PAEs類塑化劑的回收率增加。對于DMEP、DEEP和DPhP 3 種PAEs塑化劑,當C18的用量為25 mg/mL時,其回收率為65.5%、54.7%和64.7%。當C18用量為100 mg/mL時,此時各PAEs有較好的回收效果,其回收率為72.2%~109.8%,因此最終選擇添加100 mg/mL C18為最優用量。
PSA用量100 mg/mL和150 mg/mL的16 種PAEs回收率可達66.2%~110.4%和65.9%~121.5%。用量為25 mg/mL時,16 種PAEs回收率低于其他3 種用量時的回收率,為56.5%~91.2%。而50 mg/mL顯示出相對更好的回收率,PAEs回收率為75.1%~108.2%,故選擇PSA用量為50 mg/mL作為最優用量。
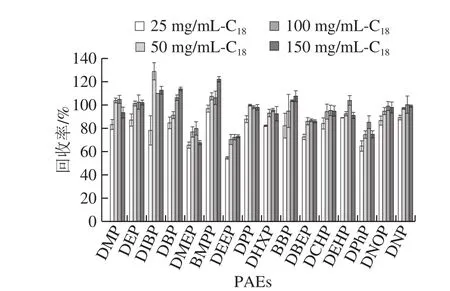
圖7 C18用量對16 種PAEs回收率的影響(n= 6)Fig.7 Effects of C18 dosage on the recoveries of 16 PAEs (n = 6)
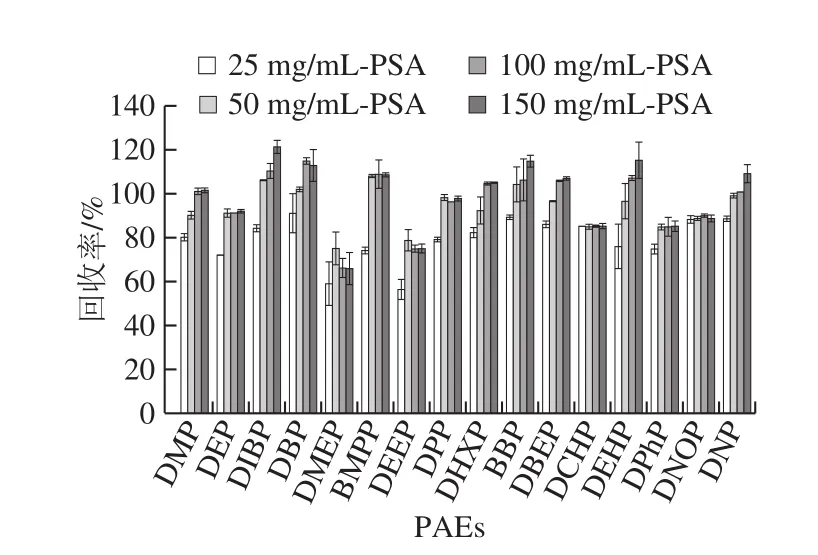
圖8 PSA用量對16 種PAEs回收率的影響(n= 6)Fig.8 Effects of PSA dosage on the recoveries of 16 PAEs (n = 6)
2.6 方法的線性范圍及檢出限
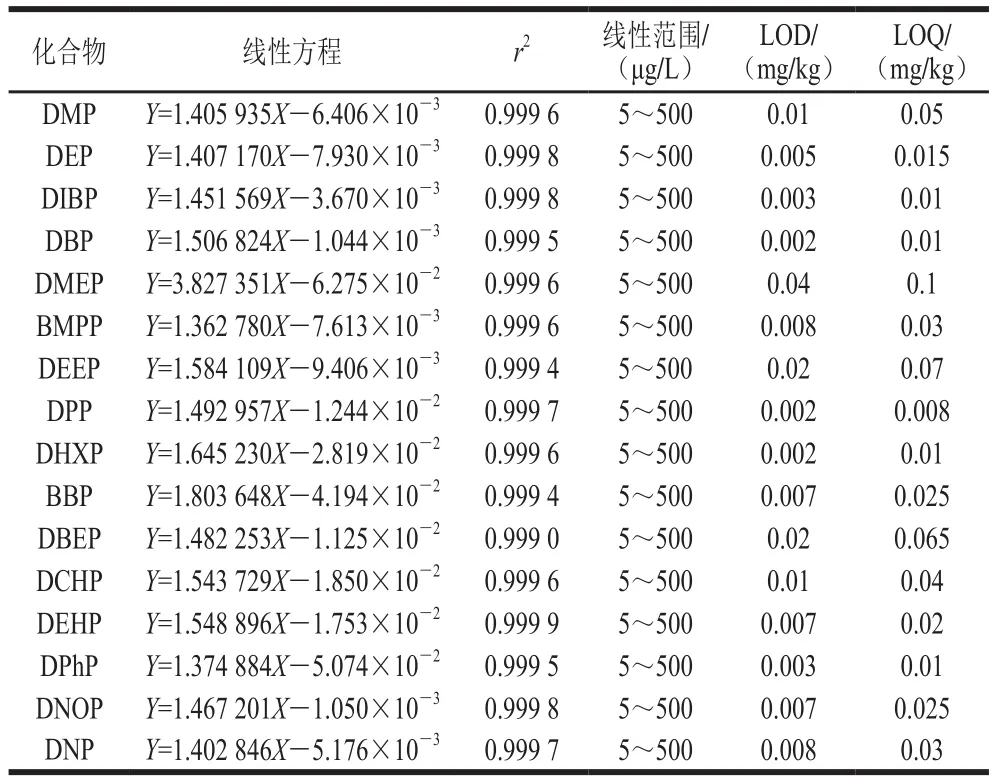
表2 16 種PAEs的線性方程、相關系數、線性范圍、方法LOD和LOQTable 2 Linear equations, correlation coefficients, linearity range,LODs and LOQs of 16 PAEs
由于存在ME影響,采用基質匹配標曲法繪制標準曲線對消除ME有一定的影響。按照1.3.4節的前處理方法,以陰性玉米油樣品提取液作為溶劑配制混合標準溶液,內標法定量。以1.3.1節中制備的混合標準溶液,形成系列水平的基質標準液。如表2所示,16 種PAEs在其線性范圍內的線性關系良好,相關系數r2均大于0.999 0。以信噪比RSN≥3確定檢出限(detection limit,LOD),信噪比RSN≥10確定定量限(quantification limit,LOQ),結果顯示該方法的LOD在0.002~0.03 mg/kg之間,LOQ在0.008~0.1 mg/kg之間。
2.7 回收率實驗
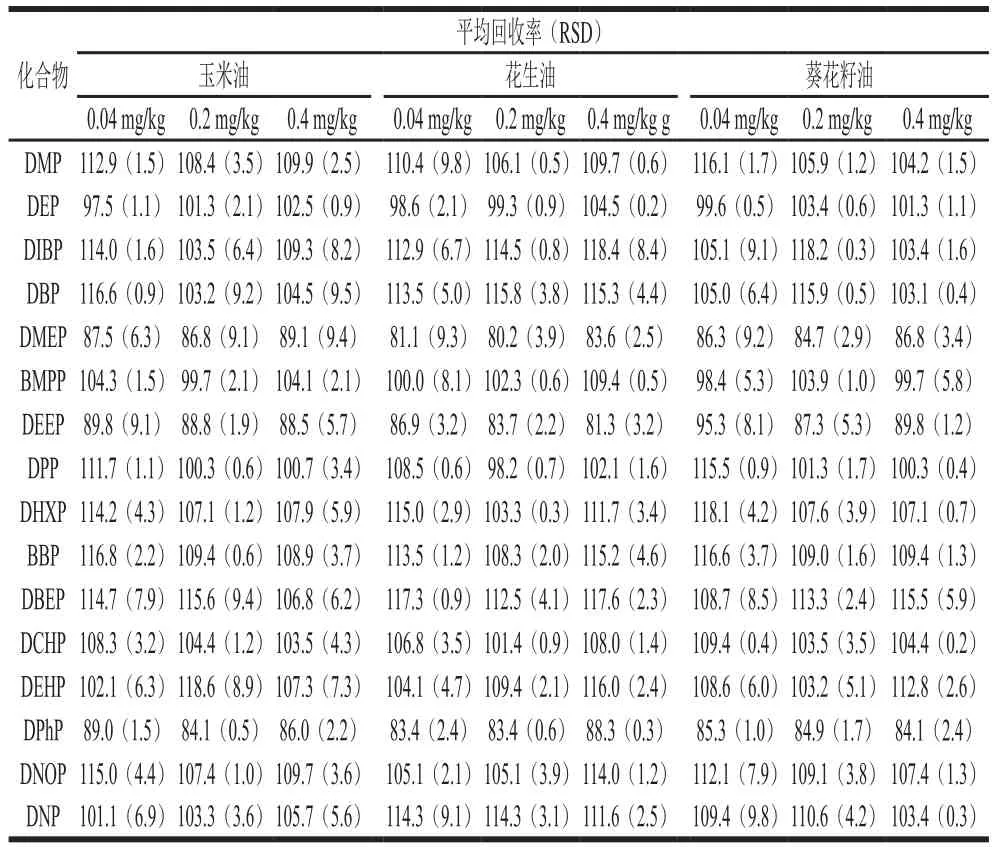
表3 16 種PAEs的加標平均回收率及精密度(n=3)Table 3 Average spiked recoveries and precision of 16 PAEs (n = 3)%
在空白植物油樣品中分別添加16 種PAEs混合標準溶液,低、中、高3 個加標量分別為0.04、0.2、0.4 mg/kg,每個水平測試6 個平行樣,并做一個樣品空白。按1.3.4節的樣品前處理方法以及優化好的QuEChERS方法進行提取和凈化,測得平均回收率和精密度如表3所示,玉米油中16 種PAEs的加標回收率為81.1%~118.6%,RSD為0.5%~8.9%;花生油加標回收率為80.2%~118.4%,RSD為0.3%~9.8%;葵花籽油加標回收率在84.1%~118.2%之間,RSD在0.2%~9.8%之間;3 種基質的平均加標回收率為80%~120%,RSD均不超過10%。結果表明該方法具有良好的準確度和精密度,符合分析要求。
2.8 不同ME的影響
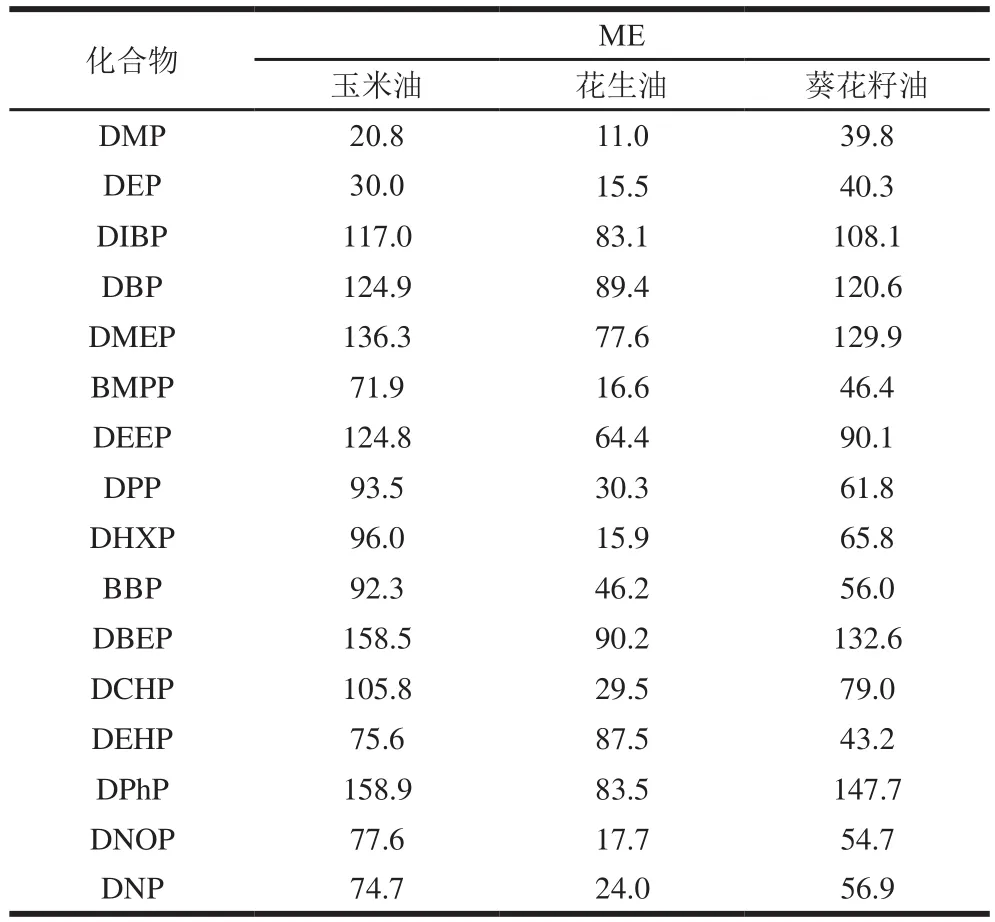
表4 3 種植物油中16 種PAEs的ME(n=3)Table 4 Matrix effects of 16 PAEs in three vegetable oils (n= 3)%
通過比較乙腈與基質匹配標準溶液,質量濃度范圍為5.0~500.0 μg/L,不同ME的影響如表4所示,與乙腈中的目標分析物相比,16 種PAEs的目標分析物信號有一定的增強,為基質增強效應,當ME<20%為弱基質效應,ME在20%~50%為中等基質效應,ME>50%為強基質效應[31]。從基質來看,花生油受基質影響小于其他2 種植物油,ME值為11.0%(DMP)~90.2%(DBEP)。玉米受基質影響最大,14 種PAEs的ME值均大于另外2 種植物油,為20.8%(DMP)~158.9%(DPHP)。從各分析物來看,DIBP、DBP、DMEP、DEEP、DBEP和DPHP均受到3 種植物油強ME影響,ME值在54.7%~158.9%之間。為減少ME引起的誤差,可以使用基質配標進行分析,獲得的結果較準確和真實。
3 結 論
本研究建立了QuEChERS結合GC-MS法檢測植物油中16 種PAEs殘留量得分析方法,以16 種氘代同位素PAEs作為內標,配合空白基質標準工作液進行定量。采用乙腈為提取溶劑,提取溶劑體積為4 mL,提取時間為2 min,QuEChERS凈化劑選擇為C18和PSA,分別為100 mg/mL和50 mg/mL。對其進行3 種植物油加標實驗,平均回收率在80.2%~118.6%范圍內,RSD為0.2%~9.8%,LOD在0.002~0.03 mg/kg之間,LOQ在0.008~0.1 mg/kg之間,符合PAEs的分析要求。對玉米油、花生油、葵花籽油的ME進行分析,其ME在11.0%~158.9%之間,為基質增強效應。本研究采用基質匹配法繪制標準曲線,降低ME的影響。本方法高效、簡便、快速,可作為植物油中16 種PAEs的定性和定量檢測手段。

