電針對骨骼肌鈍挫傷大鼠神經肌肉接頭重建相關蛋白MuSK和APP表達的影響*
房毓敏,楊娜娜,楊 光,趙 俊,羅 彤,王榮國,李志剛
(北京中醫藥大學,北京 100029)
骨骼肌損傷在肌肉損傷中所占比例最高[1]。研究表明[2]受損后的骨骼肌往往不能完全修復,這會導致骨骼肌正常功能受到影響,而影響骨骼肌不完全修復的關鍵因素就是損傷后造成的去神經支配[3]。神經肌肉接頭(NMJ)作為運動神經與骨骼肌的橋梁,是完成神經與肌肉信號傳導從而控制肌肉運動使肌肉重獲神經支配的重要結構和功能單位[4],因此越來越多學者認為研究骨骼肌損傷后NMJ的重建過程是研究受損骨骼肌再生和功能重建的關鍵環節。一直以來,乙酰膽堿受體(AChR)的簇集都被公認為是形成和維持NMJ的標志[5]。肌特異性受體酪氨酸激酶(MuSK)作為一種跨膜AChR藕聯酪氨酸激酶,是調控AChR簇集眾多信號通路中的關鍵性物質[6],在AChR簇集過程中起著非常重要的作用[7],研究表明MuSK蛋白的表達對于NMJ組織結構和功能的完整都是必須的[8]。淀粉樣前體蛋白(APP)存在于大腦的突觸結構和骨骼肌的NMJ中,是NMJ正常形成和功能所必需的[9],其可以通過不依賴于集聚蛋白的方式來誘導MuSK磷酸化[10],從而促進AChR的聚集。前期研究表明,電針可以促進骨骼肌損傷后神經肌肉接頭的重建[11],但相關機制的研究還不明確,所以本研究選取MuSK和APP這兩個具有代表性的蛋白來初步探討電針促進骨骼肌神經肌肉接頭重建的相關機制。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物和分組 SPF級健康成年雄性SD大鼠54只,體質量240~260 g,購自北京維通利華實驗動物技術有限公司,動物生產許可證編號:SCXK(京)2016-0006。實驗動物購入后于室溫23℃、空氣流通相對濕度60%、12 h晝夜循環光照的環境下適應性分籠飼養1周,在此期間自由進食飲水。實驗動物處置遵循中華人民共和國科學技術部2006年頒布的《關于善待實驗動物的指導性意見》[12]。適應性飼養結束后將54只實驗動物隨機分為3組:正常對照組(A組)、模型組(B組)和電針組(C組),每組18只。
1.1.2 主要儀器和試劑 韓式穴位神經刺激儀(HANS200E,南京濟生);急性骨骼肌鈍器傷砸傷器(北京中醫藥大學中日友好醫院);一次性無菌針灸針(華佗牌,0.25 mm×25 mm);DYY-6C 型電泳儀(BIO-RAD Mini-TRANS-BLOT CELL);DYCZ-24DN型迷你雙垂直電泳槽;TS-1 脫色搖床(太倉市實驗設備廠);生物分子成像儀(日本富士LAS-4000MINI);MuSK(abcam,ab228488);Amyloid Precursor protein(abcam,ab32136)。
1.2 動物模型建立及干預方法
1.2.1 動物造模 A組為正常對照組不予處理。B組和C組用3%戊巴比妥鈉腹腔注射麻醉,動物俯臥位右后肢外展,膝關節伸直,踝關節背伸呈90°位固定。用造模工具一次性打擊大鼠右后肢腓腸肌中段內側面,打擊面積1 cm2,動能2.45 J,為保證每只動物腓腸肌受損程度及部位一致,所有動物的造模均由一人操作完成。造模成功后局部皮膚未破損,脛腓骨無骨折,肉眼觀察腓腸肌中斷有明顯腫脹及瘀血。
1.2.2 干預方法 C組大鼠于造模后24 h用自制布袋固定,雙后肢伸直,取左側“足三里(ST36)”穴(參照《中國獸醫針灸學》),右側阿是穴(分別取在距損傷邊緣頭尾側10 mm處)作為針刺穴位,常規消毒,使用規格為0.25 mm×25 mm一次性無菌針灸針刺入5~8 mm,針刺后接HANS 200E穴位神經刺激儀。電針參數:0.4 mA,2 Hz,15 min/次[13],隔天1次,直到取材。A組和B組同步進行模擬固定,但不進行電針刺激。
1.3 取材及標本處理
各組分別于造模后第7、28、56天3個時間點各取材6只動物。沿打擊部位用鋒利的一次性刀片快速切取腓腸肌,用 PBS 緩沖液沖洗干凈后,一部分放入事前準備好的凍存管中,于液氮凍存0.5 h,然后轉移到-80℃冰箱。另一部分用4%多聚甲醛固定,備以石蠟切片及HE染色。
1.4 HE染色觀察
將取完材標本組織置于4%多聚甲醛溶液中固定24 h后,用石蠟將組織包埋后,使用石蠟切片機切片(4 μm),室溫,切片盒保存;使用二甲苯及各濃度乙醇進行脫蠟,蘇木素染色,分化,伊紅染色,脫水,透明,封片。于生物顯微鏡下觀察組織形態結構變化,經圖像采集系統收集圖片。
1.5 MuSK和APP蛋白表達水平測定
組織加入裂解液提取MuSK和APP蛋白,分裝,置-80℃冰箱待用。稱取等量蛋白樣品經SDS聚丙烯凝膠電泳分離后,并轉至聚偏二氟乙烯(PVDF)上,于封閉液中室溫振搖封閉2 h,再加入一抗進行雜交,于4℃反應過夜。TBST洗4次,加入二抗,室溫振搖反應1 h,洗3次,每次5 min,用ECL試劑進行化學發光反應,X線膠片曝光,顯影及定影。上述孵育和洗膜過程均在水平搖床上進行,膠片曝光在暗室內進行。
1.6 統計學分析
2 結果
2.1 各組組織形態學改變
HE染色結果顯示,損傷后7 d,正常對照組大鼠肌組織染色呈粉色,肌纖維排列整齊,其間有少量結締組織,形態結構清晰完整;模型組大鼠肌組織染色改變,肌纖維斷裂、降解、排列紊亂,出現大量炎性細胞浸潤,可見少量新生肌細胞形成;電針組較模型組相比炎性細胞較少,有大量新生肌細胞和少量結締組織形成,且排列趨于規則。損傷后28 d,模型組大鼠新生肌胞增多,肌纖維排列較為紊亂,結締組織增多,炎性細胞減少;電針組大鼠肌組織染色改變基本恢復正常,肌管融合肌纖維排列較為整齊,結締組織增多。損傷后56 d,模型組大鼠肌纖維進一步增多,排列逐漸整齊,結締組織增多,炎性細胞大量減少;電針組大鼠肌纖維排列整齊,損傷基本愈合,形態結構基本完整。見圖1。

注:A.對照組;B.7 d模型組;C.7 d電針組;D.28 d模型組;E.28 d電針組;F.56 d模型組;G.56 d電針組。圖1 各組腓腸肌組織形態觀察(HE染色,20×)
2.2 各組不同時間點MuSK蛋白表達
Western-blot檢測結果顯示,MuSK在正常大鼠骨骼肌中蛋白表達水平較低,損傷后7 d各組表達水平明顯升高,28 d達到高峰,56 d時表達下降。整個過程中各取材時間點,模型組始終高于正常對照組(P<0.05或P<0.01),且電針組高于模型組(P<0.05或P<0.01)。見表1、圖2。
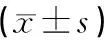
表1 各取材時間點MuSK蛋白表達的變化
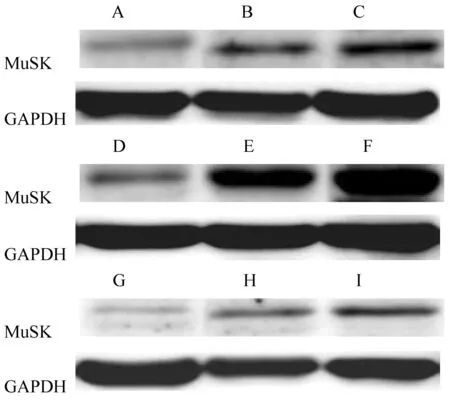
注:A.7 d對照組;B.7 d模型組;C.7 d電針組;D.28 d對照組;E.28 d模型組;F.28 d電針組;G.56 d對照組;H.56 d模型組;I.56 d電針組。圖2 各取材時間點MuSK蛋白表達量
2.3 各組不同時間點APP蛋白表達
APP在正常大鼠骨骼肌中的蛋白表達量較少,在隨后的損傷恢復過程中表達逐漸增多。與正常對照組相比,模型組在損傷后7 d時APP蛋白的表達均明顯升高(P<0.05),隨后逐漸增多,在28 d時增多最為明顯(P<0.05),在56 d時表達趨于穩定(P<0.05);與模型組相比,在7 d時電針組表達明顯增多(P<0.01),在28 d時達到峰值(P<0.05),在56 d時表達有所回落但仍高于模型組(P<0.01)。見表2、圖3。
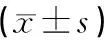
表2 各取材時間點APP蛋白表達量的變化

注:A.7 d對照組;B.7 d模型組;C.7 d電針組;D.28 d對照組;E.28 d模型組;F.28 d電針組;G.56 d對照組;H.56 d模型組;I.56 d電針組。圖3 各取材時間點APP蛋白表達量
3 討論
骨骼肌損傷屬于中醫“筋傷”的范疇。早在《靈樞·邪氣臟腑病形篇》中指出:“有所墮墜,惡血留內”;《醫宗金鑒·正骨心法要旨》云:“跌打損傷之癥,專從血論……皮不破而內損傷者,多有瘀血”;并且《雜病源流犀燭·跌撲閃挫源流》記載:“忽然閃挫,必氣為之震,震則激,激則壅,壅則氣之周流一身者,忽因所壅而聚在一處 ……氣凝在何處,則血亦凝在何處”,指出人體損傷后多形成瘀血,而己經生成的瘀血會阻滯正常氣血運行,造成局部氣血塞滯,從而使得皮肉筋骨經脈失于濡養,日久損傷局部會纖維化形成瘢痕組織,阻礙肌纖維和神經纖維的重新連接,導致神經信號傳輸障礙,從而延遲或阻礙NMJ重塑、減少運動神經元數量,導致骨骼肌功能下降。近年來,各種動物實驗與臨床實驗研究均表明電針在治療骨骼肌損傷方面有著值得肯定的療效,Wang等[14]研究證實電針足三里和阿是穴具有行氣活血的作用,能通過有效控制過度纖維化和改善微循環促進骨骼肌再生。張安寧等[15]研究發現電針足三里、阿是穴聯合跑臺訓練可以增加損傷骨骼肌mTOR表達量,正向調控myoG、Fast MyHC的表達,促進成肌細胞分化成熟,縮短骨骼肌損傷的治療療程。袁海洲[16]發現電針的刺激能促進受損更多的骨骼肌合成Agrin,進而加強AChR的募集促使受損骨骼肌功能的恢復。劉守堯[17]通過建立家兔腓腸肌急性鈍器挫傷模型,發現電針阿是穴與足三里能夠有效恢復損傷后電生理屬性。董明非[18]用電針治療肌肉拉傷患者30例,其中第1周治愈18例,占60%,第2周治愈12例,占40%,總治愈率達100%。黃瑩儀[19]以常規方法(冷敷和繃帶包扎)和電針法治療肌肉拉傷患者共48例(每組各24例),其中常規治療有效率為79.17%,電針治療有效率為95.83%,明顯高于常規治療組(P<0.05)。陳斌等[20]采用電針治療肌肉拉傷足球運動員46例,痊愈率達到100%。
受損骨骼肌恢復過程中NMJ的再生與重建是肌肉重獲神經支配的關鍵環節,而NMJ在發育和成熟過程中最具代表性的特征就是突觸后膜AChR的簇集,AChR的簇集情況體現了NMJ的發育和成熟情況[21]。MuSK作為骨骼肌特異性酪氨酸激酶受體,選擇性的由發育中的骨骼肌細胞表達并聚集在突觸后膜上,能夠在 NMJ 處與突觸后膜AChR聚集簇共定位[22],其蛋白水平可以在一定程度上反映NMJ發育調控的程度。MuSK與常規的酪氨酸激酶受體結構相同,含有1個信號肽、1個跨膜域、1個胞漿域和1個大的胞外域,這一胞外域結構可以與神經源性聚集蛋白Agrin反應,使MuSK被快速磷酸化,從而介導AChR的聚集[23], 但在這一過程中兩者并不是直接相互作用,而是通過一個MASC的共受體來介導[24],這個共受體就是低密度脂蛋白受體超家族成員 LRP4,研究表明LRP4胞外段的第一個β-螺旋槳卷曲結構能特異性結合z+Agrin蛋白C端的LG3結構域[25],從而以四聚體的形式激活MuSK,進而激活相應信號通路,導致突出分化,包括AChR的聚集[26]。目前Agrin/MuSK信號通路是AChR簇集過程中非常重要的1條信號通路,其中Agrin和MuSK共同發揮著主要作用,但Kim等[26-27]研究發現在AChR簇集過程中MuSK似乎發揮著更為重要的作用:MuSK基因敲除的小鼠在整個發育過程中根本不出現突觸后膜分化的特征,幾乎完全沒有AChR的聚集;而Agrin缺失的小鼠體內在突觸和非突觸部位仍能看到AChR的聚集過程。可見MuSK的表達對NMJ重建過程中AChR的簇集是必需的,MuSK蛋白表達異常會導致NMJ整體結構和功能的不完整[28]。本實驗研究發現正常大鼠骨骼肌中MuSK表達水平較低,在損傷后7 d表達顯著升高,28 d時達到高峰,隨后有所回落。提示在骨骼肌損傷后的修復過程中AChR在28 d時完成聚集,且在各取材時間點電針組的MuSK表達始終高于模型組,說明電針可以促進MuSK的表達,從而強化AChR的募集使相同時間內較模型組相比電針組受損骨骼肌得到了更大程度的恢復。
淀粉樣前體蛋白(APP)是一種單次跨膜蛋白質,正常情況下,APP 可參與一系列生理功能,如軸突生長、信號的跨膜轉導、鈣離子平衡以及細胞黏附等。在骨骼肌中,APP蛋白存在于肌纖維中,隨著發育的進行逐漸集中在NMJ上[29],是NMJ正常形成和功能所必需的[30]。同時APP也是一種發育調節蛋白,其表達在神經元分化期間增加,并且在突觸連接完成時最高[31]。研究表明APP基因缺乏小鼠會出現運動缺陷[32],小鼠體內運動神經元的數量也會減少[33]。Choi HY 等[10]研究表明APP參與和調控NMJ的形成:首先APP可以通過與Agrin和LRP4相互作用的形式來進一步將AChR聚集所需的所有組分募集到最大密度區域,從而確保AChR聚集在體內限制到神經接觸部位;其次在Agrin缺失的情況下,APP可以與LRP4相互作用部分激活MuSK信號通路促進AChR的聚集,同時APP也可以直接與Agrin結合,盡管親和力低于LRP4;最后APP及其異構體相互結合后可以產生或加強神經末梢的附著位點,從而增加了AChR聚集的可能性。 由此可見APP的表達在NMJ發育成熟過程中是必不可少的。在本實驗中電針組APP的表達在損傷后第7天明顯增加,第28天達到高峰,56 d時有所回落,說明電針組在損傷后7 d內神經元開始分化,在第28天時突觸連接完成,隨后APP蛋白表達逐漸減少,這一過程與MuSK蛋白在損傷過程中的表達情況相一致;模型組在損傷后7 d、28 d APP表達顯著升高,而在損傷后28~56 d APP蛋白水平基本沒有變化,提示損傷后大鼠在28 d后模型組自然恢復速度非常緩慢,而電針的刺激可以縮短這一恢復過程,加速受損骨骼肌的修復,促進骨骼肌神經肌肉接頭更快的恢復重建。
由此可見,電針作為中國傳統技術和現代科學技術的結合,其可以通過脈沖結合針體刺激肌肉的方式來緩解局部的炎癥反應,加快受損骨骼肌神經與肌肉的連接,同時正向調控骨骼肌MuSK和APP蛋白的表達水平,促進NMJ的重建從而促進骨骼肌功能的恢復,且這種治療方法不僅療效可觀而且簡便易行,無毒副作用,更加豐富了骨骼肌損傷的臨床治療方法。但其促進NMJ重建的具體調控機制還有待進一步研究。

