復合乳化劑制備重銨油炸藥的熱穩定性分析
桂繼昌,李洪偉,2,李永信,葉家明,章彬彬,4,雷 戰
(1.安徽理工大學化學工程學院,安徽 淮南 232001;2.安徽省爆破器材與技術工程實驗室,安徽 淮南 232001;3.龍巖市和利達化工有限公司,福建 龍巖 364000;4.核工業井巷建設集團有限公司,浙江 湖州 313000)
重銨油炸藥由于其低成本和高穩定性而成為應用最廣泛的工業炸藥之一,其技術要點是將銨油炸藥和一定量的乳膠基質(通常在10 %~50 %)均勻混合[1]。由于乳膠基質包覆在銨油炸藥表面可以達到防水的目的,并且高密度乳膠基質的加入,可以調整重銨油炸藥的密度和威力,彌補了銨油炸藥的不足,從而可以適用于不同的場所。
目前,國內外大多數研究是以工業炸藥熱分解行為以及提高炸藥的威力為主,羅寧等[2]用DSC-TG聯用技術研究了乳化炸藥在使用不同配比復合乳化劑下的熱分解特性;吳澤堯[3]用DSC通過動力學模型分析了AE-HLC型乳化炸藥在非等溫條件下的熱分解特性;徐志祥等[4]運用DSC技術分析了新型粉狀銨油炸藥的熱分解行為。而從熱、動力學研究炸藥穩定性[5-8],特別是針對重銨油炸藥熱穩定性的研究鮮有報道,并且由于使用的熱分析儀器因實驗量小而產生相對較大的誤差。
C80微量量熱儀已被廣泛用于熱分析[9-11]。其基本原理類似于DSC,但具有更高的靈敏度(10-6W)和測量克級液體或固體物質的能力[12]。因此以1 K/min的恒定加熱速率研究單一乳化劑和復合乳化劑制備重銨油炸藥的熱行為,并計算在此過程的熱力學及動力學參數來評價其安全性,不僅對重銨油炸藥的熱安全性有了客觀的認識,還為如何提高重銨油炸藥熱安全性提供了一個新的方向。
1 實驗
1.1 材料
根據相關文獻以及前期實驗研究,重銨油炸藥的配比為70 %銨油炸藥和30 %乳膠基質混合。銨油炸藥由多孔粒狀硝酸銨和柴油(加入比例為94.5∶5.5)攪拌均勻制得。乳膠基質根據配比分別配好油、水相材料,然后將水相材料放置于加熱板上加熱溶解至110 ~120 ℃,保持恒溫備用;油相材料(包括乳化劑)加熱溶解至95 ~105 ℃后,將水相勻速倒入油相中(時間控制在30 s)攪拌180 s(攪拌速度為1 200 r/min)制得乳膠基質。待乳膠基質溫度在55 ~60 ℃時加入質量分數為70%的銨油炸藥,混合均勻,即制得重銨油炸藥。實驗所用乳膠基質的配比如表1所示。
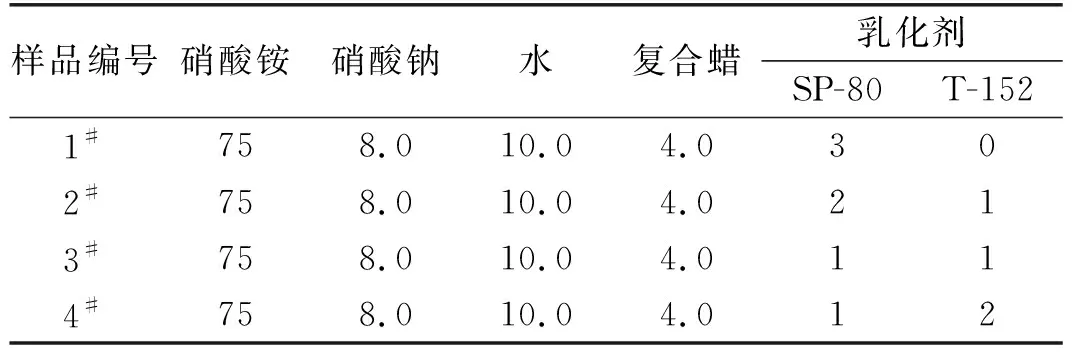
表1 乳膠基質的原料及配方
1.2 實驗裝置及程序
本實驗使用C80微量量熱儀[13](法國Caluire),其特有的CS32控制器與計算機相連以記錄實驗數據。量熱儀內部配有3D Calvet傳感器,可以完全包圍樣品從而保證熱量測量的精度,并創建了穩定的加熱環境。相關技術參數為:樣品質量:0~10 g;感度約為10-6W;可測溫度范圍:室溫~573 K;程序溫度掃描速率:0.01~2 K/min。實驗氣氛為空氣,參比物為α-Al2O3。為了觀察加熱過程中極小的熱流變化,從室溫到300 ℃,以1 K/min的恒定速率加熱,降溫階段設定為2 K/min,C80裝置結構如圖1所示。
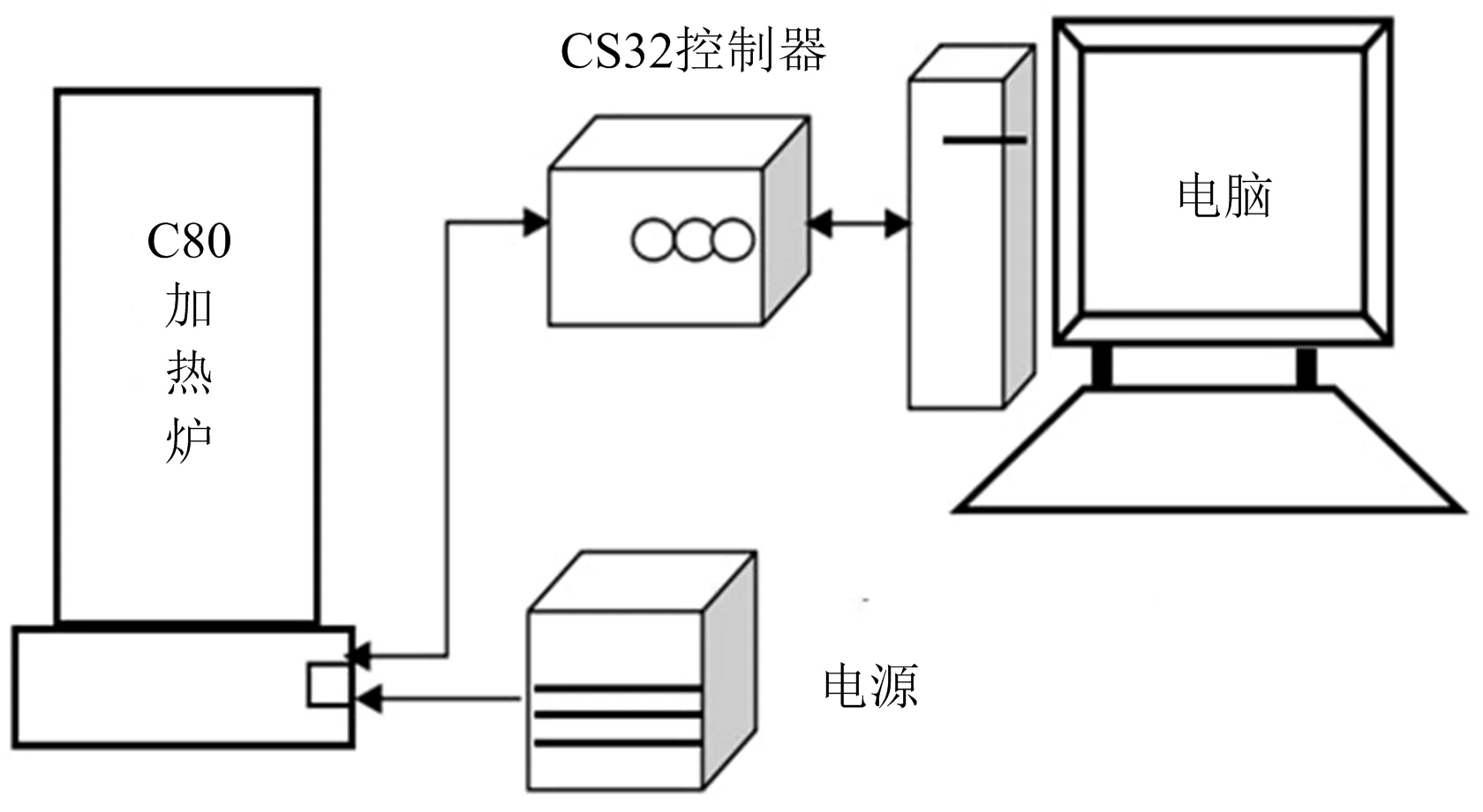
圖1 微量量熱儀C80測試系統Fig.1 The C80 micro calorimeter test system
2 參數推導
2.1 起始溫度和反應熱
起始反應溫度通過分析熱流圖可得到,具體數值是圖中基線與熱流曲線的交點。假設炸藥熱分解反應遵循Arrhenius定律,則在溫度T時反應的質量消耗速率可以描述為[14]
(1)
式中:M為在特定時間t或系統溫度T時的反應物質量,g;A為指數因子;R為通用氣體常數,J/(mol·K);Ea為表觀活化能,J/mol;n為反應階數。
在等式兩邊乘以ΔH(反應熱)后,可以得出反應熱釋放率qG,即
(2)
在得到qG相應的表達式后,通過在放熱反應開始到結束的這段時間內(加熱速率恒定)對qG進行積分得到式(3),計算出H:
(3)
式中:M0為反應物的初始質量,g;Ton為反應的起始溫度,℃;Tend為終止溫度,℃。
2.2 動力學參數
在計算得到反應熱以及起始反應溫度后,可以進一步計算得到相關動力學參數。由于反應的初始階段,反應物反應緩慢,消耗非常小(小于5%),可以忽略不計,因此可以認為M=M0。當反應階數n等于1 時,式(2)可以改寫為
(4)
然后對等式兩側取自然對數,有
(5)
2.3 熱力學參數
在獲得動力學參數之后,還需要計算自由能、焓和活化熵(ΔG°,ΔH°和 ΔS°)各參數。假設熱流曲線峰值處(熱流曲線最高點)代表最高的分解速率,則通過以下各式計算這些熱力學參數[15-16]。
(6)
ΔH°=E-RTpeak
(7)
ΔG°=ΔH°-TpeakΔS°
(8)
υ=KBTpeak/h
(9)
式中:KB為玻爾茲曼常數;h為普朗克常數。
3 實驗結果與討論
3.1 炸藥試樣熱分解特點
為了能直觀展示4種炸藥試樣的熱分解過程,以升溫速率1 K/min,溫升范圍25~300 ℃,并以時間為橫軸,作溫度-時間-熱流曲線(見圖2)。
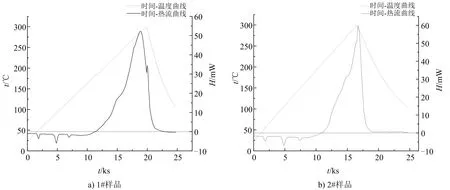
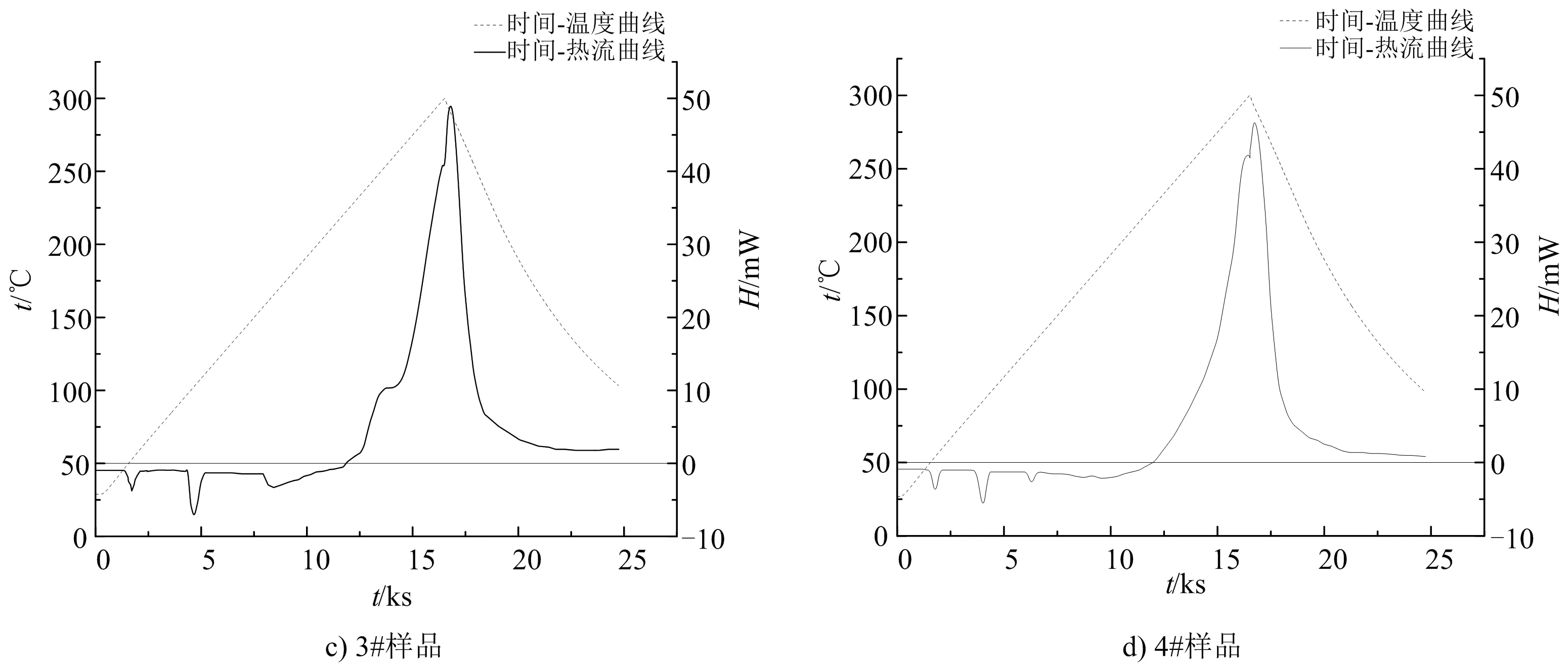
圖2 試樣在空氣氣氛下的熱流與溫度關系Fig.2 Heat flow and temperature relationship of samples under air atmosphere
通過時間—熱流曲線可知,4種炸藥試樣在25 ~170 ℃之間有3個吸熱峰存在。但是硝酸銨加熱過程中,在25 ~170 ℃之間因晶型轉變會存在4個吸熱峰[17]。根據李洪偉等[18]的研究結果可知,重銨油炸藥吸熱峰的減少是因為加入的乳膠基質均勻的覆蓋在多孔粒狀銨油炸藥的表面,從而對硝酸銨的晶型轉變有抑制作用,掩蓋了此過程中的熱量吸收,導致吸熱峰的減少。在170 ℃以后,硝酸銨和乳膠基質受熱分解反應開始加速,并在258 ~298 ℃之間分解反應達到最大,而且重銨油炸藥在整個熱分解過程中只有一個放熱峰。
分析圖2可以得出,使用單一乳化劑的重銨油炸藥(見圖2a)在放熱反應起始溫度和放熱反應峰值溫度有一定差距,試樣1#在11 000 s后熱流曲線開始上升,18 000 s后達到熱流峰值,均小于使用復合乳化劑的2#、3#、4#組。4組炸藥試樣多孔粒硝酸銨發生晶型轉變時的溫度均較為接近,表明復合乳化劑的使用對硝酸銨發生晶型轉變無明顯影響。
由圖2中基線與熱流曲線交點可以得到反應開始溫度,熱流曲線最高點溫度則是峰值溫度,相關參數如表2所示。放熱反應開始溫度是評價炸藥安全性的一個重要參數,可以反映炸藥發生化學反應的難易程度[19]。起始反應溫度越高,炸藥越穩定,越難發生熱分解反應。
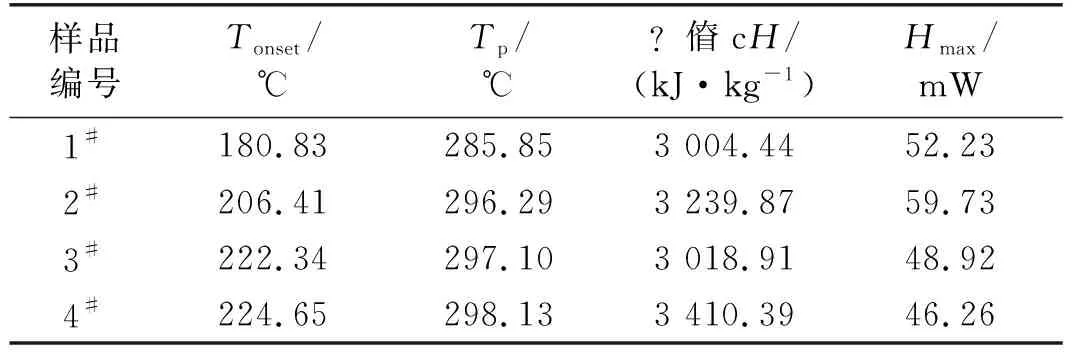
表2 炸藥試樣的放熱特征參數
從表2可以看出,試樣2#、3#、4#起始反應溫度明顯高于1#,表明使用復合乳化劑制備的重銨油炸藥穩定性高于使用SP-80乳化劑。熱流峰值可以反映發生熱分解反應的劇烈程度,熱流峰值越大,反應越劇烈,其危害程度越大。3#、4#試樣熱流峰值低于1#、2#試樣,但1#試樣在熱流峰值后存在一個放熱峰,可能是裝藥的不均勻性導致反應不完全,造成熱流峰值的減小。
3.2 熱、動力學參數分析
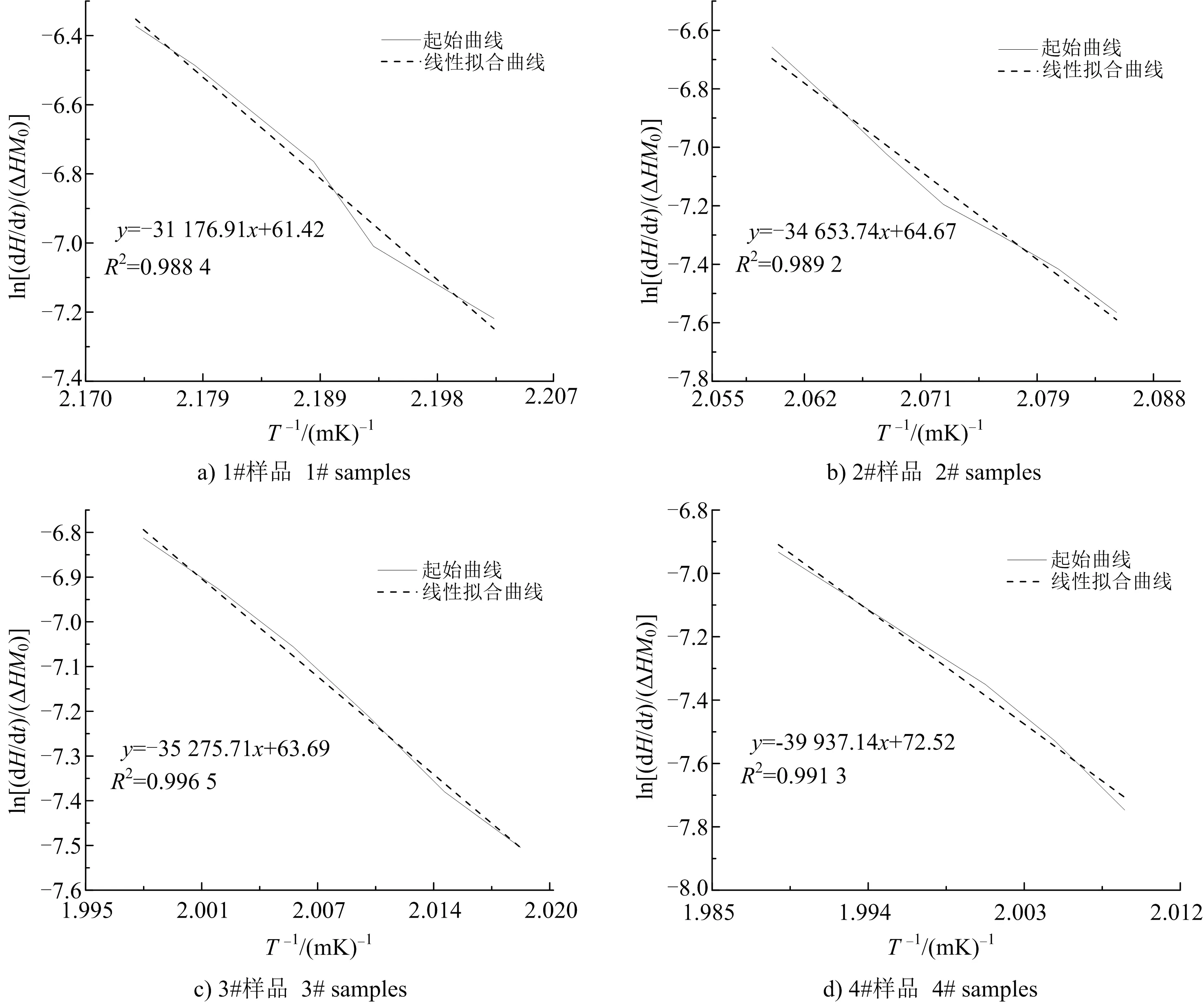
圖3 炸藥試樣的擬合曲線及方程Fig.3 Fitting curves and equations of explosive samples
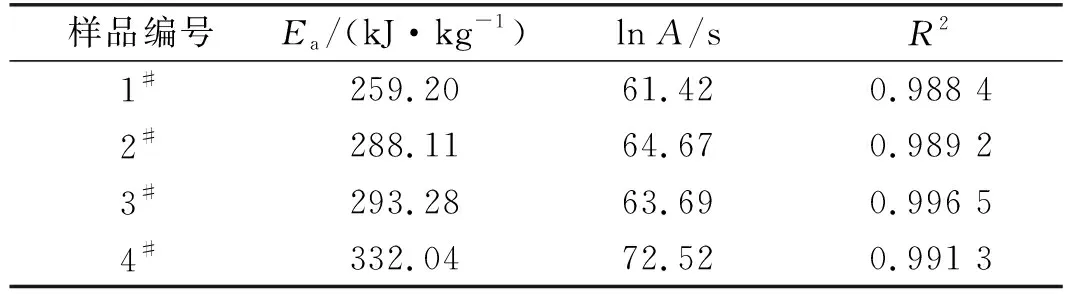
表3 炸藥試樣的反應初始階段動力學參數
活化能可以反映一種化學物質發生化學反應的難易程度,活化能越高,說明物質越穩定[20],越不容易發生化學反應,反之則越易發生反應。從4種炸藥試樣活化能可以看出,1#試樣活化能低于其余三組,說明單一乳化劑制備的重銨油炸藥相比于使用復合乳化劑穩定性較低。而使用復合乳化劑的2#﹑3#﹑4#試樣中,4#試樣活化能最大,乳化劑加入比例為SP-80∶T-152=1∶2,比1#﹑2#﹑3#試樣依次分別高出28.6 %﹑15.2 %﹑13.2 %,表明此比例制備的重銨油炸藥穩定性最高。并且擬合曲線相關系數接近于1,表明擬合結果可信度較高。
結合表3中各組試樣的動力學參數以及式(6)~式(9),可計算得到4組試樣相應的熱力學參數,計算結果如表4所示。
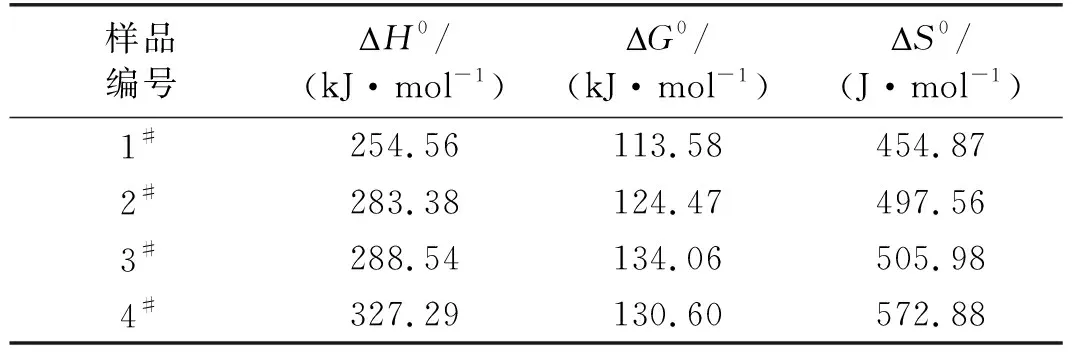
表4 炸藥試樣的熱力學參數
由于乳膠基質是動力學穩定,熱力學不穩定體系[21],重銨油炸藥也應有這樣的特性。從化學動力學角度來看,由于G0>0,表明了化學反應的不可自發性。從吉布斯自由能分析,也給出了重銨油炸藥在低溫下不自發,高溫下自發的化學動力學依據,且可計算出相應的自發反應溫度分別為286.48、296.39、297.11、298.16 ℃。但是由于重銨油炸藥組分及反應的復雜性,求出的相應參數有一定誤差,可定性分析大小。這就表明,在同等條件下,4#試樣能自發反應的溫度最高,最為穩定。
4 結論
1)乳膠基質的加入會掩蓋硝酸銨晶型轉變時的熱量吸收,但對于發生晶型轉變時的溫度無明顯影響,復合乳化劑只影響起始反應溫度及反應峰值溫度。
2)從動力學參數分析,由于使用復合乳化劑的重銨油炸藥活化能均高于單一乳化劑,因此,使用復合乳化劑制備的重銨油炸藥熱穩定均高于使用SP-80乳化劑制備的重銨油炸藥,并且在乳化劑加入比為SP-80∶T-152=1∶2時,重銨油炸藥穩定性最高。
3)分析熱力學參數從化學動力學角度給出了重銨油炸藥的不可自發性原因,并通過吉布斯自由能了解自發條件以及相應的自發反應溫度。

