山茱萸莫羅苷經Bcl-2/Bax 通路抗H9c2 心肌細胞氧化應激損傷研究
邱清勇,彭 錦,陳 麗,呂 秋,符碧薇
(1. 中國人民解放軍聯勤保障部隊第九二八醫(yī)院心血管內科,海南 海口 570206; 2. 海南醫(yī)學院基礎醫(yī)學與生命科學學院,海南 海口 571199)
氧化應激在心力衰竭、心肌缺血-再灌注損傷、心肌病、動脈粥樣硬化、房顫等多種心血管疾病的發(fā)病機制中起著至關重要的作用[1-2]。氧化應激導致活性氧(ROS)的過量產生,是心血管疾病發(fā)生的重要因素[3]。過量的ROS 不僅可導致心肌細胞氧化-抗氧化平衡系統失衡,且會導致細胞凋亡[4-5]。因此,減輕氧化應激和/或直接干預凋亡途徑的抑制可為治療提供潛在的分子靶標[6]。山茱萸是落葉小喬木山茱萸樹上的紅色果肉,有非特異性免疫增強功能及抗氧化和抗炎作用[7]。山茱萸提取物通過改善氧自由基的清除能力和抑制膜的氧化損傷而對心肌細胞有明顯的保護作用[8]。山茱萸莫羅苷是山茱萸提取物的主要成分之一,是一種良好的抗氧化劑[9]。本研究中考察了山茱萸莫羅苷通過調節(jié)B細胞淋巴瘤/白血病-2(Bcl-2)/Bcl-2 相關X 蛋白(Bax)信號通路發(fā)揮H9c2 心肌細胞氧化應激損傷的防護作用。現報道如下。
1 材料與方法
1.1 儀器、試藥與細胞
儀器:CO2培養(yǎng)箱(美國Thermo Revco 公司);Sunrise 型全自動酶標儀(瑞士Tecan 公司);BD 垂直電泳儀、BD FACSCanto 型流式細胞儀(美國BD 公司)。
試藥:山茱萸莫羅苷(上海醫(yī)科大學天然藥物化學教研室,批號為131035,質量分數大于98%);30%H2O2(江蘇凱基生物技術股份有限公司,批號為KGF009);改良杜氏伊格爾培養(yǎng)基(DMEM,批號為C11965500BT);胎牛血清(美國Gibco 公司,批號為25200056);四氮唑(MTT,美國Amresco 公司,批號為M8180-1);ANNEXIN V- FITC/PI 凋亡檢測試劑盒(北京索萊寶科技有限公司,批號為CA1020);超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSHPx)和丙二醛(MDA)檢測試劑盒,均購自南京建成生物工程研究所(批號分別為A003-1-2,A001-3-2,E004-1-1);2′,7′-二氯熒光黃雙乙 酸 鹽(DCFH-DA,美 國 Sigma 公 司,批 號 為ml063160);蛋白抽提試劑盒(武漢博士德生物工程有限公司,批號為AR0103);Bcl-2、Bax、細胞色素c(Cyt-c)、半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)和β-actin 抗體,均購自美國Santa Cruz公司(批號分別為SC-5248,SC-393813,SC-5482,SC-6284,SC-7518);辣根過氧化物酶HRP 標記親和純化山羊抗小鼠IgG 二抗(武漢艾美捷科技有限公司,批號為C1313)。
細胞:H9c2 大鼠心肌細胞(中國科學院典型培養(yǎng)物保藏委員會細胞庫,批號為131035)。
1.2 細胞培養(yǎng)和分組
用含10%胎牛血清的DMEM 培養(yǎng)基在37 ℃及5% CO2條件下培養(yǎng)H9c2 細胞,選擇對數生長期細胞進行試驗。分為陰性對照組(A 組)、陽性對照組(B 組)、莫羅苷低、中、高劑量組(C1組、C2組、C3組)。A 組加入無血清DMEM 培養(yǎng)基;B 組加入終濃度為200 μmol/L 的H2O2;C1組、C2組、C3組分別加入終質量濃度為25,50,100μg/mL的山茱萸莫羅苷,同時給予終濃度為200 μmol/L 的H2O2,繼續(xù)培養(yǎng)24 h 后進行相關檢測[10-11]。
1.3 檢測細胞增殖率
以5×103/孔接種于96 孔板中(每孔200 μL),待細胞融合后,按1.2 項下方法給予受試物干預20 h,繼續(xù)培養(yǎng)20 h,每孔加入MTT 50 μL,繼續(xù)培養(yǎng)4 h,輕輕吸取上清液,加入二甲基亞砜(DMSO,每孔200 μL),室溫振蕩10 min,采用酶標儀于492 nm 波長處測定吸光度(OD 值),計算細胞增殖率[細胞增殖率=(OD實驗組-OD空白孔)/(OD陰性對照組- OD空白孔)]。
1.4 檢測細胞凋亡情況
以5×104/孔接種于6 孔板內(每孔3 mL),待細胞融合后,按1.2 項下方法給予受試物干預24 h,轉移至離心管內離心,用磷酸鹽緩沖液洗滌2 次,加入膜聯蛋白V-FITC 和PI,并將細胞在室溫下避光孵育10 min,用流式細胞儀檢測細胞凋亡情況。
1.5 檢測SOD,GSHPx,MDA 和ROS 水平
以5×104/孔接種于6 孔板內(每孔3 mL),待細胞融合后,按1.2 項下方法給予受試物干預24 h,收集細胞,3 000 g 離心10 min,棄培養(yǎng)基,加入2 mL 磷酸鹽緩沖液,用細胞超聲破碎儀處理30 s,12 000 g 離心10 min,收集上清液,按試劑盒說明書檢測細胞中SOD,GSHPx,MDA 活性;采用DCFH-DA 探針聯合酶標儀法檢測細胞內ROS 水平,按1.2 項下方法給予受試物干預24 h,棄培養(yǎng)基,分別加入DCFH-DA(每孔10 μmol/L),在37 ℃下孵育60 min,采用流式細胞儀檢測ROS 表達水平。
1.6 檢測Bcl-2,Bax,Cyt-c 和Caspase-3 水平
以5×104/孔接種于6 孔板內(每孔3 mL),待細胞融合后,按1.2 項下方法給予受試物干預24 h,收集細胞,3 000 g 離心10 min 棄培養(yǎng)基,根據細胞量加入細胞蛋白抽提液,SDS-PAGE 進行電泳,每孔上樣量為20 μg,將印跡轉移到聚偏氟乙烯膜上,用5%脫脂牛奶在室溫下封膜1 h,將膜與Bcl-2(1 ∶200)、Bax(1 ∶500)、Cyt-c(1 ∶300)、Caspase-3(1 ∶200)和β-actin(1 ∶1 000)抗體進行孵育,4 ℃過夜,將二抗(1 ∶5 000)在室溫下孵育30 min。進行顯色,采集圖像,通過Image LabTM軟件(Bio-Rad)獲取信號,并估計強度,以β-actin 作為內對照。
1.7 統計學處理
采用SPSS 23.0 統計學軟件分析。試驗結果采用均數±標準差(± s),用單因素方差分析進行判斷,組間兩兩比較用LSD- t 檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 對H9c2 細胞增殖和細胞凋亡的影響
與A 組相比,B 組和C1組、C2組、C3組H9c2 細胞增殖率降低,H9c2 細胞凋亡率增加,差異有統計學意義(P<0.05);與B 組相比,C1組、C2組、C3組H9c2 細胞增殖率增加,H9c2 細胞凋亡率降低,且呈劑量依賴性,差異有統計學意義(P<0.05)。詳見表1 和圖1。
表1 山茱萸莫羅苷對H9c2 細胞增殖和凋亡情況及ROS 水平的影響( ± s,%)
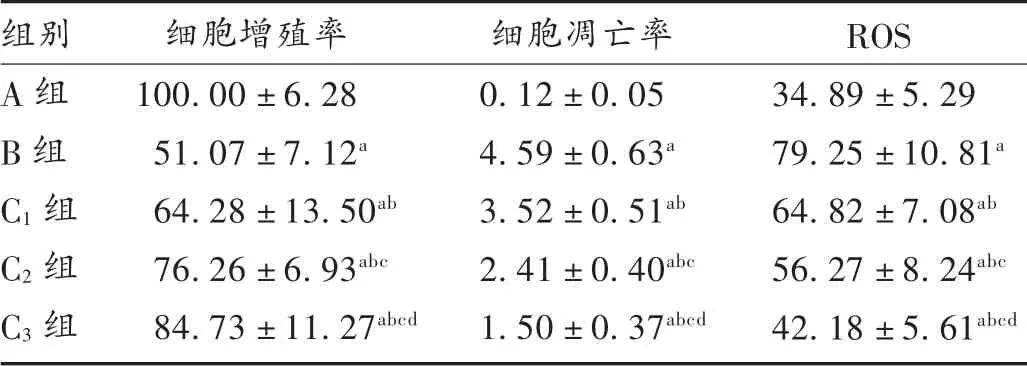
表1 山茱萸莫羅苷對H9c2 細胞增殖和凋亡情況及ROS 水平的影響( ± s,%)
注:與A 組比較,a P <0.05;與B 組比較,b P <0.05;與C1 組比較,c P <0.05;與C2 組比較,d P <0.05。下表同。
組別A 組B 組C1 組C2 組C3 組細胞增殖率100.00 ±6.28 51.07 ±7.12a 64.28 ±13.50ab 76.26 ±6.93abc 84.73 ±11.27abcd細胞凋亡率0.12±0.05 4.59±0.63a 3.52±0.51ab 2.41±0.40abc 1.50±0.37abcd ROS 34.89 ±5.29 79.25 ±10.81a 64.82 ±7.08ab 56.27 ±8.24abc 42.18 ±5.61abcd
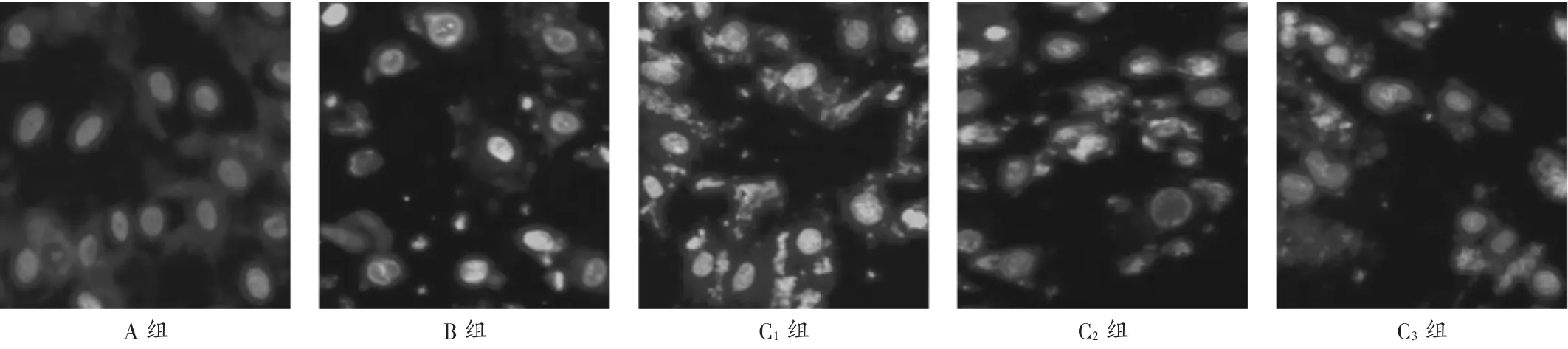
圖1 山茱萸莫羅苷對H9c2 細胞凋亡的影響
2.2 對ROS 水平的影響
與A 組相比,B 組、C1組、C2組、C3組H9c2 細胞中ROS 水平增加,差異有統計學意義(P<0.05);與B 組相比,C1組、C2組、C3組H9c2 細胞中ROS 水平降低,且呈劑量依賴性,差異有統計學意義(P<0.05)。詳見表1和圖2。
2.3 對SOD,GSHPx,MDA 水平的影響
與A 組相比,B 組、C1組、C2組、C3組H9c2 細胞中SOD 和GSHPx 水平降低,H9c2 細胞中MDA 水平增加,差異有統計學意義(P<0.05);與B 組相比,C1組、C2組、C3組H9c2 細胞中SOD 和GSHPx 水平增加,H9c2細胞中MDA 水平降低,且呈劑量依賴性,差異有統計學意義(P<0.05)。詳見表2。
表2 山茱萸莫羅苷對H9c2 細胞中SOD,GSHPx,MDA 水平的影響( ± s)
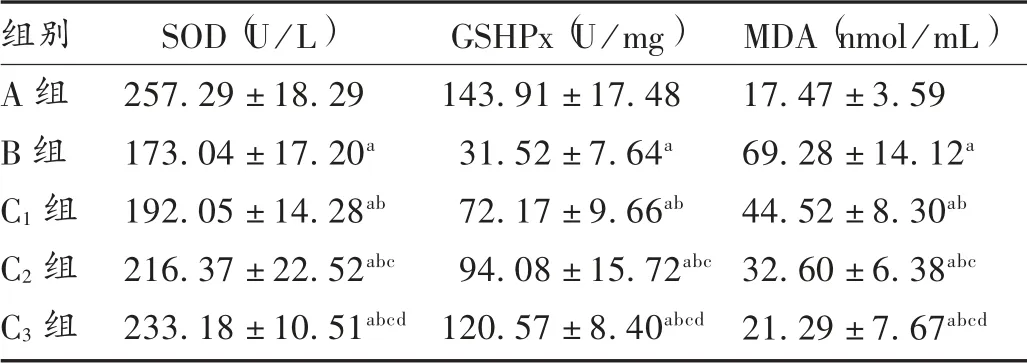
表2 山茱萸莫羅苷對H9c2 細胞中SOD,GSHPx,MDA 水平的影響( ± s)
組別A 組B 組C1 組C2 組C3 組SOD(U/L)257.29 ±18.29 173.04 ±17.20a 192.05 ±14.28ab 216.37 ±22.52abc 233.18 ±10.51abcd GSHPx(U/mg)143.91 ±17.48 31.52 ±7.64a 72.17 ±9.66ab 94.08 ±15.72abc 120.57 ±8.40abcd MDA(nmol/mL)17.47 ±3.59 69.28 ±14.12a 44.52 ±8.30ab 32.60 ±6.38abc 21.29 ±7.67abcd
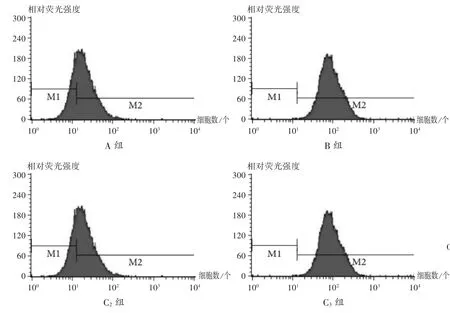
圖2 山茱萸莫羅苷對H9c2 細胞中ROS 水平的影響
2.4 對Bcl-2,Bax,Cyt-c,Caspase-3 水平的影響
與A 組相比,B 組、C1組,C2組,C3組H9c2 細胞中Bcl-2 水平降低,H9c2 細胞中Bax,Cyt-c,Caspase-3水平增加,差異有統計學意義(P<0.05);與B 組相比,C1組、C2組、C3組H9c2 細胞中Bcl-2 水平增加,H9c2 細胞中Bax,Cyt-c,Caspase-3 水平降低,且呈劑量依賴性,差異有統計學意義(P<0.05)。詳見表3 和圖3。
表3 山茱萸莫羅苷對H9c2 細胞中Bcl-2,Bax,Cyt-c,Caspase-3 水平的影響( ± s)
表3 山茱萸莫羅苷對H9c2 細胞中Bcl-2,Bax,Cyt-c,Caspase-3 水平的影響( ± s)
組別A 組B 組C1 組C2 組C3 組Bcl-2 0.93±0.14 0.27±0.03a 0.42±0.08ab 0.51±0.07abc 0.80±0.13abcd Bax 0.16±0.03 0.59±0.10a 0.33±0.05ab 0.28±0.05abc 0.21±0.02abcd Cyt-c 0.13±0.04 0.48±0.06a 0.29±0.04ab 0.21±0.02abc 0.17±0.03abcd Caspase-3 0.22±0.04 0.76±0.08a 0.49±0.08ab 0.40±0.05abc 0.31±0.02abcd
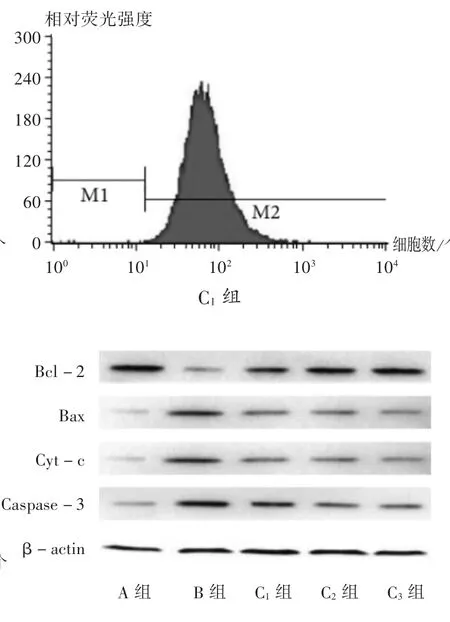
圖3 山茱萸莫羅苷對H9c2 細胞中Bcl-2,Bax,Cyt-c,Caspase-3 水平的影響
3 討論
山茱萸是山茱萸科植物除去種子的成熟果實,其提取物主要成分包括類黃酮、莫羅苷、三萜、多酚和多糖,具有補血固精、補益肝腎、調氣、補虛、明目、強身等功效。藥理學研究表明,山茱萸乙醇提取物通過提高清除氧自由基和抑制膜氧化損傷的能力,對心肌細胞有顯著保護作用[12]。大量的體內外研究表明,莫羅苷有抗癌、抗氧化劑、抗炎、抗動脈粥樣硬化、抗病毒等功效。氧化應激在各種心血管疾病的發(fā)病機制中起重要作用[13]。山茱萸莫羅苷對心肌細胞氧化應激損傷的作用尚未闡明。氧化應激損傷過程中,心肌細胞凋亡常與ROS 的過量產生有關,抑制氧化損傷和氧化應激誘導的細胞凋亡是心血管疾病的重要干預策略[14]。本研究中采用H9c2心肌細胞,與H2O2孵育,建立氧化應激損傷模型,研究山茱萸莫羅苷的保護作用及其作用機制。通過MTT 法確定細胞活力。H2O2孵育24 h 后,A 組細胞增殖率降低;經山茱萸莫羅苷預處理后,細胞增殖率明顯升高,表明山茱萸莫羅苷可保護心肌細胞免受H2O2誘導損傷。
氧氣是心肌細胞的關鍵必需物質,通常伴隨著線粒體呼吸作用產生的潛在危險的ROS。鈣離子超載的發(fā)生和過量ROS 的產生在氧化應激過程中有相互的因果關系[15]。氧化應激產生的過量ROS 可能會破壞膜結構,增加膜通透性,消耗細胞內三磷酸腺苷(TP),并導致大量Ca2+流入細胞外及細胞內鈣超載,進一步加劇ROS 的產生[16]。氧化劑和抗氧化劑間的平衡在維持正常的生物學功能中起著至關重要的作用。外源性刺激會破壞體內的平衡,引起體內ROS 的過度積累,并誘發(fā)多種疾病。盡管脂質過氧化產物可間接反映氧化應激條件下ROS 的生成,但細胞抗氧化酶(如SOD,GSH-Px)可降低細胞內ROS 含量[17]。本研究結果顯示,山茱萸莫羅苷預處理可減少MDA 和ROS 的產生,并提高SOD 和GSH-Px 的活性。山茱萸莫羅苷的作用可能部分歸因于改善了氧化劑和抗氧化劑系統的平衡。
凋亡是細胞死亡途徑的程序性和主動模式,在正常的生理或病理環(huán)境中受其自身基因調控,H2O2處理的H9c2 細胞可促進細胞凋亡[18]。本研究中,H2O2誘導的細胞凋亡形態(tài)發(fā)生變化,通過PI 和DAPI 染色觀察到細胞萎縮、染色質濃縮和出現凋亡小體。同時,山茱萸莫羅苷可能對H2O2誘導的細胞凋亡有保護作用。
由于其與氧化應激損傷和細胞凋亡的潛在相關性,在氧化應激過程中,多種作用機制可引起心肌損傷。ROS 直接或通過Bcl- 2 / Bax 信號通路引起細胞損傷[19]。Bcl-2/Bax 是線粒體穩(wěn)態(tài)的主要調節(jié)因子;其通過穩(wěn)定細胞膜完整性和抑制線粒體通透性轉換孔(MPTP)的開放來阻止Cyt-c 從線粒體釋放,從而起到抗凋亡作用,促凋亡分子Bax 通過MPTP 孔的開放來促進Cyt-c 從線粒體釋放[20-21]。Cyt-c 可與凋亡蛋白酶活化因子1(Apaf-1)、半胱天冬酶原-9(Procaspase-9)結合形成復雜的凋亡小體,激活Caspase-3 級聯反應,誘導細胞凋亡[22]。因此,Bcl-2/Bax 的降低導致線粒體內孔隙的形成,并導致線粒體內的小分子流出,山茱萸莫羅苷預處理可通過降低Bax,Cyt-c,Caspase-3 的表達,增加Bcl-2 的合成來抑制細胞凋亡。
綜上所述,山茱萸莫羅苷對H2O2誘導的H9c2 細胞氧化損傷具有一定的保護作用,其作用機制與Bcl-2/Bax 細胞信號通路有關。可能具有預防和治療H2O2引起的心肌細胞氧化應激損傷的潛力,但尚需大量的研究進行論證。

