組織工程產品用種子細胞的質量控制與標準化
韓倩倩 趙君 王苗苗 曲明悅 王春仁 李靜莉
【提要】 組織工程產品主要是利用生物學和工程學的原理來構建受損組織的功能性替代品,以恢復、維持或改善組織功能。含細胞成分的組織工程產品在體外構建時離不開載體支架材料與種子細胞的相互調控和配合。種子細胞作為原材料之一,參與體外培養構建產品,同時也轉化為組織工程產品的組成成分來發揮作用。組織工程產品構建用種子細胞不同于細胞治療用干細胞,其作為構建組織工程產品的原材料,在構建過程中細胞本身會發生生物學變化,最終與支架材料形成一個有機的整體。組織工程產品用種子細胞因其獨特性,要用專門的視角理順其質量控制指標,以保證組織工程產品的質量。
器官或組織的損傷或功能缺損是人類健康中最常見、最具破壞性且代價最高的問題之一。組織工程產品是應用生物學和工程學的原理來開發恢復、維持或替代組織器官的產品,成為組織器官缺損治療的希望。組織工程產品在體外構建時,離不開載體支架與種子細胞的相互調控和配合。組織工程用細胞作為原材料之一,參與體外培養構建產品,同時也轉化為組織工程產品的組成成分來發揮作用。其中,如何獲得可以提供所需功能的種子細胞或細胞替代品是利用組織工程學構建和創造新組織的重要環節[1]。本文參照ISO 18362Manufactureofcell-basedhealthcareproducts[2]、《GB/T 36988-2018組織工程用人源組織操作規范指南》[3]、《中國藥典》[4]、《藥品生產質量管理規范》[5]等指導文件,對組織工程產品用種子細胞的質量控制指標進行綜述,分別對細胞供體的樣本準入要求、細胞的采集及加工要求、關鍵生產物料的質控要求、細胞庫建設的指導要求及與支架材料共培養結束后的放行檢驗等環節進行總結。
1 細胞供體的準入要求
根據《中國藥典》(2015版)三部 《生物制品生產檢定用動物細胞基質制備及檢定規程》中規定,細胞系/株應具有細胞系/株來源的相關資料:①細胞系/株制備機構的名稱,細胞系/株來源的種屬、年齡、性別和健康狀況的資料,這些資料最好從細胞來源實驗室獲得,也可引用正式發表文獻;②人源細胞系/株須具有細胞系/株的組織或器官來源、種族及地域來源、年齡、性別及生理狀況的相關資料;③動物來源的細胞系/株須具有動物種屬、種系、飼養條件、組織或器官來源、地域來源、年齡、性別、病原體檢測結果及供體的一般生理狀況的相關資料;④如采用已建株的細胞系/株,應從具有一定資質的細胞保藏中心獲取細胞,且應提供該細胞在保藏中心的詳細傳代過程,包括培養過程中所使用的原材料的相關信息,具有細胞來源的證明資料。
1.1 供體篩查的基本要求
根據GB/T 36988-2018《組織工程用人源組織操作規范指南》,通過供體篩查和供體檢測結果確定供體資質是否合格,負責簽署分發的負責人應判定并記錄細胞或組織供體的合格性。只有符合下列條件的供體才能成為合格的供體。①無可傳播性病原體或疾病感染的臨床證據;②無因異種移植而產生傳染性疾病的風險;③可傳播性病原體檢測結果為陰性或無反應性。除供體資質確定豁免特例之外,所有供體均應進行篩查,主要是通過審核供體的醫療記錄來分析可能存在的風險。
1.2 供體檢測的基本要求
供體檢測總的要求是盡可能地降低傳染性疾病的危險性,檢測試驗室應對供體樣本的傳播性病原體進行檢測。如果供體年齡小于1個月,則應檢測其母親樣本。應在獲取供體細胞或組織時對供體樣本進行檢測,如果在獲取細胞或組織時不能取樣進行檢測,則應在獲取前或獲取后7 d內采集樣本進行檢測。如果供者僅提供外周血干細胞/祖細胞,在獲取細胞前采集樣本檢測的時間最多不得超過30 d。檢測實驗室應使用國家食品藥品監督管理部門簽發批準的、明確用于血源篩查的試劑,并且應按照試劑生產企業的說明書進行操作。一旦國家批準了新的病原體的篩查試劑或針對尸體檢測的試劑,則檢測實驗室應使用這些新批準的試劑。檢測試驗室應具有相應的檢測資質。
為盡可能地降低傳染性疾病的危險性,應對所有的細胞或組織供體的樣本進行下列可傳播性病原體的檢測:人免疫缺陷病毒Ⅰ型(HIV-Ⅰ)、人免疫缺陷病毒Ⅱ型(HIV-Ⅱ)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、梅毒螺旋體。
為降低可傳播性病原體的風險,對于活的含白細胞的細胞或組織供體樣本,還應檢測與細胞相關的可傳播性病原體,包括人T-淋巴細胞白血病病毒Ⅰ型(HTLV-Ⅰ)、人T-淋巴細胞白血病病毒Ⅱ型(HTLV-Ⅱ)、人巨細胞病毒(HCMV)。
對于硬腦膜供體,應對可傳播性海綿狀腦炎病毒進行充分評價。
由于人類對病原體的認識在不斷更新,而且新的病原體不斷出現,一旦有充分的數據證明某種病原體可通過人源細胞/組織傳播并嚴重危害人類健康,則應増加這種新型可傳播性病原體的檢測,病毒的檢測應采用最為敏感的檢測方法。
2 細胞的采集及加工要求
生產單位或機構應建立細胞或組織的采集程序,包括設施、環境控制、設備、物料和試劑、標簽管理、貯存、人源細胞/組織的接收、發運前運輸與發運。細胞或組織的采集單位應使用不會產生污染或交叉污染的方法采集細胞或組織。評估所有與采集相關的操作,包括技術程序、人員、設備、物料和試劑以及采集樣本運送程序等,以確定這些操作活動能夠控制污染和交叉污染。細胞或組織采集應采用無菌技術,不應從有感染的身體部位采集。
細胞或組織采集前應確認并記錄供體身份。對非活體供體,宜通過核對授權文件和/或醫療記錄的身份證號碼、年齡、性別、種族及體質量等信息確認,并對文件或記錄照相保存。對活體供體,宜通過問詢供者姓名、身份證號碼等確認供者,并詳細記錄身份核對的方法及結果,問詢時間及問詢者姓名等。
采集過程應有詳細的記錄,人源細胞/組織的生產單位或機構應定期審計采集單位的記錄并確認供體身份,以確保供體記錄與人源細胞/組織確為同一供體。同時在活體供體采集過程中,應對造成或可能造成活體供體傷害的任何不良事件以及原因的調查結果記錄進行審查。
生產單位或機構應建立并維護規范的、涉及生產全過程的操作程序,確保加工過程不造成污染或交叉污染,并防止傳染性疾病的引入、傳染及傳播的風險。
3 關鍵生產物料的質控要求
根據原材料對產品質量的影響程度、原材料的來源、生產以及對產品潛在的污染風險,結合《中國藥典》(2015版)的要求,按風險進行分級管理。DMEM/F12培養基、胎牛血清、胰蛋白酶按第4級進行嚴格的質量控制,其他按照1、2級進行管理(表1、2)。
4 細胞庫的建設
細胞庫的建立可為生物制品的生產提供已標定好的、細胞質量相同的、能持續穩定傳代的細胞種子。
4.1 原材料的選擇
細胞培養液中不得使用人血清,如需使用人血白蛋白,則須使用有批準文號的合格制品。
消化細胞用的胰蛋白酶應進行檢測,證明其無細菌、真菌、支原體或病毒污染。特別應檢測胰蛋白酶來源的動物可能攜帶的病毒,如細小病毒等。
用于生物制品生產的培養物中不得使用青霉素或β-內酰胺(β-Lactam)類抗生素。配制各種溶液的化學藥品應符合《中國藥典》(二部)或其他相關國家標準的要求。

表1 細胞培養過程關鍵物料材料等級劃分及質量標準依據
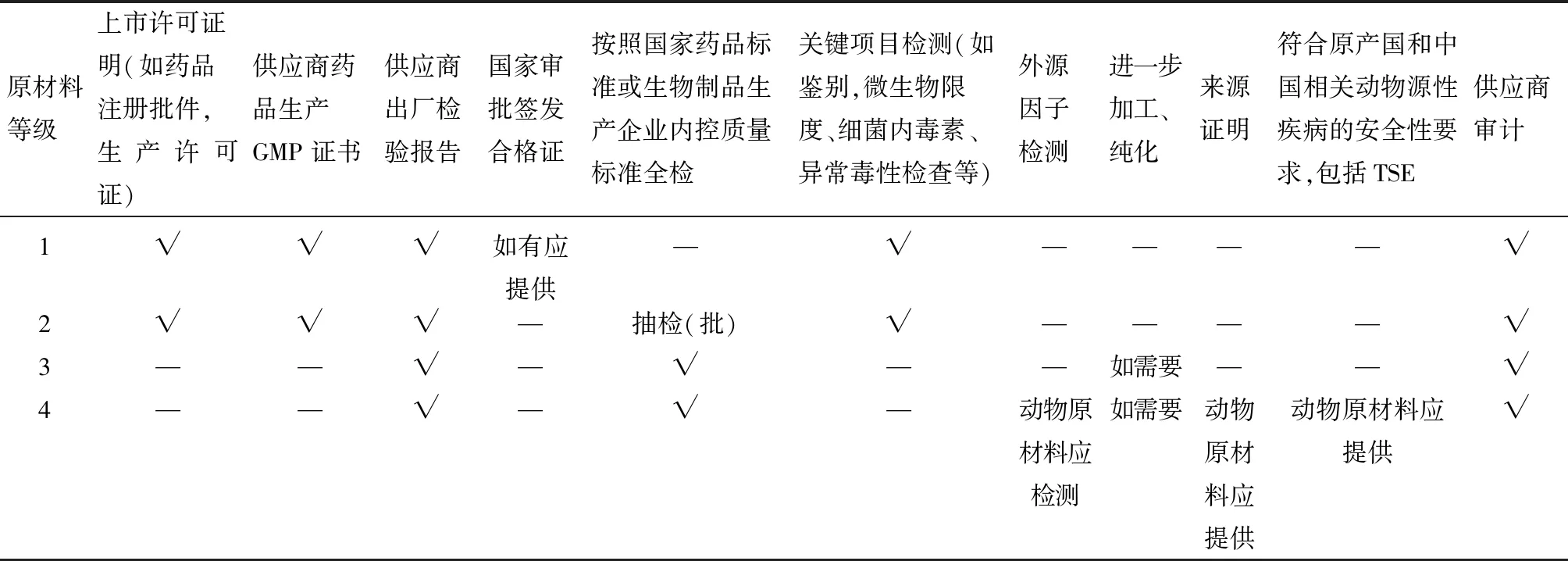
表2 不同風險等級生產用原材料的質量控制要求
4.2 細胞操作的環境要求
細胞培養的操作應符合中國《藥品生產質量管理規范》的要求。生產人員應定期檢查身體。在生產區內不得進行非生產制品用細胞或微生物的操作;在同一工作日進行細胞操作前,不得操作或接觸有感染性的微生物或動物。
4.3 人細胞庫的建立
細胞庫為三級管理,即原始細胞庫(PCB)、主細胞庫(MCB)及工作細胞庫(WCB)。如為引進的細胞,可采用主細胞庫和工作細胞庫組成的二級細胞庫管理。在某些特殊情況下,也可使用主細胞庫一級細胞庫管理,但須得到國務院藥品監督管理部門的批準。
4.3.1原始細胞庫
由一個原始細胞群體發展成傳代穩定的細胞群體,或經過克隆培養而形成的均一細胞群體,通過檢定證明適用于生物制品生產或檢定。在特定條件下,將一定數量、成分均一的細胞懸液,定量均勻分裝于安瓿,于液氮或-130 ℃以下凍存,即為原始細胞庫,供建立主細胞庫用。
4.3.2主細胞庫
取原始細胞庫細胞,通過一定方式進行傳代、增殖后均勻混合成一批,定量分裝,保存于液氮或-130 ℃以下。這些細胞必須按其特定的質控要求進行全面檢定,應合格。主細胞庫用于工作細胞的制備,每個生產企業的主細胞庫最多不得超過兩個細胞代次。
4.3.3工作細胞庫
工作細胞庫的細胞由主細胞庫細胞傳代擴增制成。主細胞庫的細胞經傳代增殖, 達到一定代次水平,制成一批均質細胞懸液,定量分裝于安瓿或適宜的細胞凍存管,保存于液氮或-130 ℃以下備用,即為工作細胞庫。每個生產企業的工作細胞庫必須限定為一個細胞代次。凍存時細胞的傳代水平須確保細胞復蘇后傳代增殖的細胞數量能滿足生產一批或一個亞批次制品。復蘇后細胞的代次水平應不超過批準的該細胞用于生產的最高限定代次。所制備的工作細胞庫必須經檢定合格(見4.5“細胞檢定”中有關規定)后,方可用于生產。
4.4 細胞庫的管理
每種細胞庫均應分別建立臺帳,記錄放置位置、容器編號、分裝及凍存數量、取用記錄等。細胞庫中的每支細胞安瓿或細胞凍存管均應注明細胞系/株名、代次、批號、編號、凍存日期,儲存容器的編號等。
凍存前細胞活力應在90%以上,復蘇后細胞存活率應不低于85%。凍存后的細胞,應至少行一次復蘇培養并連續傳代至衰老期,檢查不同代次水平的細胞生長情況。
主細胞庫和工作細胞庫分別存放。非生產用細胞應與生產用細胞嚴格分開存放。
4.5 細胞檢定
細胞檢定主要包括細胞鑒別、外源因子和內源因子的檢查、致瘤性檢查等(表3)。必要時還須進行細胞染色體核型檢查。這些檢測內容對于主細胞庫細胞和工作細胞庫細胞及生產限定代次細胞均適用。
細胞庫建立后應至少對主細胞庫細胞及生產終末細胞進行一次全面檢定。每次從主細胞庫建立一個新的工作細胞庫,均應按規定項目進行檢定。
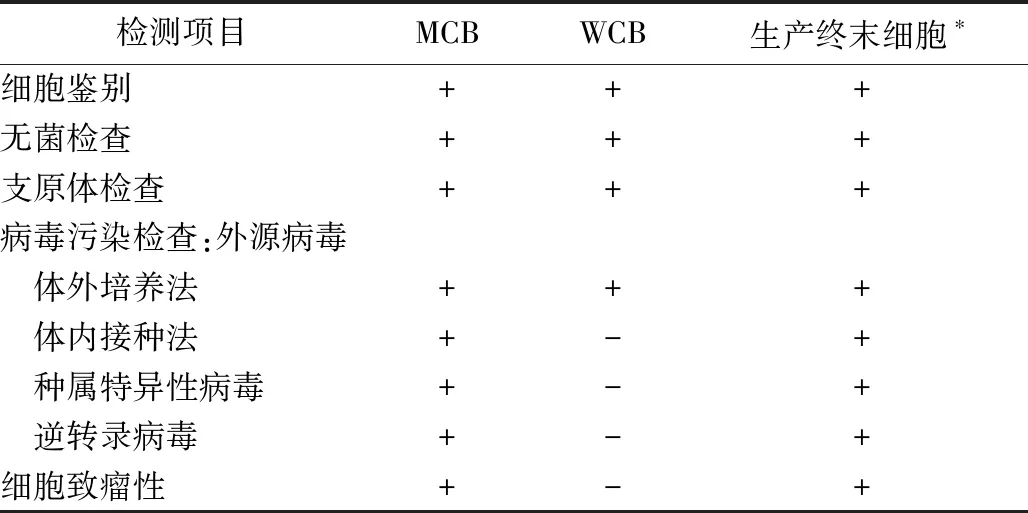
表3 細胞檢定項目要求
除考慮安全性指標外,還應充分考慮細胞的功能性指標。如細胞在建庫過程中,細胞屬性的維持以及細胞功能蛋白的表達水平都是需要考慮的關鍵指標。
5 與支架共建培養結束后的放行檢驗
與支架進行共建培養后,對于細胞的放行檢驗不容忽視。越來越多證據表明,支架對于細胞的微調控作用,會引起細胞發生分化及代謝相關指標的變化。因而,建立合理且可行的放行檢驗標準是檢驗組織工程產品有效且安全的保障。然而,鑒于細胞的特殊性,包括培養及儲存環境需要無菌,貨架期短等,無法如其他醫療器械一樣進行放行檢驗指標的設立。
對于帶細胞的組織工程產品的放行檢驗指標,從有效性角度來說,應至少包括細胞屬性標志蛋白與細胞功能蛋白的檢測,用以評估終產品中細胞的有效性發揮。安全性角度,應從制劑及無菌兩方面進行檢驗。其中,制劑檢測至少包括內毒素檢測、抗生素檢測及牛血清白蛋白檢測等。組織工程產品的活細胞特性決定了貨架有效期較短,而常規無菌檢查時間長,無法用體外培養法進行無菌檢查。“菌落總數檢測試紙”快速檢驗法,15~24 h即可驗證無菌,不失為一種理想的放行檢驗無菌檢查方法。
6 總結
組織工程學的三要素是指材料、細胞、生長因子。所以對于組織工程產品而言,細胞/干細胞是極為重要的。組織工程產品制備需要用細胞和生物材料在外部合理的培養環境下,構建能夠植入人體進行組織修復與替代的產品。細胞對于組織工程產品既是生產物料,也是產品組成成分。而且還要保持其特有的性能,才能保證植入人體后發揮其生物活性。當然,對于細胞來講,保證其供體的安全性,操作的規范性至關重要[1]。本文總結了從供體到細胞培養,到質量控制的基本指標。組織工程產品多樣,細胞來源也多樣,生產者應該根據自己產品的特點制定質量控制規程,以保證產品的安全性和有效性。

