己酮可可堿對間充質干細胞修復糖尿病腎病小鼠腎小球內皮細胞損傷的促進作用
查淑娟,晏繼喜
(武漢市武昌醫院急診醫學科,武漢 430063)
糖尿病腎病(diabetic nephropathy,DN)是糖尿病最常見的微血管并發癥,是糖尿病患者致殘與死亡的最主要原因之一,也是腎衰竭的原因之一。其患病率隨著糖尿病患病率的逐年升高而不斷升高,而且DN的預后極差,一旦發生,致死率極高[1-2]。臨床發現DN存在明顯的腎小球濾過率高、蛋白尿升高的現象[3]。腎小球內皮細胞是保護腎小球過濾系統的主要成分,細胞表面有大量的窗孔,對水及小分子具有高滲透性,而對蛋白質等大分子的滲透性很低,從而限制了蛋白質通過[4]。高血糖狀態下,腎小球內皮細胞嚴重受損[5],其結構和功能發生改變。研究表明,腎小球內皮細胞的結構和功能可能與腎衰竭和蛋白尿有關系[6-7]。因此,修復DN引起的腎小球內皮細胞損傷對治療DN具有重大的意義。
研究發現,間充質干細胞(mesenchymal stem cells,MSCs)具有修復組織、器官損傷的作用[8-9]。己酮可可堿(pentoxifylline,PTX)是一種非選擇性磷酸二酯酶抑制劑,具有減緩蛋白尿和保護腎功能的作用[10-11]。筆者以腎小球內皮細胞構建DN模型,探討PTX在MSCs對糖尿病腎病腎小球內皮細胞損傷修復的促進作用。
1 材料與方法
1.1實驗動物 野生清潔型C57BL/6小鼠4只,4~6周齡,購于湖北省疾病預防控制中心,動物合格證號:42000600020849。實驗動物飼養環境溫度22~26 ℃,相對濕度50%~60%,人工光照明暗12 h交替,自由進食和飲水。
1.2試劑 達爾伯克必需基本培養液(Dulbecco's minimum essential medium,DMEM)-LG(Hyclone,批號:SH30021.01);胎牛血清(BSA,Gibco,批號:10270-106);兔抗CD31抗體、兔抗血管內皮鈣粘蛋白(vascular endothelial cadherin,VE-Cadherin)、鼠抗內皮素(endothelin,ET)抗體、兔抗血管性血友病因子(von willebrand factor,vWF)抗體、鼠抗細胞間黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)抗體(Abcam,批號:ab28364、ab33168、ab2786、ab6994、ab171123);兔抗GAPDH(CST,批號:2118);磷酸鹽緩沖液(PBS)、0.25%胰蛋白酶、噻唑藍(MTT)、Percoll分離液、辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗兔IgG(Bioswamp,批號:PAB180003,PAB180002、PAB180013、PAB180042、PAB160011);CD30-APC、CD90-APC、CD105-APC(eBioscience,批號:17-0311-82、17-0909-41、17-1051-82);甲醛(國藥集團化學試劑有限公司,批號:10010018);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)轉移膜、化學發光試劑(Millipore,批號:IPVH00010、WBKLS0010);AnnexinV-FITC/PI凋亡檢測試劑盒(BD,批號:556547)。
1.3儀器 流式細胞儀(Beckman,型號:CytoFLEX SL);顯微鏡(Nikon,型號:TS100-F);倒置熒光顯微鏡(Olympus,型號:IX50);酶標儀(Thermo,型號:Multiskan FC);全自動化學發光分析儀(上海天能儀器有限公司,型號:Tanon-5200)。
1.4MSCs細胞分離與鑒定 取C57BL/6小鼠處死、消毒處理后于超凈臺上暴露骨髓腔。用注射器吸取無血清的DMEM-LG將骨髓沖洗至培養皿,反復吹打制成單細胞懸液。250×g離心10 min,棄上清液。加骨髓細胞懸液等體積的Percoll分離液(濃度為1.073 g·mL-1)于新離心管中,再加入細胞懸液,600×g離心30 min,取第二層于離心管中。然后用15%胎牛血清和DMEM-LG完全培養基于37 ℃、5%二氧化碳(CO2)培養箱中培養細胞。每隔3~4 d換液1次,10 d左右細胞達到80%~90%融合時進行傳代。
用0.25%胰蛋白酶消化處理生長良好的第3代細胞,吹打成單細胞懸液。離心棄上清液,然后用PBS清洗,并調整細胞密度為1×106個·mL-1。取4只EP管,各加入單細胞懸液100 μL,第1管設為正常對照組,其他三管分別加入CD90-APC、CD105-APC、CD30-APC,各2 μL,4 ℃避光孵育45 min。然后加入流式染色緩沖液重懸細胞400 μL,進行流式染色檢測。
1.5腎小球內皮細胞鑒定 取出腎小球內皮細胞培養皿,PBS清洗2次,加入多聚甲醛進行固定,PBS清洗3次。0.5%Triton X-100通透細胞后加入5%BSA,37 ℃封閉1 h。加入一抗(CD31、VE Cadherin)稀釋液置于濕盒內,4 ℃孵育過夜,PBS清洗后再加入二抗(FITC標記的單克隆抗體)稀釋液,37 ℃孵育1 h。PBS清洗后,染色并在熒光顯微鏡下觀察。
1.6PTX對MSCs和內皮細胞的毒性檢測 取指數生長期的MSCs細胞和腎小球內皮細胞,調整細胞濃度接種于96孔板中,每種細胞設置3個復孔,每孔單細胞懸液100 μL(每孔1×104個)。37 ℃培養過夜后,加入1 mmol·L-1(加入96孔板前濃度)PTX進行干預。培養24 h后,每孔加入5 mg·mL-1MTT溶液20 μL,繼續培養4 h。加入二甲亞砜(DMSO)150 μL溶解液,混勻后于酶標儀檢測波長490 nm處的吸光度(A)值。
1.7實驗分組 實驗分為6組:正常對照組、損傷組、MSCs組、MSCs+0.1 mmol·L-1PTX組、MSCs+0.3 mmol·L-1PTX組和MSCs+1 mmol·L-1PTX組。除正常對照組為正常腎小球內皮細胞外,其余5組均采用30 mmol·L-1葡萄糖溶液構建內皮細胞損傷模型,其中MSCs組、MSCs+0.1 mmol·L-1PTX組、MSCs+0.3 mmol·L-1PTX組和MSCs+1 mmol·L-1PTX組將受損細胞與MSCs細胞以1:10的濃度比分別接種于Transwell的上室和下室中進行共培養,并用濃度為0.1,0.3和1 mmol·L-1PTX對其中3組MSCs組細胞進行干預處理。
1.8腎小球內皮細胞存活率檢測 內皮細胞和MSCs細胞共培養24,48 h后,將6組的內皮細胞接種于96孔板中,接種密度為每孔3×103個,每組每個時間點設置3復孔,于37 ℃下培養48 h。然后每孔加入5 mg·mL-1MTT溶液20 μL,室溫孵育4 h后加入DMSO150 μL,混勻后在酶標儀檢測A490 nm值。
1.9流式細胞儀檢測細胞凋亡 根據實驗分組處理后培養48 h,然后PBS清洗貼壁細胞,用胰蛋白酶消化后離心收集細胞,PBS重懸細胞并計數。各組取5×105個細胞,用PBS清洗2次后,離心去上清液。用緩沖液重懸細胞,并加入Annexin V-FITC和PI各5 μL,混勻后4 ℃避光孵育30 min。隨后利用流式細胞儀進行細胞凋亡檢測。
1.10Western blotting檢測ET、vWF及ICAM-1表達 提取各組內皮細胞總蛋白,配制十二烷基硫酸鈉-聚丙烯酰胺凝膠,以每孔10 μL上樣量進行電泳。然后進行濕轉轉膜,將蛋白轉印到PVDF膜上。用5%脫脂奶粉溶液室溫封閉2 h。按照說明書稀釋抗體,與膜室溫孵育1 h。孵育了一抗(ET 1:500稀釋、vWF 1:500稀釋、ICAM-1 1:1000稀釋)的膜再與HRP標記的二抗(羊抗兔IgG 1:10 000稀釋)室溫孵育1 h,PBST洗滌3次,與化學發光劑混勻作用后置于化學發光分析儀中檢測,掃描條帶,通過軟件讀取條帶灰度值。
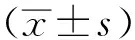
2 結果
2.1MSCs分離培養與鑒定 第3代MSCs細胞渦旋狀融合生長,形狀呈梭形,部分含有細小顆粒(圖1A)。利用流式細胞儀檢測表面標志物表達:CD90表達率94.78%,CD105表達率97.72%,陰性指標CD30表達率0.77%,細胞形態及細胞表面標志物鑒定結果符合MSCs特征(圖1B)。
A.第3代MSCs細胞(×100);B.流式細胞儀檢測MSCs表面抗原:空標;陽性指標:CD90、CD105;陰性指標:CD30。圖1 MSCs分離培養與鑒定A.MSCs cells of the third generation(×100);B.MSCs surface antigen detected by flow cytometry:blank;positive indicators:CD90,CD105;negative indicators:CD30.Fig.1 Isolation,culture and identification of MSCs
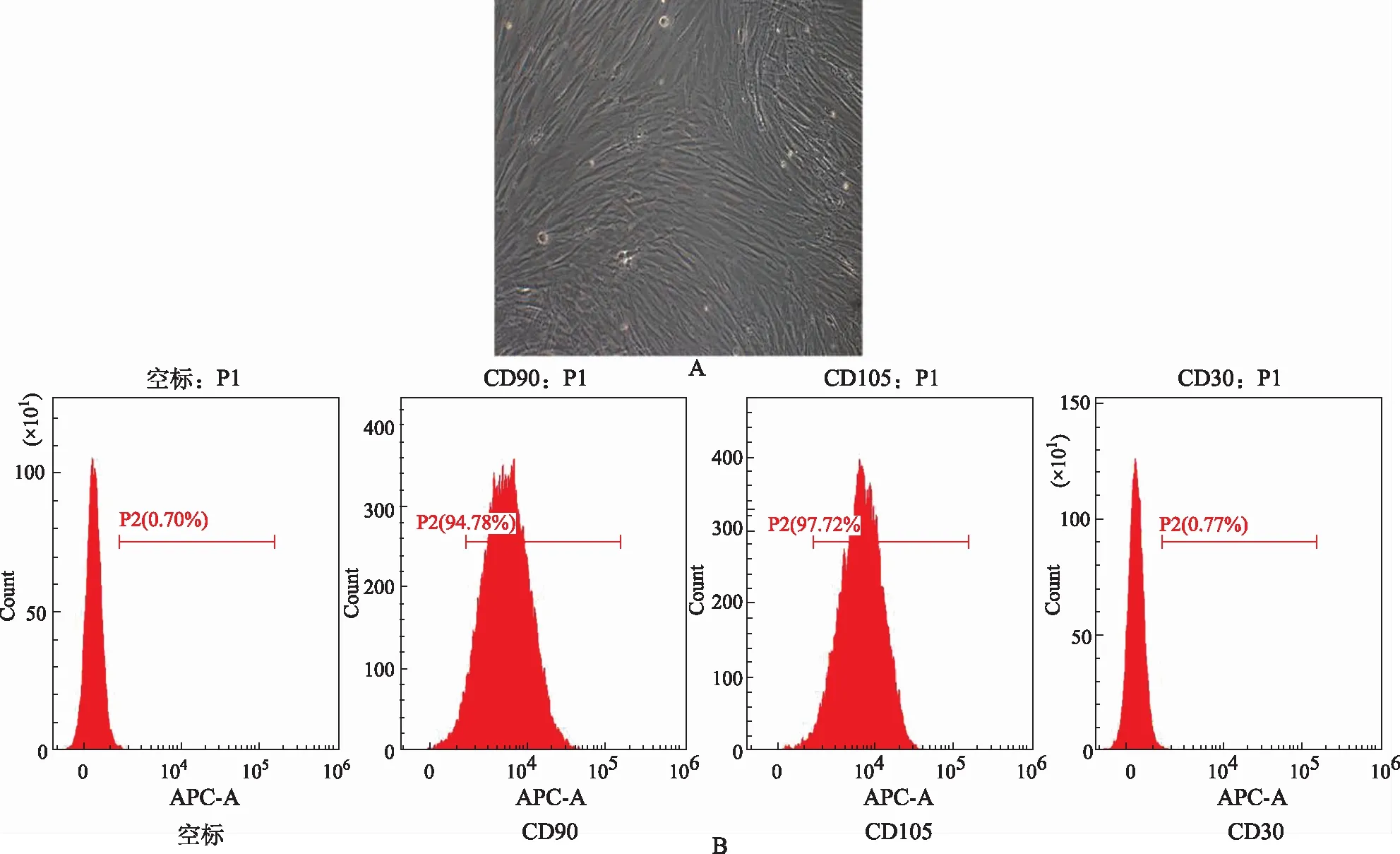
2.2腎小球內皮細胞鑒定 CD31為鑒定內皮細胞的膜蛋白,VE Cadherin是內皮細胞間一種主要的黏著蛋白。將培養的腎小球內皮細胞進行免疫熒光檢測,檢測結果見圖2,大部分細胞陽性表達CD31和VE Cadherin,說明該細胞為腎小球內皮細胞。
2.3PTX亞毒性檢測 MSCs細胞和腎小球內皮細胞接種培養24 h后,利用MTT檢測1 mmol·L-1PTX對細胞的毒性。MSCs細胞的生長率(79.40±0.12)%,腎小球內皮細胞的生長率(80.80±0.23)%,說明當PTX濃度為1 mmol·L-1時,對細胞的毒性較小。為了避免后續實驗中PTX本身的毒性作用,在本研究中均采用濃度≤1 mmol·L-1的PTX溶液干預細胞。
A.藍色顯示為細胞核,綠色顯示為特異性標志物CD31;B.藍色顯示為細胞核,紅色顯示為細胞間黏著蛋白VE Cadherin。圖2 腎小球內皮細胞CD31和VE Cadherin抗體免疫熒光染色(×400)A.nucleus (blue) and CD31,the specific marker (green);B.nucleus (blue) and VE Cadherin,the intercellular adhesion protein (red).Fig.2 Immunofluorescence staining of CD31 and VE Cadherin in glomerular endothelial cells(×400)
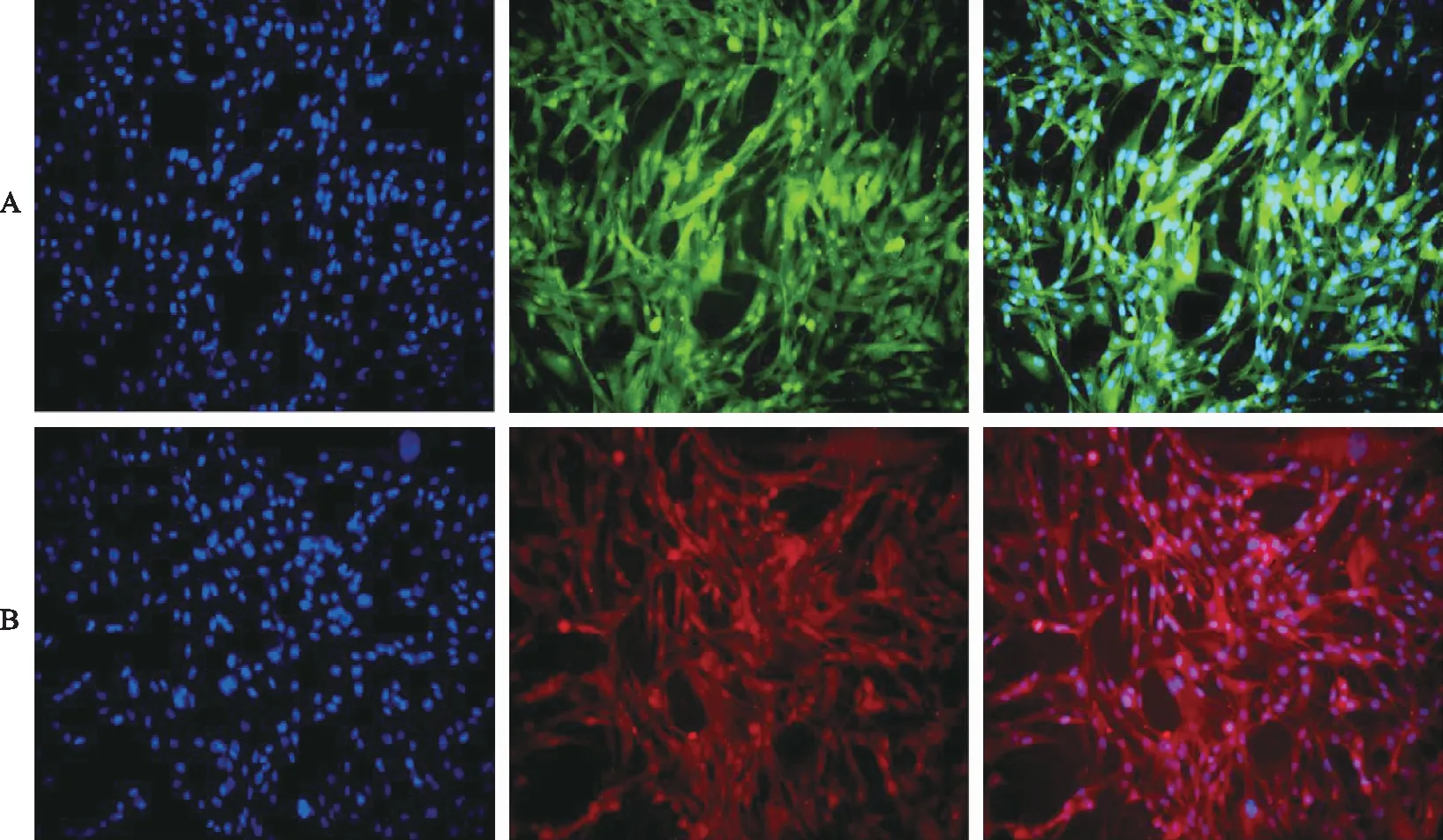
2.4PTX對高糖損傷內皮細胞增殖的影響 在相同的時間段,與正常對照組比較,損傷組內皮細胞的活力顯著降低(P<0.01)。與損傷組比較,MSCs組及PTX干預后MSCs組細胞活力增強(P<0.05或P<0.01)。與MSCs組比較,不同濃度PTX干預后,細胞活力均顯著增強(P<0.01),而且呈PTX濃度依賴性(圖3)。
①與正常對照組比較,t=15.452,19.763,P<0.01;②與損傷組比較,t=2.865~5.613,P<0.05;③與損傷組比較,t=16.397,P<0.01;④與MSCs組比較,t=18.322~20.308,P<0.01。圖3 6組細胞增殖水平比較①Compared with normal control group,t=15.452,19.763,P<0.01;② Compared with injury group,t=2.865-5.613,P<0.05;③ Compared with injury group,t=16.397,P<0.01;④ Compared with MSCs group,t=18.322-20.308,P<0.01.Fig.3 Comparison of the proliferation among six groups of cells
2.5PTX對高糖損傷內皮細胞凋亡的影響 凋亡檢測結果見圖4,與正常對照組比較,高糖刺激48 h后的損傷組細胞凋亡增加。與損傷組比較,MSCs組、MSCs+0.1 mmol·L-1PTX組、MSCs+0.3 mmol·L-1PTX組和MSCs+1 mmol·L-1PTX組的內皮細胞凋亡減少,而且呈現PTX濃度依賴性。
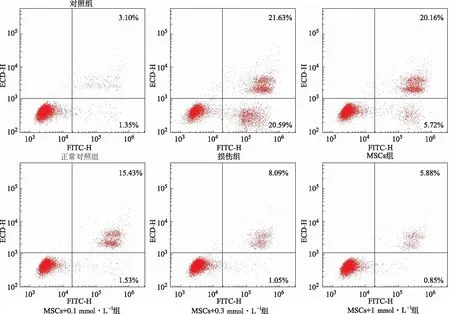
圖4 6組腎小球內皮細胞凋亡檢測Fig.4 Apoptosis detection of six groups of glomerular endothelial cells
2.6各組內皮細胞損傷標志物表達比較 與正常對照組比較,損傷組ET、vWF及ICAM-1蛋白水平均顯著升高(均P<0.01)。與損傷組比較,MSCs組和PTX干預的各MSCs組高糖誘導的損傷內皮細胞的ET、vWF和ICAM-1蛋白表達水平均降低(均P<0.05或P<0.01)。與MSCs組比較,不同濃度PTX干預后的MSCs組的ET、vWF和ICAM-1蛋白表達水平都有所下降,MSCs+1 mmol·L-1PTX組顯著下降(P<0.01),呈現PTX濃度依賴性(圖5)。
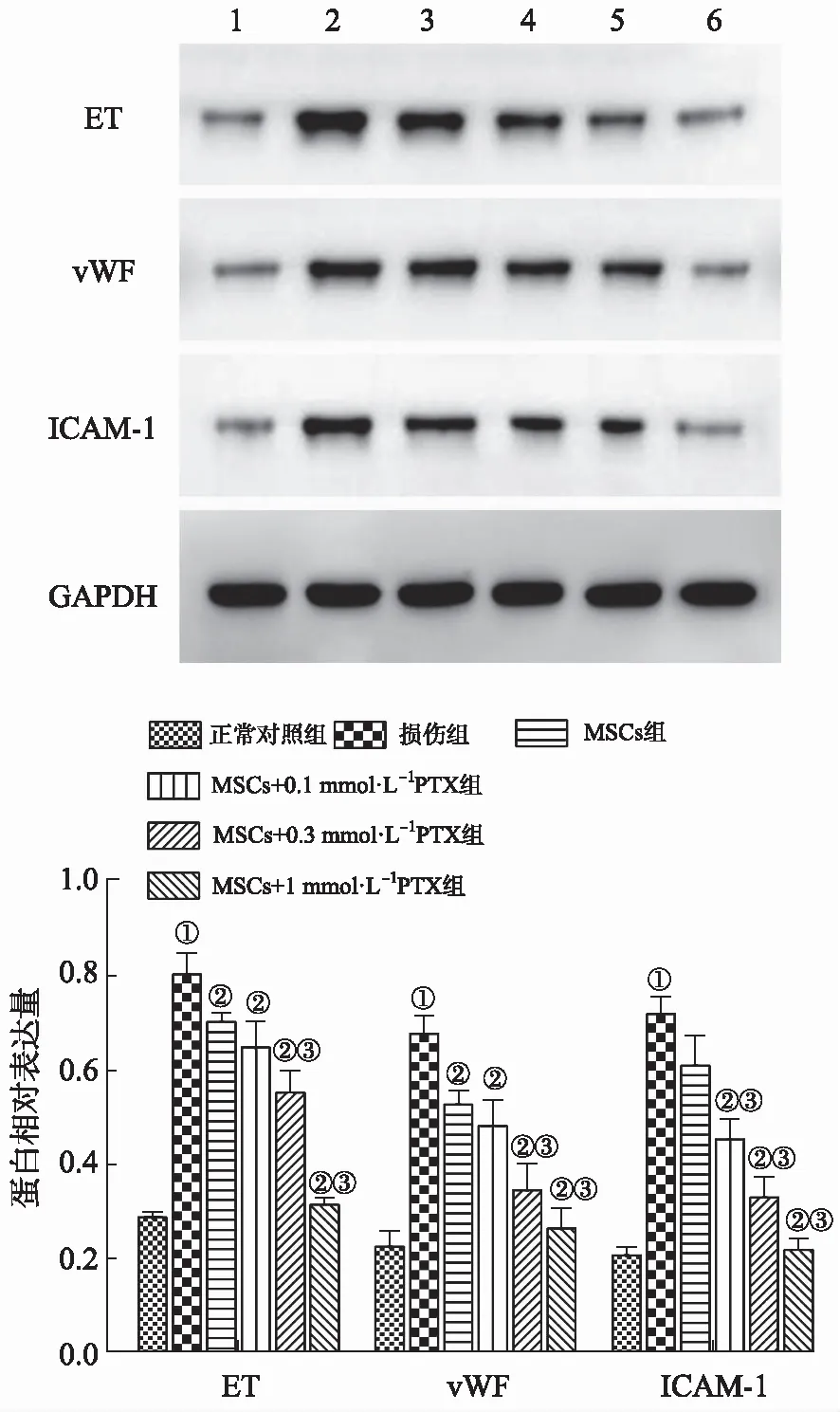
1.正常對照組;2.損傷組;3.MSCs組;4.MSCs+0.1 mmol·L-1 PTX組;5.MSCs+0.3 mmol·L-1 PTX組;6.MSCs+1 mmol·L-1 PTX組。①與正常對照組比較, t=20.487,16.735,24.582,P<0.01;②與損傷組比較,t=12.997~22.489,P<0.01;③與MSCs組比較,t=10.481~32.067,P<0.01。圖5 6組內皮細胞ET、vWF、ICAM-1蛋白表達比較1.normal control group;2.injury group;3.MSCs group;4.MSCs+0.1 mmol·L-1 PTX group;5.MSCs+0.3 mmol·L-1 PTX group;6.MSCs+1 mmol·L-1 PTX group.①Compared with normal control group,t=20.487,16.735,24.582,P<0.01;② Compared with injury group,t=12.997-22.489,P<0.01;③Compared with MSCs group,t=10.481-32.067,P<0.01.Fig.5 Comparison of the protein expression of ET,vWF and ICAM-1 among six groups of endothelial cells
3 討論
DN是糖尿病的高糖環境導致腎臟微血管發生的病變,最終可能發展為終末期腎衰竭[12]。DN是西方發達國家終末期腎病(end-stage renal disease,ESRD)的首要原因[13],也成為我國患者進行腎衰竭血液透析的第二大原因,是糖尿病患者死亡的主要原因之一,具有高發病率、無特異性治療及預后不良等特點[14]。糖尿病患者的腎小球選擇性濾過能力逐漸喪失,是西方發達國家的糖尿病演變為ESRD的最常見原因[15]。腎小球內皮細胞表面的窗孔是腎小球過濾屏障的重要成分,維持其結構和功能完好是腎小球正常過濾的基礎。但是,糖尿病患者長期的高血糖微環境會造成內皮細胞損傷,影響腎小球過濾系統的正常生理功能,這也是糖尿病患者出現蛋白尿癥狀的原因。
MSCs是一種成體干細胞,最初發現于骨髓中,具有多向分化的潛能。而且,MSCs能夠對受損細胞、組織及器官進行修復,如修復心肌梗死部位的心肌細胞[16],恢復腦外傷導致的腦神經功能受損[17]。PTX具有擴張微血管、抑制血小板聚集以及降低蛋白尿排泄等作用,還能緩解炎癥反應,減輕機體應激反應[18-19]。本研究基于高糖誘導的腎小球內皮細胞損傷模型,觀察PTX對MSCs修復糖尿病腎病腎小球內皮細胞損傷的影響。檢測PTX對MSCs和腎小球內皮細胞的毒性作用,結果顯示濃度<1 mmol·L-1的PTX對細胞的毒性作用較小,因此采用≤1 mmol·L-1的濃度(0.1,0.3和1 mmol·L-1)干預細胞。研究發現,在高糖環境下,腎小球內皮細胞的活力受到抑制,細胞凋亡增加[20-21]。本研究顯示,MSCs對受損的腎小球內皮細胞具有促增殖、抑凋亡作用,而PTX干預后,促進了MSCs的作用。
ET是一種具有持久收縮血管、調節血流的內皮縮血管肽,當內皮細胞受到外源性或內源性物質刺激時,ET會異常表達,大量釋放[22]。vWF是一種黏附性多聚糖蛋白,是內皮細胞生成的促凝因子,當內皮細胞受損時,vWF會大量合成并釋放,是重要的內皮細胞損傷標志物[23]。ICAM-1是一種細胞間黏附分子,王靜等[24]研究發現在脂多糖誘導的內皮細胞損傷模型中,ICAM-1、vWF等因子含量明顯高于正常內皮細胞。本研究結果表明,與正常對照組比較,高糖誘導的腎小球損傷內皮細胞的損傷分子標志物ET、vWF及ICAM-1蛋白表達量明顯升高,與文獻[24]報道一致。而與損傷組相比,MSCs組和PTX干預的MSCs組均降低了高糖刺激導致的內皮細胞損傷標志物表達量,尤其是PTX干預后的MSCs組各損傷標志物蛋白表達量顯著降低。
綜上所述,PTX可在一定程度上促進MSCs對糖尿病腎病小鼠腎小球內皮細胞增殖、凋亡抑制及損傷修復作用,并在小劑量范圍內呈現出濃度依賴性,具體作用機制還需進一步深入研究。

