荔枝核總黃酮對兩種肝纖維化大鼠模型的作用比較*
成秋宸,覃雯,卓朗,趙永忠,范麗雯,林文斯,劉瑞彪
(1.廣西藥用植物園西南瀕危藥材資源開發國家工程實驗室,南寧 530023;2.廣西醫科大學第一附屬醫院感染性疾病科,南寧 530023;3.桂林醫學院第一附屬醫院消化內科,桂林 541001;4.桂林醫學院第一附屬醫院檢驗科,桂林 541001)
荔枝核是我國南方的傳統中藥,具有行氣散結、驅寒止痛的功效[1]。荔枝核中的黃酮類化合物總稱為荔枝核總黃酮(total flavone ofLitchiChinensisSonn.,TFL),在抗肝纖維化、抗乙型肝炎病毒、抗氧化等方面均有較好的療效。本課題組前期研究發現TFL在體外可以抑制肝星狀細胞(hepatic stellate cells,HSCs)的增殖,影響炎癥通路中關鍵性因子核因子-κB(nuclear factor-kappaB,NF-κB)的表達,一定劑量下的TFL對膽管結扎(bild duct ligation,BDL)肝纖維化大鼠具有較好的退黃、抗纖維化等作用[2-3]。針對逆轉肝纖維化的藥物開發成為研究的熱點和重點。筆者復制了兩種常見的肝纖維化大鼠模型,觀察TFL對四氯化碳(carbon tetrachloride,CCl4)誘導肝纖維化大鼠和BDL肝纖維化大鼠的治療作用,并探討其作用機制。
1 材料與方法
1.1實驗材料
1.1.1實驗動物 SPF級SD大鼠40只,6周齡,雄性,體質量180~220 g,由廣西醫科大學實驗動物中心提供,合格證號:SCXK桂2009-0002,使用許可證號:SYXK桂2014-0003。入實驗室適應1周,相對濕度:50%~70%,溫度(25±1) ℃,12 h光照。
1.1.2試劑與儀器 TFL購自南京草本源生物科技有限公司( 含量:83.5%,批號:ZC16081016)。肝功能試劑盒:總膽紅素(total bilirubin,T-BiL)、血清堿性磷酸酶(ALP)、丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)購自美國Abbott公司,委托桂林醫學院第一附屬醫院檢驗科檢測;抗NF-кB單克隆抗體購自CST公司(批號:D14E12);抗環氧化酶2(cyclo-oxygenase 2,COX-2)單克隆抗體購自CST公司(批號:12282);抗α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)單克隆抗體購自Abcam公司(批號:32575);抗GAPDH單克隆抗體(TA-08)購自北京中杉金橋生物公司(批號:141205);組織切片掃描儀(LEICA SCN400)。
1.2實驗方法
1.2.1動物飼養及分組 將大鼠按照隨機數字表法分為5組:正常對照組、CCl4模型對照組、BDL模型對照組、CCl4+TFL組、BDL+TFL組,每組8只。CCl4模型對照組和CCl4+TFL組采用40%CCl4+60%玉米油混合液(4 mL·kg-1)灌胃法[4],每周2次,持續8周。BDL模型對照組和BDL+TFL組采用雙重膽管結扎后切斷法造模4周。CCl4+TFL組和BDL+TFL組每日1次分別灌胃給予TFL(300 mg·kg-1·d-1),正常對照組、CCl4模型對照組和BDL模型對照組給予0.9%氯化鈉溶液(300 mg·kg-1·d-1),持續時間均為4周。大鼠每日灌胃前稱體質量,并記錄。至各組末次灌胃結束后24 h內,放血法處死大鼠。
1.2.2血標本采集及生化指標檢測 從大鼠腹主動脈采血,4000 r·min-1離心10 min(r=12.5 cm),每個指標取血清200 μL,檢測T-BiL、ALP、ALT、AST含量。
1.2.3形態學及病理學觀察 取肝臟、脾臟測量并稱濕質量,計算肝脾指數(肝指數=肝臟濕質量/體質量;脾指數=脾臟濕質量/體質量)。取大鼠肝右葉,4%多聚甲醛溶液固定,石蠟包埋,切片行Sirius red染色,切片掃描,采用Aperio ImageScope12.3版軟件計算膠原面積百分比(膠原面積百分比=切片中膠原染色面積/切片中肝臟組織面積×100%)[5]。
1.2.4免疫組織化學法檢測α-SMA、CollagenⅠ在肝臟組織中的表達 按照Envision法試劑盒說明書操作,采用0.01 mol·L-1檸檬酸鈉(pH值6.0)高溫高壓修復法,一抗[α-SMA(1:400)、CollagenⅠ(1:400)]孵育2 h,二抗孵育20 min,二氨基聯苯胺(diaminobenzidine,DAB)顯色,蘇木精復染,脫水、透明、封片。陰性對照以磷酸鹽緩沖液(PBS)代替一抗。α-SMA以細胞質呈現棕黃色為陽性區域,CollagenⅠ以細胞間質呈棕黃色為陽性區域。根據染色面積及染色強度,采用Imag J半定量法進行圖像分析。
1.2.5Western blotting 檢測α-SMA、NF-κBp65、COX-2蛋白的表達 肝臟組織勻漿,RIPA強堿性裂解液,離心,上清液即為總蛋白,BCA法進行蛋白定量,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrop-horesis,SDS-PAGE),濕轉法轉膜,封閉液封閉1 h,一抗(GAPHD、α-SMA、NF-кB p65、COX-2)1:1000比例稀釋,4 ℃孵育過夜,室溫孵育二抗(1:5000)1 h,洗滌,電化學發光法(electrochemiluminescence,ECL)顯影,暗室曝光洗片,以內參GAPDH為標準,Image J測算吸光度(A值),計算每組蛋白的相對表達量[6],重復3次求平均值。
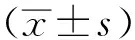
2 結果
2.1各組大鼠血清肝功能指標含量 CCl4模型中,TFL給藥組ALP、ALT、AST水平均明顯下降(P<0.05);BDL模型中,TFL給藥組T-BiL、ALP、ALT水平均明顯下降(P<0.05)。表明TFL對CCl4模型和BDL模型大鼠肝功能有較好的改善作用,其中在CCl4模型中TFL以降低ALP、ALT、AST指標為主;在BDL模型中TFL以降低T-BiL、ALP、ALT為主。故TFL在CCl4模型中降低AST指標的作用優于BDL模型,而BDL模型中降低T-BiL方面則優于CCl4模型。見表1。

表1 5組大鼠血清中T-BiL、ALP、ALT、AST含量測定結果Tab.1 Determination results of the serum level of T-BiL,ALP,ALT and AST in five groups of rats
2.2各組大鼠肝纖維化程度及肝脾指數比較 CCl4大鼠模型中肝指數以下降為主,加用TFL后肝指數升高,趨于正常,與正常對照組比較,差異無統計學意義。BDL大鼠模型中,肝脾指數明顯增高(F=29.47,66.30,P<0.01);加用TFL后,肝指數下降,與正常對照組比較,肝指數差異有統計學意義(F=29.47,P<0.01),脾指數顯著下降,與BDL模型對照組比較,差異有統計學意義(F=66.30,P<0.01)。見圖1。
根據全切片掃描軟件計算染色區域纖維化的面積,兩種模型中膠原面積均顯著升高,較正常對照組差異有統計學意義(F=22.64,P<0.01),在兩種模型中分別應用TFL,膠原面積均有所下降(F=22.64,P<0.01),其中CCl4模型大鼠肝臟膠原面積的降低十分顯著,與CCl4模型對照組比較差異有統計學意義(F=22.64,P<0.01)。見圖1。

A.正常對照組;B.CCl4模型對照組;C.CCl4+TFL組;D.BDL模型對照組;E.BDL+TFL組。①與正常對照組比較,P<0.01;②與BDL模型對照組比較,P<0.01;③與CCl4模型對照比較,P<0.01。圖1 5組大鼠肝脾指數及膠原面積比較(n=8)A.normal control group;B.CCl4 model control group;C.CCl4+TFL group;D.BDL model control group ;E.BDL+TFL group.①Compared with normal control group,P<0.01;②Compared with BDL model control group,P<0.01;③Compared with CCl4 model control group,P<0.01.Fig.1 Comparison of liver index,spleen index and the percent of liver collagen area among five groups of rats(n=8)
在CCl4模型中TFL以降低肝纖維化的膠原面積為主;在BDL模型中TFL以降低脾指數和肝纖維化程度為主。故TFL在BDL模型中降低大鼠脾指數的作用優于CCl4模型,而兩種模型大鼠肝纖維化的膠原面積都明顯降低。
2.3各組大鼠肝組織 α-SMA、CollagenⅠ蛋白表達(免疫組織化學法檢測) 正常對照組α-SMA、CollagenⅠ蛋白微量表達,CCl4模型對照組與BDL模型對照組α-SMA、CollagenⅠ蛋白呈陽性表達,較正常對照組差異有統計學意義(P<0.01)。CCl4+TFL組與BDL+TFL組中α-SMA、CollagenⅠ蛋白表達較各自的模型對照組有減弱,秩均值有下降,但下降不明顯,差異無統計學意義。見表2。

表2 5 組大鼠α-SMA、CollagenⅠ免疫組織化學檢測結果比較Tab.2 Comparison of immunohistochemical results of α-SMA and Collagen I among five groups of rats
2.4各組大鼠肝組織中α-SMA、NF-κBp65、COX-2蛋白的表達(Western blotting檢測) 在CCl4模型中,TFL干預后,NF-κBp65與COX-2蛋白在肝臟中的表達量均較CCl4模型對照組有所降低(P<0.05);在BDL模型中,NF-κBp65、α-SMA與COX-2蛋白的表達量較模型對照組均顯著降低(F=911.60,895.26,2386.42,P<0.05)。見圖2—圖4。故TFL在BDL模型中降低大鼠肝臟α-SMA表達的作用優于CCl4模型,而且在兩種模型大鼠肝臟中NF-κBp65與COX-2蛋白的表達都顯著降低。

A.正常對照組;B.CCl4模型對照組;C.CCl4+TFL組;D.BDL模型對照組;E.BDL+TFL組。圖2 5組大鼠肝臟組織光鏡HE和Sirius red染色結果(×200,n=8)A.normal control group;B.CCl4 model control group;C.CCl4+TFL group;D.BDL model control group ;E.BDL+TFL group.Fig.2 H&E staining and Sirius red staining on livers in five groups of rats(×200,n=8)

A.正常對照組;B.CCl4模型對照組;C.CCl4+TFL組;D.BDL模型對照組;E.BDL+TFL組。圖3 5組大鼠肝臟組織光鏡α-SMA、CollagenⅠ蛋白IHC染色結果(×200,n=8)A.normal control group;B.CCl4 model control group;C.CCl4+TFL group;D.BDL model control group ;E.BDL+TFL group.Fig.3 Immunohistochemistry(IHC) staining on α-SMA and CollagenⅠ in livers in five groups of rats(×200,n=8)

A.正常對照組;B.CCl4模型對照組;C.CCl4+TFL組;D.BDL模型對照組;E.BDL+TFL組。①與正常對照組比較,P<0.05;②與CCl4模型對照比較,P<0.05;③與BDL模型對照組比較,P<0.05。圖4 5組大鼠肝組織α-SMA、NF-κBp65、COX-2蛋白表達(n=3)A.normal control group;B.CCl4 model control group;C.CCl4+TFL group;D.BDL model control group;E.BDL+TFL group.①Compared with normal control group,P<0.05;②Compared with CCl4 model control group,P<0.05;③Compared with BDL model control group,P<0.05.Fig.4 The protein expression of α-SMA、NF-κBp65 and COX-2 in livers in five groups of rats(n=3)
3 討論
CCl4造模的肝纖維化大鼠屬于化學損傷性肝纖維化模型[7],其組織病理以肝細胞變性、壞死,假小葉形成為主,適合模擬臨床化學藥物損傷性肝病。膽管結扎造模的肝纖維化大鼠屬于膽汁淤積性肝纖維化模型[8],其組織病理以大量的新生膽管,膽汁淤積,細胞變性,炎癥細胞浸潤為主要改變,適合模擬臨床膽管堵塞、寄生蟲、先天膽管畸形等膽汁淤積性肝病。本研究選用兩種常見的肝纖維化大鼠模型,從血清學指標、病理、分子指標比較一定劑量TFL對模型大鼠的作用。兩種模型的發病原因不同、病理特征不同、臨床表現也不同,但是TFL均可以減緩甚至逆轉其肝纖維化的發展進程。可以為尋求“異病同治”、開發具有潛在抑制上皮間質轉化靶點的藥物提供基礎[9]。
血清酶學ALT、AST是反映肝細胞是否損傷和壞死的主要指標[10-11],當肝細胞受損時,ALT和AST升高。ALP被認為是膽汁淤積和膽道損傷的標志物[12],血清ALP升高可提示膽汁淤積。研究表明,ALP還可評估膽汁淤積的預后情況[13]。本研究血清學結果表明,在降低ALT方面,TFL對CCl4模型的作用更為顯著;在降低ALP方面,TFL對BDL模型的作用更為顯著。在BDL模型中,脾指數和肝臟組織切片中膠原面積的降低更為顯著。結果提示,在CCl4和BDL肝纖維化大鼠模型中,TFL均有較好的療效。
HSCs的激活被認為是肝纖維化形成過程中的關鍵環節[6,14],α-SMA的大量表達被認為是HSCs活化的標志[15]。本實驗中免疫組織化學檢測結果顯示兩種模型的α-SMA下降均不明顯。而在Western blotting實驗中,BDL模型中的TFL給藥組下降較模型對照組顯著。NF-κBp65被認為是多條炎癥信號轉導通路中的核心分子,NF-κBp65的活化可導致下游多種炎癥因子的表達增強,加劇炎癥損傷,長期的炎性刺激可導致肝臟纖維化[16-17]。本實驗中兩種肝纖維化模型給藥組中的NF-κBp65下降均顯著,故可推斷TFL主要通過抑制NF-κBp65來發揮抗纖維化作用。COX-2是啟動炎癥反應、促進細胞增殖、抑制細胞凋亡的重要因子。COX-2在肝纖維化發生后表達普遍升高,使用COX-2抑制劑后,HSCs活化明顯減少[18]。本實驗中,在應用了TFL之后,COX-2的表達較各自的模型對照組均顯著降低。表明TFL對COX-2有一定的抑制作用。TFL可能通過抑制COX-2來抑制HSCs的活化和增殖,從而達到抗纖維化的效果。
綜上所述,TFL適用于CCl4誘導的肝纖維化大鼠和BDL肝纖維化大鼠,在CCl4模型中以降低血清酶學指標為主,在BDL模型中以降低淤膽狀態為主,抑制NF-κBp65和COX-2蛋白的表達可能是其作用的分子機制。

