鹿茸蛋白提取物對帕金森模型秀麗隱桿線蟲毒性作用與藥理作用的研究
趙鑫 陳思 王毅 劉洋 孫婭楠 何忠梅
帕金森病(Parkinson’s disease,PD)是繼阿爾茨海默癥之后的第二大神經退行性疾病,流行病學研究表明,在全世界范圍內,PD患者在65歲以上人群中占1%~2%,在85歲以上人群中占4%~5%[1]。現代研究認為,PD發病部位在大腦黑質區多巴胺神經元丟失引起的體內多巴胺分泌量的降低,繼而出現震顫、運動遲緩、肌肉僵直等一系列運動功能障礙。目前,臨床上指導推薦藥物多為左旋多巴為代表的復方多巴制劑及抗膽堿類藥物[2]。但是多巴制劑僅能緩解發病,并不能從根本上治療帕金森病。
中醫認為,鹿茸性溫,入肝、腎經。鹿茸是迄今為止唯一發現的哺乳動物可再生附屬器官[3]。現代藥理學研究表明,鹿茸有很強修復再生能力。鹿茸不僅能夠促血管再生[4],還能促進表皮和成纖維細胞增殖及皮膚創傷愈合[5]。且大量研究表明,鹿茸對神經系統具有保護作用[6]。這為鹿茸用于治療神經系統損傷性疾病提供了一定的理論依據。但現有的研究在肯定了鹿茸修復神經損傷作用的同時,并未對其毒性進行過系統研究[7]。本課題組前期得到一組可促進神經生長作用的鹿茸蛋白提取物。通過鹿茸蛋白提取物給藥造模大鼠證實鹿茸蛋白提取物能夠治療大鼠帕金森病,并且研究發現鹿茸蛋白提取物中標記的蛋白成分可以透過血腦屏障[8]。而后給藥損傷的SH-SY5Y細胞,發現鹿茸蛋白提取物可以保護神經細胞,促進神經細胞生長。本實驗依賴于秀麗隱桿線蟲(C.elegans)這一模式生物,從表型上觀察到其對帕金森模型線蟲A30P(以下簡稱A30P線蟲)樹突的修復作用,但是藥物起藥效作用的安全劑量范圍尚需進一步研究。本實驗在前期研究的基礎上觀察鹿茸蛋白提取物對A30P線蟲生存率、生長發育、運動行為、樹突恢復等方面的影響,探究鹿茸蛋白提取物的毒性及其藥理學作用,篩選出最佳藥效劑量范圍。
1 材料與方法
1.1 實驗藥品
梅花鹿鹿茸(購自吉林云鹿集團),經中國中醫科學院醫學實驗中心形態學實驗室王毅研究員鑒定為梅花鹿(Cervusnippon)的鹿茸。
1.2 線蟲品系
秀麗隱桿線蟲A30P(Pdat-1::α-sny::GFP)、缺陷型大腸桿菌菌株(E.coli OP50),均由日本Tomoki Kuwahara博士惠贈。
1.3 實驗試劑
瓊脂(國藥試劑)、細菌蛋白胨(Oxoid)、疊氮鈉(Sigma)、5-氟尿嘧啶(Sigma)、BCA蛋白試劑盒(碧云天),其他所需化學試劑均購自國藥集團化學試劑北京有限公司。
1.4 實驗儀器
FD-1D-50冷凍干燥機(北京博醫康實驗儀器有限公司),R-215旋轉蒸發儀(瑞士步琦有限公司),P1000D透析袋(索萊寶公司),85-2A磁力攪拌器(鄭州恒巖儀器有限公司),恒溫培養箱(Taisite公司),OSE-MC8離心機(Tiangen biotech公司),體視顯微鏡(Motic公司),MPE FV1000雙光子顯微鏡(奧林巴斯公司)。
1.5 藥材處理
新鮮鹿茸直接液氮速凍后置入超微粉碎機中,加適量水粉碎至肉糜狀。取已經破碎的鹿茸糜狀物,按照1∶10(W/V)的比例加入雙蒸水,取適量冰醋酸調節pH=4,攪拌過夜后離心取上清并濃縮。將濃縮好的上清液放入透析袋透析脫鹽,將除鹽的鹿茸蛋白提取物溶液旋蒸并凍干保存。
1.6 蛋白含量測定
采用BCA試劑盒法檢測所得鹿茸蛋白提取物中蛋白含量。按照BCA蛋白試劑盒說明書配置梯度蛋白標準品,并以50∶1的比例混合A液與B液。取各個稀釋要求濃度的標準品和待測蛋白質樣品25 μL加入到96孔板中,并且每個樣品孔加入200 μL工作液振蕩混勻。37℃孵育30分鐘,在595 nm下測量OD值,并計算蛋白濃度。
1.7 蛋白分子量測定
分別配置10%分離膠和5%濃縮膠進行SDS-PAGE蛋白電泳。首先將鹿茸蛋白提取物干粉溶解配置成為1 mg/mL濃度蛋白溶液。按比例加入5×上樣緩沖液后,50℃煮沸3分鐘。上樣體積分別為20 μL與10 μL。起始電壓為80 V,待溴酚藍指示劑進入分離膠時調整電壓升高至120 V,溴酚藍指示劑消失即停止電泳。然后用考馬斯亮藍染液搖床振蕩染色45分鐘后脫色過夜。完全脫色后觀察鹿茸蛋白及標準蛋白條帶分布并進行對比。
1.8 樣品制備
取適量凍干的鹿茸蛋白提取物干粉,加入M9緩沖液完全溶解后,用0.22 μm微孔濾膜過濾除菌,4℃保存備用。待使用時按濃度要求稀釋。
1.9 線蟲培養與線蟲同步化
將OP 50大腸桿菌均勻涂抹在NGM瓊脂板上,37℃培養過夜。每隔2天轉移線蟲到新的含菌NGM瓊脂板上,20℃培養箱恒溫培養[9]。用M9輕輕從NGM板上洗下產卵期A30P線蟲,收集在1.5 mL離心管中。靜置后4000 g離心1分鐘后棄上清液,加入適量M9,反復清洗3次。加入1 mL線蟲裂解液,振蕩混勻1分鐘,離心去上清。加入M9反復清洗3~5次后加入空白NGM板中孵育過夜,即得到同步化L1期A30P線蟲。
1.10 生長發育實驗
將同步化后L1期的A30P線蟲加入到混有不同濃度鹿茸蛋白提取液與OP50大腸桿菌的NGM板上。培養線蟲48小時后,用MOTIC體視顯微鏡拍照并計算線蟲體長。每組統計10條線蟲。
1.11 生殖實驗
將同步化的L1期A30P線蟲加入到混有不同濃度鹿茸蛋白提取液與OP50大腸桿菌的NGM板上。培養線蟲48小時到達懷孕期后,轉移線蟲至新的不含藥的NGM板中。每板1條線蟲,每組10板。待24小時后,移出孕蟲。計數每板子代卵的數量。
1.12 生存率實驗
將同步化的L4期A30P線蟲加入不同濃度的鹿茸蛋白提取液中,置于96孔板,每孔約20條線蟲。置于20℃培養箱培養24小時,在顯微鏡下計數各組線蟲存活個數。線蟲死亡標準:身體僵直,鉑絲輕觸頭部無反應。
1.13 身體彎曲頻率實驗
將同步化后培養至L4期的A30P線蟲加入到混有不同濃度鹿茸蛋白提取液與OP50大腸桿菌的含有5-氟尿嘧啶的NGM板上。培養線蟲3天后,轉移線蟲至新的不含藥的NGM板中恢復1分鐘。顯微鏡下觀察錄制線蟲30秒內身體彎曲次數,身體呈Ω型記為一次彎曲次數。每組統計10只線蟲。
1.14 神經恢復實驗
將同步化后培養至L4期的A30P線蟲加入到混有不同濃度鹿茸蛋白提取液與OP50大腸桿菌的含有五氟尿嘧啶的NGM板上。培養線蟲3天后,將線蟲用2 mM疊氮麻醉后轉移至含有2%瓊脂墊的載玻片上,蓋上載玻片,雙光子顯微鏡下觀察拍照。每一條點狀樹突記為1分,每一條線狀樹突記為2分,計算每一只線蟲樹突得分(注:恢復1條點狀樹突、2條線狀樹突,樹突得分即為5)。統計各組線蟲樹突評分,每組統計10條線蟲。
1.15 統計學處理

2 結果
2.1 鹿茸蛋白提取物中蛋白含量與分子量分析
BCA試劑盒法測得蛋白線性回歸方程y=2.8419x-0.2857R2=0.9962,計算得出鹿茸蛋白提取物中蛋白含量為76%。從SDS-PAGE蛋白電泳圖可以得出鹿茸蛋白廣泛分布于55~250 kD之間,多為大分子蛋白。著重分布于130 kD附近,以及70~55 kD之間。見圖1。

圖1 鹿茸蛋白提取物SDS-PAGE蛋白電泳圖
2.2 不同濃度鹿茸蛋白提取物對A30P線蟲生長發育的影響
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培養A30P線蟲48小時后,A30P線蟲體長如表1所示。與0 mg/mL濃度相比,各濃度給藥組體長并無統計學差異(P>0.05)。
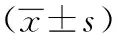
表1 不同濃度鹿茸蛋白提取物對A30P線蟲體長的影響
2.3 不同濃度鹿茸蛋白提取物對A30P線蟲生殖能力的影響
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培養A30P線蟲至孕期后,A30P線蟲24小時內排卵量如表2所示。與0 mg/mL濃度相比,當給藥濃度達到8 mg/mL時,A30P線蟲產卵量降低(P<0.05),4 mg/mL藥物濃度時有明顯的下降趨勢但無統計學差異(P>0.05),2 mg/mL以下濃度組線蟲排卵量并無明顯差異(P>0.05)。
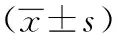
表2 不同濃度鹿茸蛋白提取物對A30P線蟲生殖能力的影響
2.4 不同濃度鹿茸蛋白提取物對A30P線蟲生存率的影響
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物暴露A30P線蟲24小時后,A30P線蟲存活率如表3所示。與0 mg/mL濃度相比,4 mg/mL對線蟲存活率有下降趨勢但無統計學差異,2 mg/mL及以下濃度對A30P線蟲的生存沒有影響。但是當濃度為8 mg/mL暴露時,A30P線蟲的生存率顯著降低(P<0.05)。
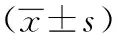
表3 不同濃度鹿茸蛋白提取物對A30P線蟲生存率的影響
2.5 不同濃度鹿茸蛋白提取物對A30P線蟲運動的影響
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培養L4期線蟲3天后,A30P線蟲運動及身體彎曲頻率如表4所示。圖2a為0 mg/mL濃度A30P線蟲連續6秒內運動,線蟲身體呈現半圓形轉動。圖2b為給藥2 mg/mL組A30P線蟲連續6秒內運動,線蟲身體Ω型爬行。與0 mg/mL濃度相比,1、2 mg/mL以及4 mg/mL濃度對線蟲身體彎曲頻率明顯增加,且有統計學顯著差異(P<0.01),4 mg/mL與其他兩組比較有明顯差異(P<0.01)。
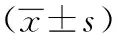
表4 不同濃度鹿茸蛋白提取物對A30P線蟲身體彎曲頻率的影響
2.6 不同濃度鹿茸蛋白提取物對A30P線蟲神經恢復的影響
0、0.125、0.25、0.5、1、2、4、8 mg/mL鹿茸蛋白提取物培養L4期A30P線蟲3天后,A30P線蟲樹突恢復情況如圖3所示。A為0 mg/mL濃度,A30P線蟲樹突退化,其余給藥組樹突有不同程度恢復。B、C幾乎沒有樹突恢復,D分別恢復一條線狀樹突與點狀樹突,E清晰可見恢復一條線狀樹突與一條點狀樹突,F、G分別恢復兩條與三條線狀樹突,H恢復一條點狀樹突。與0 mg/mL濃度相比,0.25 mg/mL以上濃度能顯著恢復A30P線蟲樹突比率,0.25、0.5、1、2、4、8 mg/mL恢復比率依次升高(P<0.01)。見表5。
2、4、8 mg/mL相比于0.25 mg/mL濃度明顯升高,差異有統計學意義(P<0.01)。1 mg/mL及以上濃度對A30P線蟲樹突恢復評分有明顯增長趨勢,差異有統計學意義(P<0.05)。見表6。

表5 不同濃度鹿茸蛋白提取物對A30P線蟲的樹突恢復比率的影響
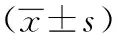
表6 不同濃度鹿茸蛋白提取物對A30P線蟲的樹突計分的影響

注:圖為12倍鏡顯微鏡下的A30P線蟲;a為0 mg/mL濃度組,b為給藥2 mg/mL濃度組。

注:圖為25倍雙光子顯微鏡下拍攝A30P線蟲熒光圖片;A~H給藥濃度依次為0、0.125、0.25、0.5、1、2、4、8 mg/mL。
3 討論
秀麗隱桿線蟲在由英國Brenner[10]提出并作為一種新的模式生物,廣泛應用在分子生物學和發育生物學等研究領域。隨后Sulston[11]繪制完成了線蟲細胞譜系圖,使得線蟲成為了唯一一種體內細胞均能被追蹤的模式生物。秀麗隱桿線蟲體型小、體長僅1 mm。身體透明,在普通光學顯微鏡下均能追蹤觀察。生命周期短暫卻完整,在20℃條件下,秀麗隱桿線蟲的平均壽命為2~3周,而產生下一代僅需要四天左右。以上諸多優勢使秀麗隱桿線蟲成為了當今生命科學和醫學領域研究中最重要的模式生物之一。目前,科學家建立了大量的秀麗隱桿線蟲疾病模型和成熟的方法來模擬人類疾病,如糖尿病模型、肥胖模型、衰老模型、帕金森模型、阿爾茨海默癥模型等[12-13]。
就帕金森病模型而言,通常采用MPP+[14]或魚藤酮[15]誘導秀麗隱桿線蟲神經元損傷的方法僅僅模擬外部環境因素對機體造成的損傷。而帕金森病模型線蟲A30P模擬了人體遺傳因素導致的帕金森病。本實驗研究采用的帕金森模型線蟲A30P轉入了人的α-突觸核蛋白,在8個多巴胺神經元中可以檢測到Pdat-1::EGFP熒光(頭部6個,即CEP和ADE神經元,后部區域有2個,即分別是PDE神經元)以及多巴胺神經元的前后神經突。并且線蟲CEP樹突的EYFP標記隨著生長發育持續減少,3日齡A30P線蟲表達EYFP減少90%[16]。符合人類帕金森發病機理,神經元不斷退化缺失,并且線蟲行為表現為運動障礙,不能正常爬行前進。故以A30P線蟲作為帕金森病模型研究鹿茸蛋白提取物的毒性作用與藥理作用。
對于鹿茸蛋白提取物毒性實驗采用三個指標,生存率、體長以及產卵率。生存率是研究藥物毒性最直觀的評價指標;體長及體寬反映線蟲生長發育情況;后代數反映出藥物對線蟲生殖能力的影響;不同濃度鹿茸蛋白提取物暴露A30P線蟲后,8 mg/mL鹿茸蛋白提取物降低了A30P線蟲的存活率(P<0.05),且抑制A30P線蟲產卵(P<0.05)。4 mg/mL鹿茸蛋白提取物有降低A30P線蟲的存活率及抑制A30P線蟲產卵的趨勢,但無統計學差異。培養線蟲48小時后,對線蟲體長的影響差異無統計學意義。根據毒性實驗結果推測這一現象與藥物滲透壓有關。鹿茸蛋白提取物多部分為55 kD以上大分子蛋白質,蛋白含量為76%。并且隨著濃度的增加,滲透壓也隨之升高(結果未在本實驗顯示)。線蟲結構簡單,皮下組織及腸道共同調節線蟲體內滲透壓平衡。并且由排泄細胞、導管細胞和孔細胞代替人體“腎”的功能[17]。一旦滲透壓平衡被打破,線蟲的生理結構功能則會出現異常,甚至吸水脹破而導致死亡。
對于藥理實驗采用兩個指標:評價樹突恢復以及評價運動能力。線蟲的運動行為能反映其神經系統基本功能,常用線蟲的身體彎曲頻率作為其運動行為的評價指標。結果表示,1、2 mg/mL以及4 mg/mL濃度對線蟲身體彎曲頻率明顯增加,且有顯著統計學差異(P<0.01),4 mg/mL與其他兩組比較有明顯差異(P<0.01)。0.25 mg/mL及以上濃度能夠提高線蟲樹突恢復比例,1 mg/mL及以上濃度對A30P線蟲樹突恢復評分有明顯增長趨勢。2、4、8 mg/mL對A30P線蟲樹突有明顯恢復作用。說明鹿茸蛋白提取物能夠保護A30P線蟲神經元的退化缺失,恢復A30P線蟲運動能力,從而達到治療A30P線蟲帕金森病的目的。綜合毒性實驗結果及藥理實驗結果,1、2 mg/mL以及4 mg/mL鹿茸蛋白提取物為安全有效劑量。
本實驗以帕金森模型線蟲為研究對象,探究了不同濃度鹿茸蛋白提取物對線蟲的毒性作用與藥理作用,以確定鹿茸蛋白提取物最佳給藥濃度,為后續鹿茸蛋白提取物治療帕金森病提供研究依據。

