銀杏二萜內酯對腦缺血大鼠學習記憶能力的影響及機制研究
霍好利
缺血性腦卒中是導致血管性癡呆的主要病因,而學習記憶功能障礙是其早期的主要臨床表現[1,2]。銀杏二萜內酯類主要來自于銀杏葉,其銀杏二萜內酯葡胺注射液(diterpene ginkgolides meglumine injection,DGMI)主要是由銀杏內酯組成,研究發現DGMI能夠抑制氧化應激和抑制體內的細胞凋亡[3-6],但其是否可以改善患者腦缺血后的學習記憶能力尚未見文獻報道,本實驗將復制腦缺血大鼠模型并行DGMI治療,從而研究DGMI對患者腦缺血后的影響和作用機制。
1 材料與方法
1.1 實驗動物 河北省實驗動物中心購買健康清潔級的雄性SD大鼠(8周齡,體重220~260 g,動物合格證號:201809014)。大鼠飼養溫度23℃~25℃,飼養環境的相對濕度為55%~60%,飼養光照的周期為12 h∶12 h,大鼠在適應性飼養1周后再進行實驗,且手術前需常規24 h禁食,可以自由飲水。
1.2 藥物與試劑 江蘇康緣藥業股份有限公司生產的DGMI(規格:25 mg∶5 ml,批號:20170416);北京博奧森生物技術有限公司生產的TUNEL試劑盒(批號:170417);上海碧云天生物技術有限公司生產的Bcl-2抗體(批號:071209)、Bax抗體(批號:180113)和ABC-DAB(批號:180107)等試劑盒;南京建成生物工程研究所生產的超氧化物歧化酶(SOD,批號:20170404)、過氧化氫酶(CAT,批號:20170513)、丙二醛(MDA,批號:20170124)等試劑盒。
1.3 實驗儀器 生化分析儀(深圳邁瑞生物醫療電子股份有限公司);采用北京麥克奧迪儀器儀表有限公司生產的Image-Pro Plus 6.0圖像分析系統;L-80XP型低溫超速離心機(美國Beckman公司);FSH-Ⅱ型勻漿器(江蘇金壇國勝實驗儀器廠)。
1.4 分組、模型制備與給藥 應用隨機數字法將200只實驗用大鼠隨機分為假手術組和模型組,每組100例。按照DGMI劑量分為低(劑量1.5 mg·kg-1·d-1)、中(劑量3 mg·kg-1·d-1)、高(劑量6 mg·kg-1·d-1)劑量組,每組40只。根據王釗楠等[7]實驗報道,制備慢性腦缺血大鼠模型需采用結扎雙側頸總動脈的方法,但是假手術組僅需游離頸總動脈不進行結扎。精確稱取DGMI,加入適量0.9%氯化鈉溶液配置濃度為0.75 mg/ml的DGMI溶液,然后加入0.9%氯化鈉溶液依次配置濃度為1.5 mg/ml、3 mg/ml的DGMI溶液,各組均于術后第2天開始腹腔注射給藥治療(2 ml/kg),療程14 d,假手術組和模型組同步腹腔注射給予等體積的0.9%氯化鈉溶液(2 ml/kg)。
1.5 Morris水迷宮實驗和跳臺實驗評價大鼠學習記憶能力
1.5.1 水迷宮實驗:將Morris水迷宮裝置(直徑1.3 m、深度0.5 m)置于暗室,添加適量水并設置恒溫25℃水溫,將圓形水面按十字法劃分為4個象限(Ⅰ、Ⅱ、Ⅲ、Ⅳ),于第Ⅲ象限水面下2 cm設置直徑10 cm、高30 cm的安全平臺,安置攝像機記錄大鼠運動軌跡。①定位航行試驗:正式試驗前1 d,每只大鼠均適應性訓練120 s;將大鼠分別在4個象限面放入水迷宮的池壁中,然后記錄大鼠2 min內游泳的軌跡和逃避潛伏的時間,大鼠到達安全平臺后需停留30 s,如果大鼠2 min 內未找到安全平臺,就將大鼠的逃避潛伏期記為120 s,每只大鼠均連續進行5 d、取平均值。②空間探索試驗:在定位航行試驗結束后的第2天,將安全平臺撤去,把所有大鼠放入第Ⅱ象限面,然后觀察和記錄90 s內大鼠出現在原來設置安全平臺的次數。
1.5.2 跳臺實驗:每組隨機抽取10只大鼠,正式試驗前1 d放在平臺后接通電源,適應性訓練180 s;正式試驗時,大鼠就直接放在接通銅柵電源的平臺上,然后記錄大鼠3 min內的錯誤次數和承受電擊的總時間。
1.6 大腦海馬CA1區行病理學檢查 每組均隨機抽取10只大鼠,在大鼠深度麻醉后進行斷頭取腦,并將嗅球、小腦和低位腦干去除,采用濃度為4%的多聚甲醛溶液固定3 d,進行石蠟包埋、切片和脫蠟水化等操作,再進行常規HE染色(先用乙醇梯度進行脫蠟、PBS洗滌,再用蘇木素進行5 min染色,之后用濃度為0.5%的乙醇鹽酸進行分色、采用尹紅染色20 s等),染色后再利用倒置光學顯微鏡去觀察實驗大鼠大腦海馬CA1區的神經元形態。
1.7 TUNEL染色法觀察大腦海馬CA1區細胞凋亡狀況 取1.5制備的腦組織切片,經乙醇梯度脫蠟水化處理后,按照TUNEL試劑盒步驟進行染色(細胞核黃褐色著色為陽性著色)。凋亡指數(AI)計算:顯微鏡下計數細胞總數和凋亡細胞數,AI(%)=(視野中的凋亡細胞數/視野中的細胞總數)×100%,每只大鼠均取5張切片,每張切片需選取5個互不重疊視野取平均值。
1.8 IHC法檢測大腦海馬CA1區Bcl-2、Bax蛋白表達 取1.5制備的組織石蠟切片,經乙醇梯度脫蠟水化處理后,按照Bcl-2、Bax試劑盒操作步驟,采用ABC-DAB法進行IHC操作[依次進行3% H2O2-甲醇溶液孵育25 min、血清封閉1.5 h、一抗(1∶500)4℃過夜、二抗(1∶200)室溫孵育1.5 h、DAB顯色5 min等],通過倒置光學顯微鏡觀察(黃褐色為陽性著色)。每只大鼠取5張切片,每張切片取5個互不重疊的視野,通過Image Pro plus圖像分析系統測定圖片灰度,進行半定量分析。
1.9 比色法測定大腦海馬區的抗氧化酶的活性與MDA的含量 將每組剩余10只大鼠進行麻醉,然后斷頭取腦,將海馬組織剝取后研磨勻漿,在3 000 r/min的低溫(4℃)下進行離心,15 min后取上清液,然后按照步驟處理,再用紫外-可見分光光度計來測定抗氧化酶的活性和MDA的含量情況。
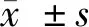
2 結果
2.1 學習記憶能力測定結果 (1)Morris水迷宮實驗:與假手術組比較,模型組大鼠逃避潛伏期和逃避路程均顯著增長(P<0.01);而腦缺血大鼠在DGMI中、高劑量治療2周后能降低逃避潛伏期和縮短逃避的路程,差異有統計學意義(P<0.05或P<0.01)。模型組大鼠穿越原設安全平臺位置的次數少于假手術組大鼠(P<0.01);腦缺血大鼠采用DGMI中、高劑量治療2周后穿越原平臺位置次數高于模型組大鼠(P<0.05或P<0.01)。(2)跳臺實驗:與假手術組比較,模型組大鼠錯誤次數顯著增多且受電擊總時間顯著延長(P<0.01);而與模型組比較,腦缺血大鼠經DGMI中、高劑量治療14 d后犯錯誤次數減少且受電擊時間縮短(P<0.05或P<0.01)。見表1、2。
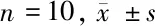
表1 5組大鼠Morris水迷宮實驗結果
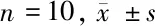
表2 5組大鼠跳臺實驗結果
2.2 大腦海馬CA1區病理學結果 假手術組大鼠海馬CA1區形態結構未見異常,而模型組大鼠海馬CA1區則呈現明顯的病理性改變,主要表現為神經元的層次紊亂、神經元數量減少且細胞間隙呈增大趨勢,膠質細胞也有所增加,胞核固縮或是溶解,核仁消失;與模型組比較,經DGM治療14 d能夠明顯改善腦缺血大鼠大腦海馬CA1區組織形態和神經元結構病變,其中DGMI高劑量組上述效果最為顯著。見圖1。
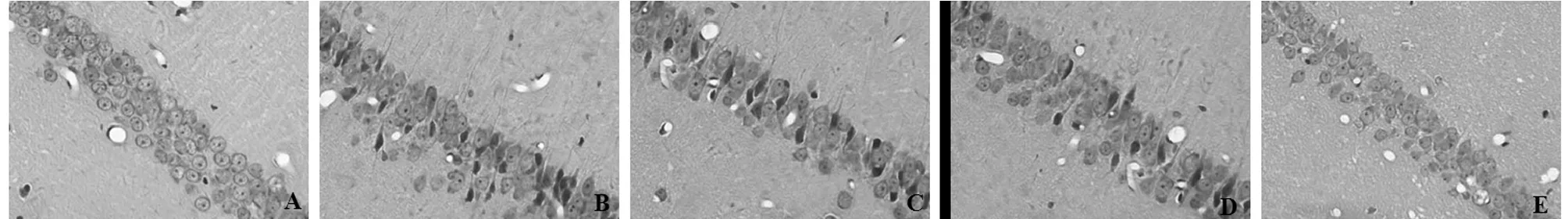
圖1 5組大腦海馬CA1區病理學檢查結果(HE×400);A 假手術組;B 模型組;C DGMI低劑量組;D DGMI中劑量組;E DGMI劑量組
2.3 大鼠大腦海馬CA1區的細胞凋亡結果觀察 與假手術組比較,模型組大鼠大腦海馬CA1區凋亡細胞(經TUNEL染色陽性著色:凋亡的細胞核呈黃褐色)數量明顯高于假手術組;而與模型組比較,經DGM治療14 d后腦缺血大鼠大腦海馬CA1區凋亡細胞數量減少,DGMI劑量組減少效果最為顯著。模型組大鼠與假手術組大鼠大腦海馬CA1區細胞凋亡指數(AI)比較,呈顯著升高趨勢[(65.03±8.71)%vs(2.69±1.08)%,P<0.01],而與模型組比較,DGMI中、高劑量組AI顯著降低[(40.92±6.75)%、(16.94±3.37)% vs(65.03±8.71)%,P<0.01]。見圖2。
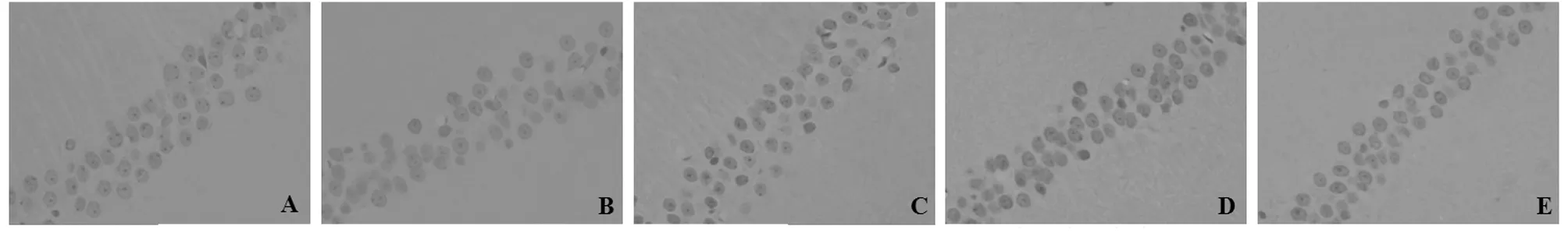
圖2 5組大鼠大腦海馬CA1區細胞凋亡狀況(TUNEL×400);A 假手術組;B 模型組;C DGMI低劑量組;D DGMI中劑量組;E DGMI劑量組
2.4 大腦海馬CA1區Bcl-2、Bax蛋白表達檢測結果 細胞質通過Bcl-2蛋白和Bax蛋白進行表達;模型組大鼠與假手術組大鼠比較,大腦海馬CA1區Bcl-2蛋白表達下調和灰度值降低(P<0.01),與假手術組大鼠比較Bax蛋白表達上調和灰度值升高(P<0.01),Bcl-2/Bax值顯著降低(P<0.01);而與模型組比較,經DGMI中、高劑量治療14 d后腦缺血大鼠大腦海馬CA1區Bcl-2蛋白表達明顯上調、Bax表達下調,灰度值差異均有統計學意義(P<0.05或P<0.01),Bcl-2/Bax值顯著升高,差異有統計學意義(P<0.01)。見圖3、4,表3。

圖3 5組大鼠大腦海馬CA1區Bcl-2蛋白表達(IHC×400);A 假手術組;B 模型組;C DGMI低劑量組;D DGMI中劑量組;E DGMI劑量組

圖4 5組大鼠大腦海馬CA1區Bax蛋白表達(IHC×400);A 假手術組;B 模型組;C DGMI低劑量組;D DGMI中劑量組;E DGMI劑量組
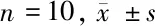
表3 5組大腦海馬CA1區Bcl-2、Bax蛋白表達灰度值及Bcl-2/Bax值
2.5 5組抗氧化酶的活性和MDA含量比較 模型組大鼠大腦海馬區的抗氧化酶活性比假手術組低,且MDA含量呈升高趨勢(P<0.01);經DGMI中、高劑量治療14 d的大鼠比模型組大鼠的抗氧化酶(SOD、CAT)活性高,還有助于降低MDA的含量,差異有統計學意義(P<0.05或P<0.01)。見表4。
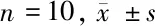
表4 5組大鼠腦組織抗氧化酶活性和MDA含量
3 討論
血管性癡呆(VD)是缺血性腦卒中后常見的神經功能障礙并發癥[8,9],其中學習記憶能力降低是其最主要的早期臨床表現[1,2]。隨著老齡化的加劇、腦血管疾病發病率的上升,VD患病人群也逐年增多[10]。目前,臨床上主要采取抗凝溶栓、改善腦循環等治療方案,但對于VD的防治作用并不理想,仍是臨床上亟待解決的醫學難題之一。Morris水迷宮實驗和跳臺實驗是評價學習記憶能力的常用實驗方法,能夠較好地反映空間學習記憶的形成和維持并且能夠量化[11,12],本研究發現,經DGMI治療能夠有效縮短腦缺血大鼠逃避潛伏期和跳臺潛伏期、增加跳臺次數,提示DGMI對腦缺血所致學習記憶功能障礙具有一定的改善作用。
空間學習記憶與大腦海馬區密切相關,其中海馬CA1區錐體細胞是形成記憶的重要區域[13]。海馬CA1區對錐體細胞缺血缺氧非常敏感,因此腦缺血極容易導致CA1區錐體細胞損傷而導致學習記憶能力降低[14]。既往病理學研究證明,患者出現腦缺血,會引起海馬區的神經功能受損,還會引起神經細胞出現繼發性凋亡,如果及時挽救患者缺血的半影區神經元,就能抑制患者出現缺血性腦損傷[15]。Bcl-2、Bax蛋白在對于細胞凋亡的調控作用非常重要,二者同源但工作相反[16],Bcl-2表現出抑制細胞凋亡的生理作用,而Bax具有促凋亡的生理作用,并且Bcl-2和Bax能夠形成二聚體而雙雙失活,因此Bcl-2/Bax值更加能夠體現二者在細胞凋亡過程中所表現出的實際作用[17]。大鼠出現氧化應激損傷主要是因為大鼠體內的氧自由基出現代謝失衡導致的,而清除體內氧自由基取決于SOD和CAT等關鍵還原酶[18],MDA是大鼠脂質過氧化反應的終產物,所以能夠間接反應大鼠的胰腺組織氧化應激損傷程度的就是胰腺組織的SOD、CAT的活性和MDA的含量[19]。結果顯示,大鼠采用DGMI治療可以顯著抑制腦缺血大鼠大腦海馬CA1區組織形態和細胞結構病變、抑制海馬CA1區細胞凋亡,使海馬CA1區的Bcl-2表達上調, Bax表達下調,有助于使Bcl-2/Bax值提高,能使大腦海馬區的抗氧化酶活性得到改善,還能使MDA含量得以降低,結果提示腦缺血后采用DGMI治療能改善其學習的記憶能力,這是因為DGMI抑制大腦海馬CA1區神經元病變及該部位細胞凋亡有關。
綜上所述,DGMI具有改善腦缺血所致學習記憶功能障礙,這是因為DGMI能夠調控體內相關基因(Bcl-2、Bax)的表達,有助于減少氧化應激造成的損傷,與其能抑制大腦海馬CA1區神經元病變及該部位細胞凋亡有關。

