OIP5-AS1和miR-410在膠質瘤中的表達及調控機制
孫偉力 康天 孫建平 王苑宇 孫曉楓 楊悅 焦保華
腦膠質瘤是起源于神經上皮的腫瘤的統稱,年發病率為(3~8)/10萬。和其他腫瘤一樣,膠質瘤的發病也是由于遺傳易感因素和環境中的多種致癌因素相互作用的結果。越來越多的研究表明:在多種腫瘤中出現的非編碼RNA的表達失調,可能參與了調控腫瘤發生和發展過程[1]。近年來,研究者對LncRNA和microRNA在膠質瘤發生和發展過程中的作用進行了大量研究。有報道證實LncRNA TUG1在膠質瘤組織中表達下調,可發揮腫瘤抑制因子的作用,TUG1在體外過表達可以促進膠質瘤細胞的凋亡,這提示TUG1可能是治療膠質瘤的潛在治療靶點[2]。另據報道,在膠質瘤組織中LncRNA H19的過表達與患者的預后呈負相關,沉默H19可以通過調節miR-675的表達抑制膠質瘤細胞的生長[3]。OIP5-AS1是從編碼OIP5的同一基因的反義方向轉錄的,最初在斑馬魚中被稱為cyrano,發現其在中樞神經系統的早期發育中起關鍵作用[4]。在膠質瘤的發生和進展過程中,OIP5-AS1是否存在調節作用,目前筆者尚未發現相關研究。已有研究報道:miR-410的表達量隨膠質瘤級別的升高而降低,可以靶向作用于下游抑癌基因MET,有效調控膠質瘤細胞的增殖和侵襲[5]。在本研究中,將探討OIP5-AS1和miR-410在腦膠質瘤組織中表達的差異性及與膠質瘤惡性程度的關系,并進一步探討二者相互作用的機制。
1 資料與方法
1.1 一般資料 收集2016年10月至2017年10月在河北醫科大學第二醫院神經外科手術切除的膠質瘤患者標本65例(膠質瘤組),所有患者術前未進行其他治療,且不合并其他系統的原發性惡性腫瘤、嚴重全身感染以及結締組織疾病。收集同期10例行去骨瓣減壓術的重度顱腦外傷患者術中為降低顱內壓,部分切除的腦組織標本作為對照組。
1.2 儀器與試劑 Real-Time PCR System購自美國Applied Biosystem公司;Dual-Luciferase? Reporter Assay Syste購自普洛麥格生物技術有限公司;BX51熒光顯微鏡購自日本Olympus公司;Trizol試劑盒購自美國Invitrogen公司;SYBR Premix Ex Tap Ⅱ、逆轉錄試劑盒購自日本Takara公司;HEK 293T細胞系購自中國科學院;Lipofectamine 2000購自美國Invitrogen公司;質粒由上海吉凱基因科技有限公司合成。
1.3 試驗方法
1.3.1 試驗分組:根據標本的性質分為腫瘤組與非腫瘤對照組,根據WHO 2007年發表的中樞神經系統腫瘤病理分類將腫瘤組再分為2組:低級別膠質瘤(Ⅰ/Ⅱ級)組,高級別膠質瘤(Ⅲ/Ⅳ級)組。
1.3.2 設計及合成引物序列:通過NCBI,選擇目的基因/SNP位點,查找序列,設計引物,篩選引物,優化各組分濃度,并經BLAST檢查引物特異性。由生工生物工程(上海)公司合成上述引物。見表1。

表1 引物序列
1.3.3 Real-Time PCR反應:采用Trizol試劑盒及氯仿、異丙醇、乙醇、DEPC等經裂解、勻漿、離心、洗滌、溶解后從各組膠質瘤組織、正常組織的細胞中提取總RNA。經BioTek Synergy HT多功能酶標儀鑒定待測樣品OD260/OD280的比值及其濃度。然后取總RNA(2 μg)在無RNA酶離心管中配置反應體系在適當條件下進行逆轉錄。使用SYBR Premix Ex Taq Ⅱ試劑盒、引物、cDNA等配置總體積20 μl的qRT-PCR反應體系,反應條件:起始過程95℃ 10 min;擴增過程95℃ 15 s,60℃ 1 min,總共擴增40個循環,擴增cDNA。并以U6作為miR-410的內參基因,GAPDH作為OIP5-AS1的內參基因。待測基因的相對表達量用2-ΔΔCt進行計算,其中-ΔΔCt=-(ΔCt腫瘤組-ΔCt對照組),ΔCt腫瘤組=Ct目的基因-Ct內參基因,ΔCt對照組=Ct目的基因-Ct內參基因。實驗進行3次,取平均值。
1.3.4 生物信息學分析:在Starbase 2.0數據庫中,根據miR-410尋找調節其表達的LncRNA,初步明確是否為OIP5-AS1。進一步使用Target Scan預測軟件,確定miR-410和OIP5-AS1的結合位點。
1.3.5 HEK 293T細胞的培養及傳代:①細胞復蘇、培養:37℃水浴預熱含10%FBS的DMEM高糖培養基,快速解凍HEK 293T細胞系、重懸細胞,然后于1 000 r/min離心5 min。棄上清,加5 ml培養基重懸細胞后,接種到25 cm2的培養瓶中,搖勻后在5% CO2孵箱中37℃恒溫培養。②細胞傳代:當細胞融合度長至約90%時,給細胞傳代。在超凈臺中棄培養基,加入5 ml PBS清洗細胞后,再加入1 ml 0.25%的胰蛋白酶消化細胞。加入5 ml含10%FBS的DMEM高糖培養基終止消化。用移液器輕輕吹下瓶壁上剩余的細胞,將細胞移入離心管中,1 000 r/min離心5 min。棄上清,重懸細胞后,接種到75 cm2培養瓶中,細胞密度在1×104細胞/cm2,恒溫培養。并以1∶10傳代,提取處于對數生長期的HEK 293T細胞用于雙熒光素酶報告基因實驗。
1.3.6 雙熒光素酶報告基因實驗:①實驗分組:將293T細胞分為NC組(轉染NC序列)和miR-410 mimics組(轉染miR-410模擬物)。②構建質粒:由上海吉凱基因科技有限公司合成。③轉染目的細胞質粒:提取處于對數生長期的HEK 293T細胞,當細胞融合率達到80%時,按照Lipofectamine-2000試劑盒說明書分別轉染NC序列和miR-410模擬物序列。④雙熒光素酶檢測 轉染約48 h后,加入20 μl Luciferase Assay試劑,震蕩混勻后立即使用酶標儀檢測螢火蟲熒光酶熒光值,隨后加入20 μl Stop & Glo?試劑,震蕩混勻后靜置3 min后使用酶標儀檢測海腎熒光酶熒光值,計算螢火蟲熒光素酶活性與海腎熒光素酶活性的比值。實驗進行3次,取平均值。
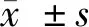
2 結果
2.1 患者臨床信息及資料歸納 (1)根據標本性質分組:腫瘤組65例,其中男40例,女25例;平均年齡(46.23±12.58)歲。對照組10例,重度顱腦外傷患者。(2)根據膠質瘤病理級別分組:低級別膠質瘤組29例,其中Ⅰ級12例,Ⅱ級17例。高級別膠質瘤組36例,其中Ⅲ級19例,Ⅳ級17例。見表2。

表2 5組OIP5-AS1和miR-410的表達
2.2 正常腦組織和膠質瘤組織HE染色 與正常腦組織HE染色相比,膠質母細胞瘤由分化程度低、多形性明顯、胞核的非典型性突出、有絲分裂活躍的高度間變的膠質細胞組成,腫瘤的細胞密度高;腫瘤中可見明顯的微血管增殖和壞死。見圖1。

正常腦組織 膠質瘤組織(WHO Ⅳ級)
2.3 對照組與腫瘤組OIP5-AS1和miR-410的表達 腫瘤組和對照組OIP5-AS1和miR-410的表達水平。與正常腦組織比較,膠質瘤組織中OIP5-AS1的表達水平明顯升高,miR-410的表達明顯降低(P<0.05)。見表3,圖2。

表3 對照組與腫瘤組OIP5-AS1和miR-410的表達

圖2 OIP5-AS1和miR-410在膠質瘤和正常組織中的相對表達(散點圖)
2.4 不同級別膠質瘤組OIP5-AS1和miR-410的表達水平 OIP5-AS1在高級別膠質瘤組織中的表達水平顯著高于低級別膠質瘤組織(P<0.05)。miR-410在高級別膠質瘤組織中的表達水平顯著低于低級別膠質瘤組織(P<0.05)。OIP5-AS1和miR-410的表達水平與膠質瘤的病理分級顯著相關。見表4。

表4 不同級別膠質瘤組織OIP5-AS1和miR-410的表達
2.5 相關性分析結果 Pearson檢驗示:OIP5-AS1表達與miR-410表達呈負相關(r=-0.64,P<0.001)。見圖3。

圖3 OIP5-AS1表達水平與miR-410的相關性分析
2.6 OIP5-AS1與miR-410的關系 使用Starbase 2.0在線預測:OIP5-AS1是調節miR-410的分子海綿。進一步使用Target Scan預測軟件確定了miR-410和OIP5-AS1可能的結合位點。見圖4。

圖4 在線生物信息軟件預測miR-410和OIP5-AS1的結合位點
2.7 雙熒光素酶活性測定結果 與NC組比較,miR-410 mimics對突變型OIP5-AS1-mt熒光素酶活性的影響無顯著差異;miR-410 mimics顯著下調野生型OIP5-AS1-wt的熒光素酶活性。實驗結果證實:OIP5-AS1與miR-410之間存在靶向關系。見表5。

表5 雙熒光素酶活性測定結果
3 討論
膠質瘤是發病率最高的原發性顱內腫瘤,2007年世界衛生組織(WHO)中樞神經系統腫瘤分類將腦膠質瘤分為Ⅰ~Ⅳ級,其中Ⅰ、Ⅱ級為低級別腦膠質瘤,Ⅲ、Ⅳ級為高級別腦膠質瘤。在本實驗中,將此作為腫瘤組的分組標準,并進一步檢測了OIP5-AS1和miR-410在各組中的表達,通過觀察這兩種非編碼RNA在不同級別膠質瘤中表達的變化趨勢并經統計學證實二者與腫瘤惡性程度相關。
已有研究表明,與OIP5-AS1編碼同一基因的正義方向轉錄的OIP5在正常組織呈限制性表達,但在腎癌及乳腺癌等許多腫瘤中過表達,因此被認為是一種致瘤基因,并且有可能成為靶向藥物治療的靶點[6]。目前筆者尚未發現相關研究表明編碼OIP5的同一基因的反義方向轉錄的OIP5-AS1在膠質瘤發生及發展中的作用。有研究發現,OIP5-AS1在哺乳動物中普遍存在,在人類某些腫瘤中明顯高表達[7]。OIP5-AS1在神經系統中表達水平較高,且在發育過程中對調控神經發育起著非常重要的作用。同時,OIP5-AS1也是近年來腫瘤相關研究的一個熱點。Kim等[8]的研究表明:在人宮頸癌Hela細胞中,OIP5-AS1可能作為競爭性內源RNA與RNA結合蛋白HuR結合并使其穩定,從而抑制HuR誘導的細胞增殖,參與腫瘤細胞的調控。同樣,Deng等[9]研究報道,熒光素酶檢測證實miR-448是OIP5-AS1的靶基因,OIP5-AS1通過與miR-448競爭性結合,正向調控下游靶基因Bcl-2,在肺腺癌組織和細胞中高表達時,發揮致癌作用,主要是影響肺癌細胞增殖、遷移和侵襲。Yang等[10]還發現,在多發性骨髓瘤中OIP5-AS1通過調節miR-410的表達,調控其靶基因KLF10,從而介導PTEN/PI3K/AKT信號通路,促進腫瘤細胞增殖、細胞周期的進展和抑制細胞凋亡。本實驗明確了OIP5-AS1和miR-410的靶向調節關系。
在膠質瘤組織中,OIP5-AS1表達顯著升高,而miR-410表達降低,提示OIP5-AS1與miR-410表達水平呈負相關關系,經Pearson相關性檢驗也已證實二者表達量變化差異有統計學意義(P<0.05)。此外,miR-410在人膠質瘤組織中表達下調,通過下調其靶基因MET,發揮抑癌作用,對膠質瘤生長產生明顯抑制作用[5]。因此,我們假設OIP5-AS1可能發揮致癌基因的作用,miR-410可能作為神經膠質瘤中的抑癌基因調節某些抑癌蛋白的表達并進一步抑制腫瘤發生和/或進展。本研究還發現OIP5-AS1和miR-410的表達與膠質瘤的病理分級密切相關。其中,膠質瘤患者病理分級越高,OIP5-AS1表達水平越高,miR-410表達水平越低,提示OIP5-AS1和miR-410與膠質瘤的發病機制和發展密切相關,可以推測OIP5-AS1對miR-410可能發揮“海綿分子”的功能。
Ganesan等[11]研究發現:OIP5-AS1過表達在人類上皮起源的腫瘤中很常見,OIP5-AS1在未分化細胞的口腔腫瘤中過表達,受其調節的6個miRNA(miR-137、miR-148a-3p、miR-30a-5p、miR-30b-5p、miR-338-3p和miR-22-3p)表達下調,OIP5-AS1對miRNA具有“海綿”的功能。OIP5-AS1表觀基因組分析結果表明,通過miR-143/145的重復表達,靶向干細胞特性相關轉錄因子,通過共表達的NEAT1、TUG1和HOTAIR對OIP5-AS1進行正向轉錄調控,可能是維持腫瘤細胞干細胞特點和低分化的原因,也是預后不良的原因。在膠質瘤中,可能也存在這種調節機制,OIP5-AS1過表達,發揮其對miR-410的“海綿化”功能,并靶向抑制下游抑癌因子的表達,腫瘤細胞增殖及侵襲力增強。同時,通過OIP5-AS1正向轉錄調控機制,表達不斷增強,進一步加速腫瘤的增殖和侵襲,導致高級別的膠質瘤中OIP5-AS1過表達。
本研究通過實驗證實OIP5-AS1是膠質瘤的促癌基因,通常情況下反義lncRNA可以負向調節對應mRNA的表達,因此有必要了解OIP5在腫瘤發生中的作用,從而進一步理解OIP5-AS1做為促癌基因的機制。Freitas等[12]發現OIP5在膠質母細胞瘤中的表達率較高,可達54%。同時OIP5陽性表達組患者生存期比陰性組延長25周,統計結果提示差異有統計學意義(P<0.05)。我們可以從這一結果推斷OIP5在膠質母細胞瘤起到了抑制腫瘤進展的作用。最近,Dorival等[13]在T98G GBM細胞系中對OIP5的敲除效果進行了評估。結果表明,下調OIP5可以刺激膠質瘤細胞的活力,抑制環己亞硝脲(抗癌藥)誘導的細胞壞死和凋亡。OIP5在GBM細胞中的表達似乎能夠增強環己亞硝脲細胞毒性作用,進一步證明該基因是GBM治療反應的潛在治療靶點和可能的分子生物標志物。但是國內學者通過檢測92例膠質瘤組織中OIP5的表達水平,發現OIP5的陽性表達率為18.47%,陽性表達率差異無統計學意義(P>0.05)[14],能否作為膠質瘤治療的新靶點需進一步研究。OIP5在多數腫瘤中為促癌基因,而在GBM中則相反。
隨著分子生物學的發展,新一代測序技術和DNA微陣列技術極大地幫助我們在全基因組范圍內識別不同癌癥及其亞型的miRNA和mRNA信號。通過大量實驗證實,miRNA在不同腫瘤中扮演著截然相反的角色。有研究發現:miR-410在兒童急性淋巴細胞白血病病例中的表達水平均明顯增高,在疾病進展中起促進作用,在體外實驗得到進一步證實[15]。miR-410在腫瘤中的作用與正、負調控相關:在某些腫瘤中負性調節BAK1、CETN3和BRD7促進腫瘤細胞增殖及侵襲,在有些腫瘤中miR-410可以有效靶向c-MET、AGTR1和SNAIL等起到抑癌作用[16]。
雙熒光素酶報告基因系統將含有目的DNA的序列插入到載體工具中進行實驗,在轉錄水平測定上游刺激對下游靶基因的影響,可以快速、靈敏、高效地檢測轉錄因子和其靶啟動子區DNA相互作用的關系,從而揭示細胞信號轉導通路的分子機制。
綜上所述,膠質瘤組織中OIP5-AS1的表達水平明顯升高,miR-410的表達明顯降低,兩者可能影響膠質瘤的發生和發展。OIP5-AS1和miR-410的表達與膠質瘤的病理分級相關,而且OIP5-AS1表達與miR-410表達呈負相關,而且OIP5-AS1可以靶向調節miR-410的表達。為揭示膠質瘤發生和侵襲性生長的發病機制提供了實驗證據,從而為膠質瘤的基因治療和靶向治療提供了理論基礎。

