超聲引導下不同濃度嗎啡復合羅哌卡因前鋸肌平面阻滯對乳腺癌患者術后鎮痛效果的影響
林建宏,劉曉飛,王倩,姜愛華
1 濱州醫學院,山東濱州256600;2 青島大學附屬煙臺毓璜頂醫院
隨著加速康復外科(ERAS)理念的臨床普及和超聲可視技術的發展,圍手術期多模式鎮痛成為學科發展的趨勢,其中以超聲引導下區域阻滯為代表。超聲引導下前鋸肌平面阻滯(SAPB)通過阻滯肋間神經的外側皮支,能夠為胸壁的前外側及部分后側提供良好的鎮痛[1,2],近年來被廣泛應用于乳腺手術、胸科手術、肋骨骨折和肩部手術的術中和術后鎮痛[3]。近來部分研究發現,某些阿片類藥物復合局部麻醉劑用于外周神經阻滯可顯著提高外周阻滯效果并延長阻滯時間[4,5],但目前嗎啡復合羅哌卡因用于周圍神經阻滯鮮有報道。本研究觀察了超聲引導下不同劑量嗎啡復合羅哌卡因SAPB對乳腺癌患者術后鎮痛效果的影響,為臨床應用提供借鑒。
1 資料與方法
1.1 臨床資料 經煙臺毓璜頂醫院醫學倫理委員會批準,選擇2019年9~12月收治的乳腺癌患者。納入標準:①女性;②年齡30~60歲;③擇期乳腺癌根治術;④ASA分級Ⅰ~Ⅱ級;⑤簽署研究知情同意書。排除標準:①存在神經阻滯禁忌證,如凝血功能異常、穿刺部位感染等;②心、肺、肝、腎、腦等嚴重功能不全或重癥疾病;③精神疾病或溝通交流障礙;④對研究相關藥物有過敏史;⑤雙側乳腺手術。共收集符合標準患者120例,采用隨機數字表法分為C、R1、R2、R3組各30例。C組年齡(46.97±7.75)歲,身高(160.33±6.00)cm,體質量(62.10±8.07)kg,BMI(24.29±3.79)kg/m2;R1組年齡(45.53±6.66)歲,身高(159.33±4.72)cm,體質量(61.07±8.08)kg,BMI(23.80±3.03)kg/m2;R2組年齡(47.50±6.20)歲,身高(162.20±6.98)cm,體質量(60.20±8.52)kg,BMI(22.90±2.99)kg/m2;R3組年齡(46.23±6.42)歲,身高(161.17±7.17)cm,體質量(60.83±9.29)kg,BMI(23.48±3.72)kg/m2;各組年齡、身高、體質量、BMI均具有可比性。
1.2 麻醉方法 所有患者常規禁飲禁食,無術前用藥,入手術室后監測心電圖、無創血壓、脈搏血氧飽和度和心率。患者取仰臥位,常規消毒皮膚,鋪巾。采用索諾聲便攜式超聲儀和配套高頻探頭(7~12 MHz),在腋中線第5肋間放置探頭,獲得清晰背闊肌、前鋸肌圖像,兩層肌肉間的筋膜間隙為前鋸肌平面。固定探頭,使用22 G神經阻滯針由前上至后下進針,至前鋸肌表面給予生理鹽水3 mL;當超聲見液體擴散、回抽無血液和氣體后,各組均注入0.375%羅哌卡因20 mL,R1、R2、R3組分別復合嗎啡2、4、6 mg。神經阻滯完成后進行全身麻醉:依次靜脈注射咪達唑侖0.05 mg/kg、舒芬太尼0.3~0.4 μg/kg、依托咪酯0.3 mg/kg和羅庫溴銨0.8 mg/kg行麻醉誘導;置入喉罩后以IPPV模式進行機械通氣(潮氣量6~8 mL/kg、頻率10~12次/min),根據患者實際情況調節呼吸參數,將呼氣末二氧化碳分壓控制在35~45 mmHg。以丙泊酚、瑞芬太尼和七氟醚維持麻醉,根據血壓波動情況及腦電雙頻指數(BIS)調節維持藥量,使血壓維持相對穩定、BIS控制在40~60。術中根據手術和肌松要求追加羅庫溴銨,手術結束后,使用適量新斯的明和阿托品拮抗肌松藥的殘余作用。術后鎮痛:當患者術后VAS≥4分時,即采用補救鎮痛措施,靜脈注射氟比洛芬酯50 mg,累計劑量≤200 mg/d,直至VAS降至4分以下。麻醉均由同一位經驗豐富的麻醉醫師實施,術后由另一位不知分組情況的麻醉醫師觀察并記錄相關數據。
1.3 指標觀察方法 觀察手術操作情況,記錄手術
時間;術后2、4、8、12、24、48 h,觀察并記錄患者靜息狀態的VAS和Ramsay鎮靜評分;記錄術后第一次補救鎮痛時間,以及術后48 h內補救鎮痛次數;記錄患者術后鎮痛滿意度:10分表示非常滿意,0分表示非常不滿意;記錄患者不良反應發生情況,主要包括呼吸抑制、惡心嘔吐、尿潴留、皮膚瘙癢、局麻藥中毒、切口愈合延遲等。

2 結果
2.1 各組手術時間比較 患者均順利完成手術,手術時間C組(111.93±13.90)min、R1組(114.17±12.27)min、R2組(110.27±8.63)min、R3組(108.97±12.08)min,各組間比較P均>0.05。
2.2 各組術后不同時點VAS和Ramsay評分比較 見表1、表2。
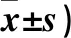
表1 各組術后不同時點VAS比較(分,
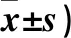
表2 各組術后不同時點Ramsay評分(分,
2.3 各組術后補救鎮痛情況及鎮痛滿意度比較 見表3。

表3 各組術后補救鎮痛情況及鎮痛滿意度比較
2.4 各組不良反應情況比較 C組出現惡心嘔吐4例,皮膚瘙癢、局麻藥中毒各1例;R1組出現惡心嘔吐6例,呼吸抑制、皮膚瘙癢、尿潴留各1例;R2組出現惡心嘔吐7例,皮膚瘙癢2例;R3組出現惡心嘔吐6例,皮膚瘙癢3例,尿潴留1例;各組不良反應發生率比較P均>0.05。
3 討論
多種鎮痛藥物的聯合應用是當前疼痛診療的新趨勢,可通過不同鎮痛藥物間的協同作用,既達到滿意的鎮痛效果,又減少了藥物用量,從而降低了不良反應的發生率。Abdel-Ghaffar等[6]研究發現,在腹橫肌平面(TAP)阻滯中,在布比卡因中加入嗎啡可降低腹壁手術后疼痛,并以劑量依賴性的方式降低術后對阿片類鎮痛藥的需求。El Sherif等[7]研究發現,在TAP阻滯中加入嗎啡是減輕腹部惡性腫瘤手術患者疼痛的有效方法,且未發生嚴重不良反應。Kumari等[8]研究發現,與單獨使用羅哌卡因相比,羅哌卡因復合曲馬多腹腔內灌注可減少腹腔鏡膽囊切除術患者術后疼痛和鎮痛需求。
近來,阿片類藥物的外周作用越來越受到重視。研究發現,阿片類受體不僅存在大腦、脊髓、延髓及交感神經節前纖維等處,也存在于免疫細胞和外周神經,它們對炎癥疼痛具有調節作用[9]。嗎啡在外周神經阻滯中發揮鎮痛的作用機制可能為:①直接與存在于外周神經組織的阿片受體結合;②通過外周神經膜后阿片結合蛋白轉運至脊髓背角與阿片受體結合,同時神經末梢炎癥部位與阿片受體結合調節炎癥反應[10];③經外周血管進入血液循環激發內源性阿片肽釋放,產生抗傷害刺激作用[3]。Tesfaye等[11]研究發現,嗎啡作為一種強效阿片類藥物,能夠有效緩解痛覺超敏與痛覺過敏,且嗎啡對于神經病理痛作用效果顯著,可作用于炎癥組織和初級傳入神經元的阿片受體,產生局部鎮痛的作用。
羅哌卡因作為一種新型長效酰胺類局部麻醉劑,其麻醉效能和阻滯時間優于利多卡因,心血管毒性明顯低于布比卡因,因此廣泛用于神經阻滯[12]。羅哌卡因濃度為0.375%可較好地確保鎮痛效果,同時20 mL的容量可較好地兼顧局麻藥限量和麻醉藥擴散之間的平衡[13]。羅哌卡因作為目前臨床常用局部麻醉劑,脂溶性較差,單獨應用劑量較大。Rahiri等[14]發現,TAPB可出現局麻藥血藥濃度高于全身毒性反應的閾值,提示我們無論何時進行神經阻滯都需要注意局麻藥劑量、患者的生理情況以及注射部位的特殊性。
本研究結果顯示,R1、R2、R3組術后整體VAS趨勢優于C組,疼痛基本處于可忍受程度,能夠達到臨床鎮痛的要求。這說明一定劑量的嗎啡復合羅哌卡因SAPB可為前胸壁手術提供良好的鎮痛,與Abdel-Ghaffar等[6]的研究相吻合。本研究結果發現,2 mg嗎啡聯合0.375%羅哌卡因尚無法達到有效術后鎮痛,患者滿意度低;4 mg和6 mg嗎啡聯合0.375%羅哌卡因均能產生良好的臨床鎮痛,但6 mg組較4 mg組并沒有進一步提高鎮痛效果。我們考慮可能是因為外周神經組織的阿片受體已經飽和或激活的阿片受體有限,但其真正的機制還需要深入探討。本研究中未發生局麻藥中毒等相關并發癥,且不增加Ramsay 靜評分和阿片類鎮痛藥物所致的不良反應(呼吸抑制、惡心嘔吐、尿潴留、皮膚瘙癢)。考慮阿片類藥物所致不良反應可能與藥物劑量、給藥途徑及給藥方式有關,因此小劑量嗎啡在SAPB中應用是安全有效的。
綜上所述,不同濃度嗎啡復合羅哌卡因SAPB較單獨使用羅哌卡因,均可延長神經阻滯作用時間,降低乳腺癌根治術患者術后不同時點VAS,減少術后鎮痛藥物的使用,不增加阿片類藥物所引起的不良反應,且以4 mg嗎啡為鎮痛效果最佳劑量,值得臨床推廣應用。

