miR-223對肺結核大鼠肺泡巨噬細胞吞噬能力的影響及其機制
江葉舟,彭瑤,李點
湖南省胸科醫院,長沙410006
肺結核是由結核分枝桿菌感染誘發形成,主要臨床病理特征為患者肺部出現典型結核結節及肺部干酪樣細胞壞死,最終形成空洞[1]。肺泡巨噬細胞(AM)在肺部損傷及病原菌防御中具有重要作用,可通過吞噬、免疫應答清除微生物和感染異物[2]。在多種因素影響下,AM能釋放炎癥因子,也可釋放抗炎癥介質,維持內環境穩定,在肺結核發病過程中具有重要作用[3]。miR-223作為高度保守的miRNA之一,可通過抑制其靶基因表達對炎癥反應的狀態進行調控。研究表明,miR-223表達下降可促進肺結核患者的炎癥反應[4]。2019年12月~2020年1月,本研究觀察了miR-223對肺結核大鼠AM吞噬能力的影響,并探討其可能的機制。現報告如下。
1 材料與方法
1.1 材料 動物:雄性SD大鼠40只,16~17周齡,體質量(225±11)g,購自長沙天勤生物科技有限公司。主要試劑:TRIzol試劑購自浙江聯碩生物科技有限公司,逆轉錄試劑盒購自武漢賽維爾生物科技有限公司,RT-PCR檢測試劑盒購自上海優予生物科技有限公司;臺式低溫離心機購自美國Stoelting公司,恒溫搖床購自成都蘇凈科學器材有限公司。miR-223 mimics及其陰性對照質粒均由上海吉瑪制藥技術有限公司設計合成。
1.2 動物分組與建模干預 將40只雄性SD大鼠隨機分為miR-223組、模型組、陰性對照組和正常對照組,每組10只。適應性喂養1周后,miR-223組、模型組、陰性對照組胸部備皮、消毒,以5號針頭從右側肋弓角頂點緊貼劍突側緣進行胸腔穿刺,進針1 cm左右,注入結核分枝桿菌懸液0.2 mL,拔針后穿刺部位壓迫止血2 min;正常對照組注射等量生理鹽水[5]。血液檢查及結核菌素試驗證實肺結核建模成功后,miR-223組、陰性對照組分別經尾靜脈注射miR-223 mimics及其陰性對照質粒2 mg/kg,模型組、正常對照組注射等量生理鹽水。
1.3 AM分離 各組繼續喂養6周后,無菌環境下進行全身麻醉,打開胸腔,將肺部取出,斷髓處死。用PBS多次清洗肺葉,流式細胞術分離小鼠AM,經膠原酶Ⅳ消化后獲得單細胞懸液。導入到EP管中,1 500 r/min離心5 min;PBS沖洗,在加入RPMI 1640培養基的培養板中重懸細胞。培養2~3 h,吸除上清,PBS沖洗3次;將10 μg/mL脂多糖(LPS)加入培養板中,培養24 h;收集細胞懸液前2 h,加入非經典型自噬抑制劑Brefeldin A(BFA),棄上清,胰蛋白消化后收集AM。
1.4 AM吞噬能力觀察 采用流式細胞術。將濃度為0.04 mg/mL的FITC-E.coli懸液注入到各組AM培養基中,無光條件下孵育4 h。無機鹽溶液和平衡鹽溶液洗滌后,采用流式細胞儀檢測AM的平均熒光強度(MFI)和吞噬FITC-E.coli的陽性細胞(形成吞噬熒光微球)百分比(簡稱吞噬陽性細胞百分比),MFI、吞噬陽性細胞百分比越高表明吞噬能力越強。
1.5 AM形態學觀察 采用HE染色。取各組AM,制備細胞爬片,甲醛固定20 min;PBS沖洗3次,蘇木精和伊紅染色液進行復染,時間分別為6~8 min、10 s。梯度乙醇脫水,二甲苯透明,中性樹膠封片。200倍光學顯微鏡下觀察細胞形態。
1.6 AM中miR-223、STAT3 mRNA表達檢測 采用實時熒光定量PCR法。取各組AM,胰蛋白酶消化,TRIzol法提取總RNA,反轉錄成cDNA。PCR引物序列:miR-223上游引物5′-GCCGGCGCCCGAGCTCTGGCTC-3′、下游引物5′-TGTCAGTTTGTCAAATACCCCA-3′,STAT3上游引物5′-GCGGCAGTTTCTGGCCCCTT-3′、下游引物5′-CGGGCCACAATCCGGGCAAT-3′,內參β-action上游引物5′-GAGAGGGAAATCGTGCGTGAC-3′、下游引物5′-GACGTAGCACAGCTTCTCCTTAATG-3′。PCR反應條件:60 ℃預變性,10 min;95 ℃變性,72 ℃退火,各30 s;95 ℃延伸,共循環40次。采用2-ΔΔCt法計算miR-223、STAT3 mRNA相對表達量。
1.7 AM中STAT3蛋白表達檢測 采用Western blotting法。取各組AM,以1×105/孔接種于6孔板。加入細胞裂解液,按照4∶1的比例將提取的蛋白溶液和緩沖溶液混勻,煮沸變性。電泳板孔內注入蛋白樣品50 μg,轉移到PVDF膜上,加脫脂奶粉封閉1 h,TTBS漂洗10 min×3次。加入STAT3及內參GAPDH一抗(稀釋比例分別為1∶500、1∶1 000),4 ℃孵育過夜。加入二抗(稀釋比例1∶5 000),常溫條件下封閉1 h,37 ℃條件下孵育45 min。TTBS漂洗10 min×3次,DAB顯色。采用凝膠圖象處理系統(Gel-Pro-Analyzer軟件)分析目標條帶的光密度值,計算STAT3蛋白相對表達量。
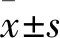
2 結果
2.1 各組AM吞噬能力比較 與正常對照組比較,miR-223組、模型組、陰性對照組MFI及吞噬陽性細胞百分比均降低,且模型組、陰性對照組降低更明顯(P均<0.05)。模型組與陰性對照組MFI及吞噬陽性細胞百分比比較差異均無統計學意義(P均>0.05)。見表1。

表1 各組AM吞噬能力比較
2.2 各組AM細胞形態比較 正常對照組AM細胞質狀態及細胞形態完整,細胞核居中較多,未見吞噬顆粒聚集;miR-223組AM細胞質狀態及細胞形態較好,細胞核居中或偏移,少量吞食顆粒聚集;陰性對照組、模型組AM細胞吞噬顆粒聚集,細胞核偏移較為嚴重。見圖1。

注:A為miR-223組,B為模型組,C為陰性對照組,D為正常對照組。
2.3 各組AM中miR-223、STAT3 mRNA及蛋白表達比較 與正常對照組比較,miR-223組、模型組、陰性對照組miR-223相對表達量均降低,STAT3 mRNA及蛋白相對表達量均升高,且模型組、陰性對照組變化更明顯(P均<0.05)。模型組與陰性對照組miR-223、STAT3 mRNA及蛋白相對表達量比較差異均無統計學意義(P均>0.05)。見表2。

表2 各組AM中miR-223、STAT3 mRNA及蛋白相對表達量比較
3 討論
肺結核是由于肺結核桿菌感染所引起的慢性傳染性呼吸系統疾病,病情嚴重者甚至可能會導致嚴重的呼吸系統并發癥[6]。研究證實,肺結核發病后會激活巨噬細胞中的多個炎癥因子,加上結核分枝桿菌感染,巨噬細胞吞噬病菌后不能將其完全消除,逐漸出現外源性凋亡[7]。miR-223廣泛存在于哺乳動物中,具有組織特異性,參與細胞增殖及組織生長,在一定程度上可抑制正常細胞再生[8]。相關文獻報道,miR-223在肺結核患者體內可發揮雙重作用,在抑制中性粒細胞趨化引起的肺組織損傷的同時,還可降低巨噬細胞中STAT3、NF-κB等表達,通過抑制巨噬細胞凋亡而發揮抗結核免疫的作用[9~11]。本研究結果顯示,與正常對照組比較,模型組AM的MFI及吞噬陽性細胞百分比明顯下降、細胞形態明顯變差、miR-223表達明顯降低,說明肺結核會導致大鼠AM吞噬能力下降及miR-223表達降低;而升高大鼠miR-223表達后,大鼠AM的MFI及吞噬陽性細胞百分比明顯升高,細胞形態變好。這表明過表達miRNA-223可增強AM的吞噬能力,并有助于恢復細胞形態。
miR-223可調控機體多種靶基因,在炎癥反應和感染免疫應答中調控作用顯著。STAT通路是調控細胞因子的重要通路,STAT3主要被IL-6家族細胞因子(如IL-11、LIF)通過gpl30受體活化,并受到促炎和抑炎細胞因子的調控[5]。研究發現,STAT3與巨噬細胞的吞噬能力密切相關[12]。STAT3在細胞質、細胞核的相關信號傳遞中發揮重要作用,STAT3缺乏是巨噬細胞不正常的表現之一,無STAT3表達的巨噬細胞對炎癥因子及結核分枝桿菌十分敏感[13]。STAT可參與炎癥因子的活化,通過激酶反應使其磷酸化,磷酸化的STAT對特定靶基因予以調控,進行細胞核內DNA轉錄,調節相關蛋白進行抗炎級聯反應,最終影響細胞的增殖、分化和凋亡[13,14]。miR-223、STAT3均與炎癥的發生發展有關,但其相關性及對肺結核大鼠吞噬細胞的影響尚不明確。研究發現,miR-223在TLR配體刺激后的表達下調伴隨著STAT3表達升高,miR-223靶點預測發現STAT3的3′UTR區有miR-223的非保守結合位點,說明miR-223可通過直接靶向STAT3而調控炎癥反應[15]。本研究結果顯示,肺結核大鼠AM中的STAT3蛋白表達明顯高于正常大鼠,而當升高細胞miR-223表達后肺結核大鼠AM中的STAT3蛋白表達明顯降低;結合既往研究結果,說明miR-223對肺結核大鼠AM吞噬能力的影響可能是通過降低STAT3表達而實現的。
綜上所述,肺結核大鼠AM中miR-223表達降低,過表達miR-223可增強AM的吞噬能力,其機制可能與抑制STAT3信號通路有關。

