響應面法優化苜蓿蛋白酶解工藝
李偉民,陳九杰,魏泉增,張瑩麗
許昌學院食品與生物工程學院,河南省食品安全生物標識快檢技術重點實驗室(許昌 461000)
紫花苜蓿在中國各地均有種植[1]。苜蓿(Medicago sativa)中蛋白質含量可達22%以上,含有的氨基酸種類多樣[2]。大多數直接提取的葉蛋白很難被直接利用,而且苜蓿蛋白具有很強的抗原性,表現為較低的消化率和生物效價[3],這使得苜蓿蛋白產業的發展受到一定阻礙。
苜蓿蛋白經過酶法水解后制備的多肽對人體具有重要作用,多肽是涉及人體內多種細胞功能的重要物質,對于預防心腦血管疾病、促進造血功能、調節內分泌與神經系統等[4]方面疾病,多肽類藥物具有明顯效果[5]。多肽不僅可提高物質的利用價值,還可賦予物質一定生物學活性,特別是在增強抑菌性[6]、免疫性[7]和抗氧化性[8]等方面。已發現的多肽主要有降血壓、促進免疫功能、抑菌等[9]多種功能。
近年來,多肽的制備多選用核桃[10]、海參[11]、魚籽[12]等原料,而這些原材料通常價格昂貴,不易獲取。試驗采用苜蓿為原材料,苜蓿易獲得,經濟價值低,種質資源豐富。目前對苜蓿多肽的制備方法的研究較少。試驗利用中性蛋白酶對苜蓿進行酶解制備多肽,以提高苜蓿的利用價值。
1 材料與方法
1.1 材料與試劑
紫花苜蓿;中性蛋白酶(酶活力20萬 U/g,南寧龐博生物工程有限公司);其他試劑均為國產分析純。
1.2 儀器與設備
FA2014B分析天平(上海佑科儀器儀表有限公司);TG16-WS離心機(長沙湘儀離心機儀器有限公司);T6課件分光光度計(北京普析通用儀器有限責任公司);Dk-8D水浴鍋(常州普天儀器制造有限公司);PHS-3C型pH計(上海佑科儀器儀表有限公司);DL-1型電爐(中興偉業儀器有限公司);750t型粉碎機(鶴壁市天冠儀器儀表有限公司)。
1.3 試驗方法
1.3.1 多肽溶液制備方法
準確稱取一定量的苜蓿粉于反應容器中,依照蛋白酶添加量加入中性蛋白酶溶液,調整到預設pH,緩慢攪拌,酶解過程中注意維持酶解系統pH恒定。酶解結束后將酶液迅速置于沸水中滅酶10 min。冷卻至室溫后,以4 000 r/min離心10 min,收集上清液。
1.3.2 標準曲線繪制
溶液中多肽含量測定方法采用雙縮脲法[13]。標準曲線制備方式見表1。在試管中加入一定酪蛋白溶液,其中不足1 mL的用蒸餾水補至1 mL,以1.0 mL蒸餾水為空白,向各試管中加入4 mL雙縮脲試劑,充分混勻,室溫下反應30 min,用721分光光度計在540 nm處測其吸光度,繪制標準曲線。
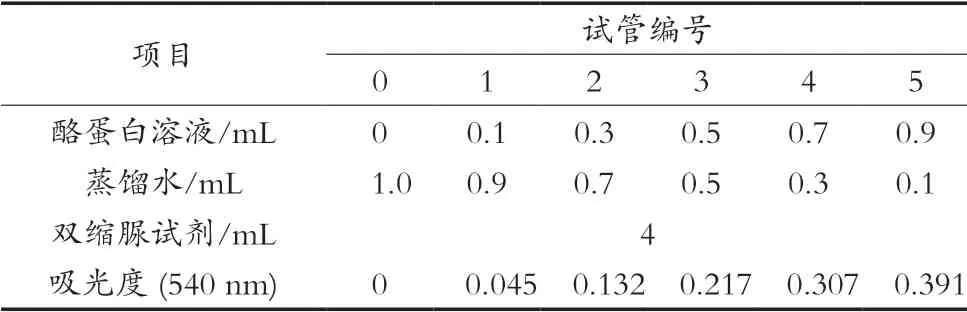
表1 蛋白標準曲線制備
1.3.3 多肽濃度測定
將收集到的上清液定容至100 mL,搖勻,移取10 mL溶液至離心管中,以4 000 r/min離心5 min,使上清液澄清,吸取1 mL上清液,并和4 mL雙縮脲試劑混合,以蒸餾水為空白,室溫下溶液反應30 min,測定吸光度。最后根據標準曲線關系式,計算溶液濃度。
1.3.4 單因素試驗
確定中性蛋白酶添加量(1 500,2 250,3 000,3 750和4 500 U/g)、酶解溫度(40,45,50,55和60℃)、酶解時間(2,3,4,5和6 h)和酶解pH(pH 5,6,7,8和9 h)4個因素,分別考察其對溶液中多肽含量的影響。
1.3.5 響應面試驗
在單因素試驗結果探索最適酶解時間、最適酶解pH、最適酶解溫度、最適中性蛋白添加量的基礎上,選取其中的酶解時間、酶解pH、酶解溫度作響應面綜合分析。采用Design-Expert 8.0.6軟件中心組合試驗進行多肽含量提取最佳工藝。試驗方案見表2。
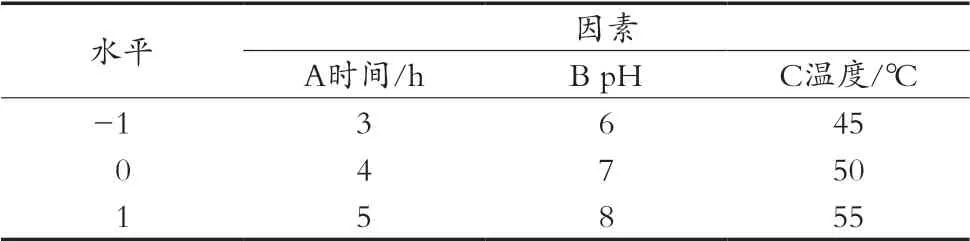
表2 試驗因素和水平
1.4 數據分析
響應面試驗結果利用Design-Expert 8.0.6軟件進行分析,建立回歸方程并作等高線和三維曲面圖,對任意2種因素的交互效應進行分析和評價,得到最優工藝組合。
2 結果與分析
2.1 酪蛋白標準曲線
以酪蛋白含量為橫坐標,OD值為縱坐標,制作標準曲線,從而得到回歸方程:y=0.043 5x+0.000 9,相關系數R2=0.999 9。
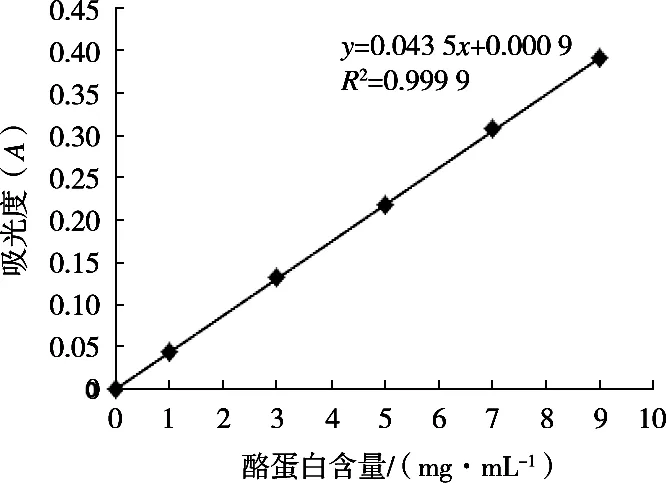
圖1 蛋白標準曲線
2.2 單因素試驗
2.2.1 中性蛋白酶添加量對酶解效果的影響
中性蛋白酶添加量對酶解效果的影響如圖2所示。苜蓿在中性蛋白酶添加量1 500 U/g時,多肽含量最低,隨著中性蛋白酶添加量增加,水解度不斷增大。中性蛋白酶添加量3 750 U/g時,多肽含量最高,隨著中性蛋白酶量繼續增加,多肽含量降低。酶濃度過高,酶分子間可能相互水解,導致酶解效果下降[14]。
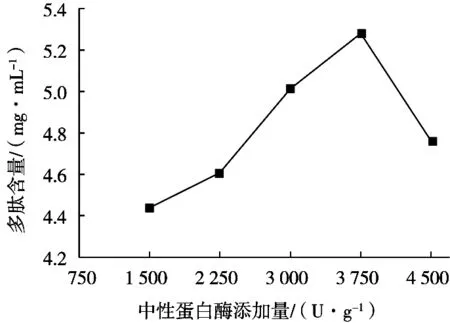
圖2 中性蛋白酶添加量對苜蓿多肽含量的影響
2.2.2 酶解溫度對酶解效果的影響
酶解溫度對酶解效果的影響如圖3所示,溶液中多肽含量呈現先緩慢上升后逐漸下降趨勢。溫度40 ℃時,苜蓿多肽含量較低。在一定范圍內,溶液中多肽含量與酶解溫度呈正相關。溫度達到50 ℃時,苜蓿多肽含量最高,隨后繼續增大溫度,多肽含量開始下降,溫度達到60 ℃時,苜蓿多肽含量最低,溫度偏高或偏低均會抑制中性蛋白酶的活性,溫度過高會導致中性蛋白酶逐漸失活,影響酶解效果,酶解溫度以50℃為宜。
2.2.3 酶解時間對酶解效果的影響
酶解時間對酶解效果的影響如圖4所示。苜蓿在酶解2 h條件下多肽含量最低,隨著時間增加,苜蓿多肽含量隨之增加。苜蓿在酶解時間4 h時多肽含量最大。隨著酶解時間繼續增加,苜蓿多肽含量下降,水浴時間6 h時,苜蓿多肽含量最低,這可能是由于隨著酶解時間延長,短鏈的多肽片段被繼續水解為氨基酸[15]。酶解最適時間以4 h為宜。
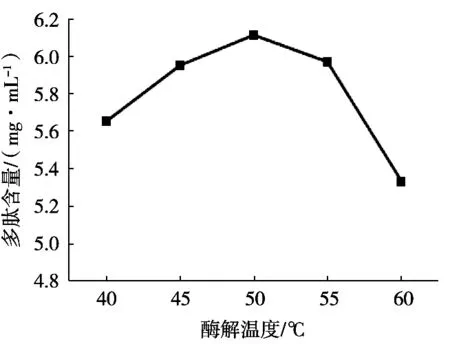
圖3 酶解溫度對苜蓿多肽含量的影響
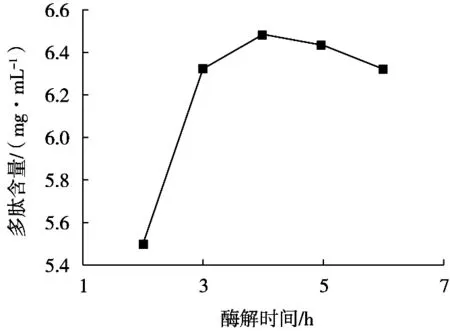
圖4 酶解時間對苜蓿多肽含量的影響
2.2.4 酶解pH對酶解效果的影響
酶解pH對酶解效果的影響如圖5所示。苜蓿在pH 5條件下多肽含量最小。在一定范圍內,酶解pH與苜蓿多肽含量呈正相關。苜蓿多肽在酶解pH 7時多肽含量為最大值,隨著pH逐漸增大,苜蓿多肽含量開始下降。苜蓿在酶解pH 9條件下多肽含量最低。酶解最適pH為7。
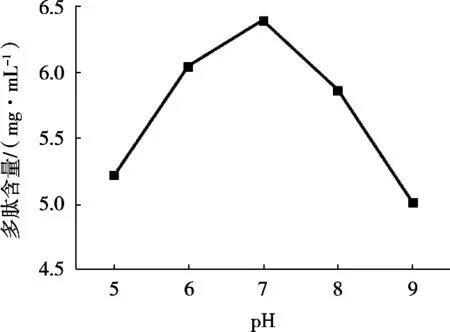
圖5 酶解pH對苜蓿多肽含量的影響
2.3 響應面法優化
2.3.1 響應面法試驗分析及結果
由4個單因素結果選取其中的酶解時間(A)、酶解pH(B)、酶解溫度(C)這3個因素作為參考依據,以多肽含量為指標。進行響應面試驗,確定中性蛋白酶水解制備苜蓿多肽的最佳工藝條件。響應面試驗方案及結果見表3。
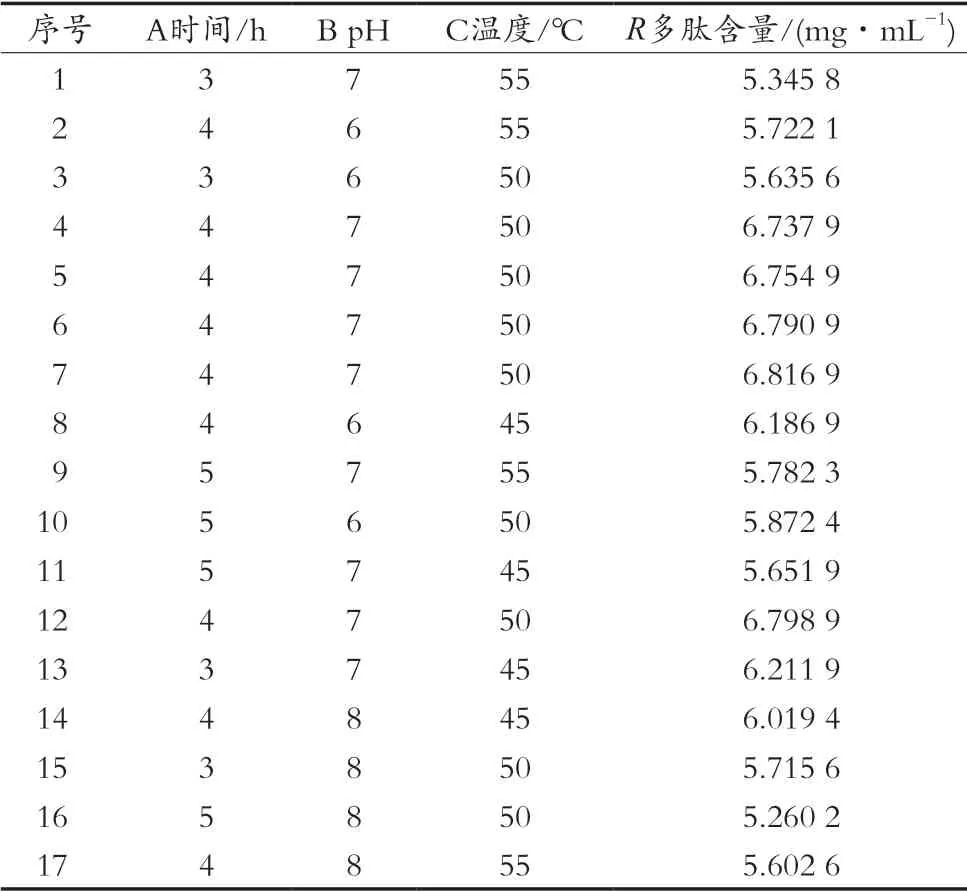
表3 響應面試驗設計及結果
2.3.2 方差分析
通過Design-Expert 8.0.6軟件進行數據分析,建立多元二次響應面回歸模型為:R=6.78-0.043-0.010B-0.20C-0.17AB+0.25AC+0.012BC-0.65A2-0.51B2-0.39C2。由表4可以看出,模型達到極顯著(p<0.01),失擬項不顯著(p>0.05),表明方程無失擬性因素存在,回歸模型與實際值能較好地擬合。一次項A表現為顯著,B、C表現為極顯著,二次項A2、B2、C2表現為極顯著,說明它們對響應值影響極大。由F檢驗可以得到影響因素主次排序:酶解溫度(C)、酶解pH(B)和酶解時間(C)。
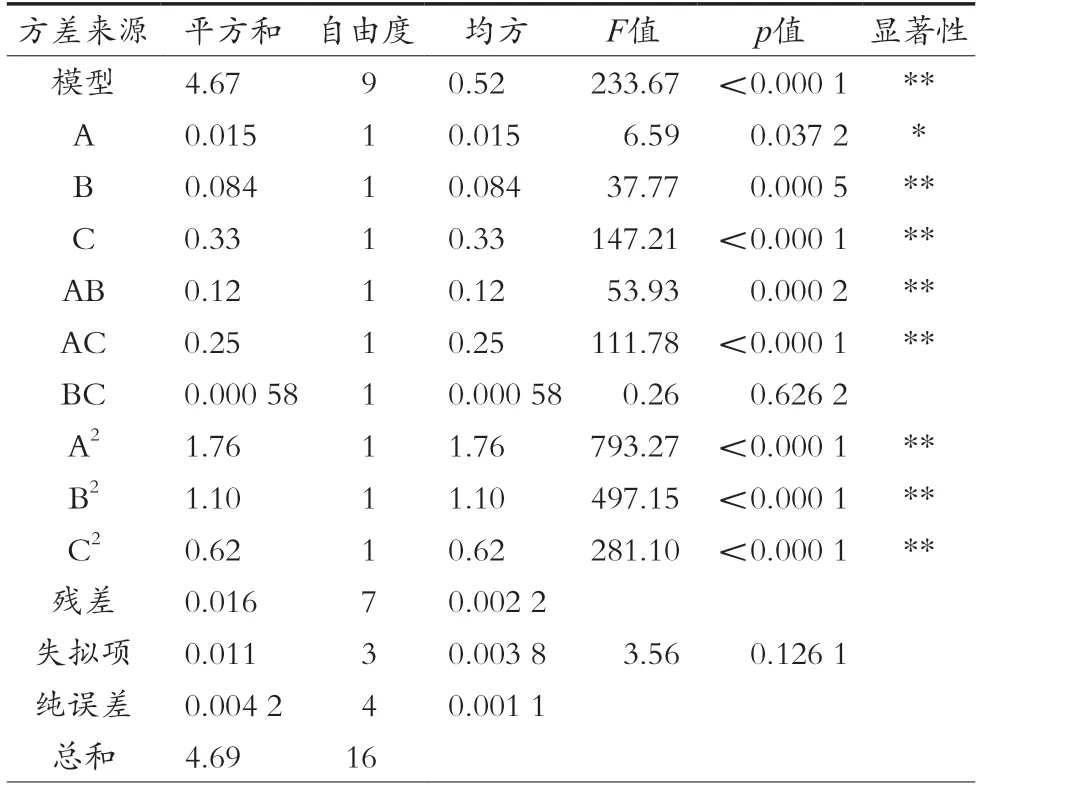
表4 回歸分析結果
圖6直觀反映不同兩因素之間的交互作用對多肽含量的影響,曲面越彎曲,兩因素交互作用對多肽含量的影響越顯著。由表4可知,其中因素AB、AC對多肽含量的影響顯著(p<0.01),BC對多肽含量的影響不顯著(p>0.05)。
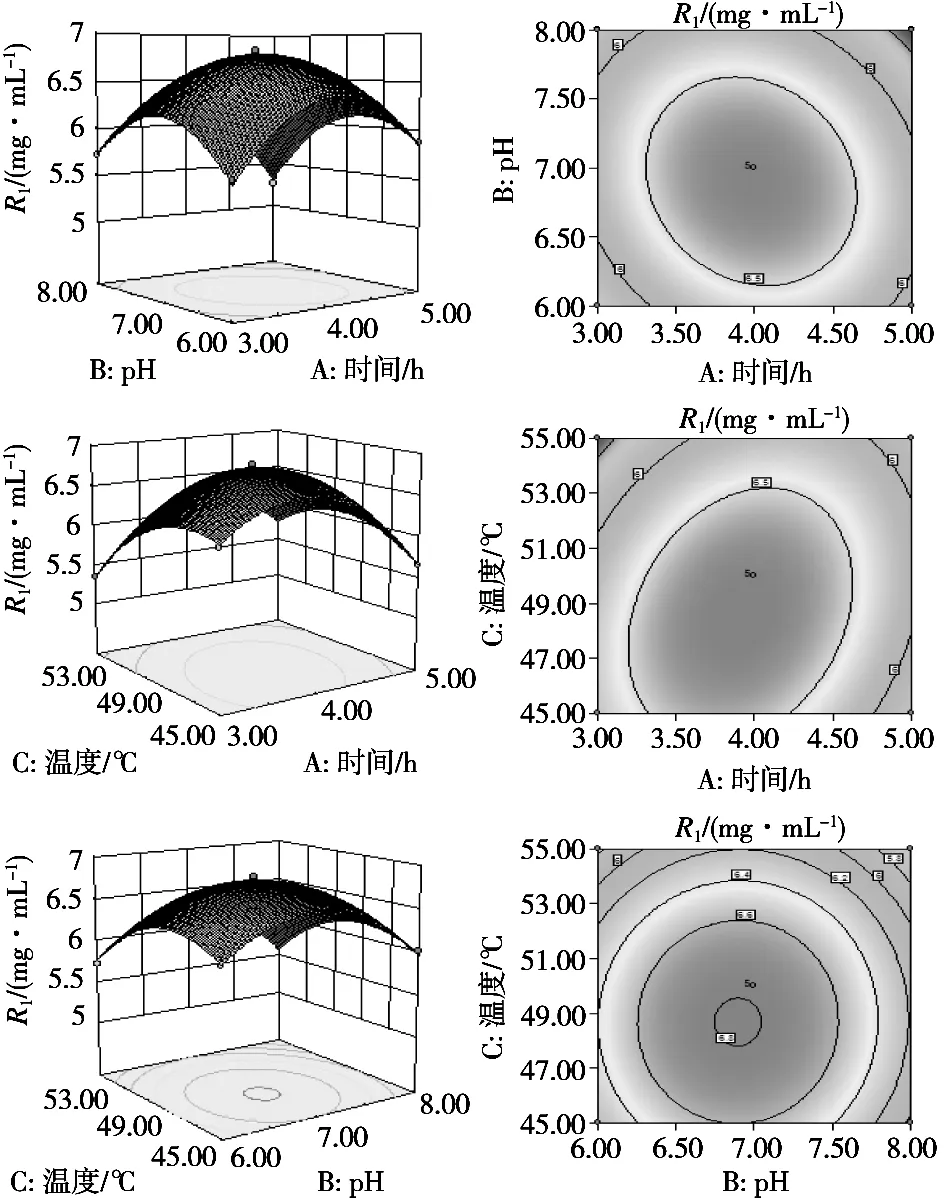
圖6 不同兩因素之間交互作用對酶解液中多肽含量的影響
2.3.3 苜蓿蛋白酶解工藝的確定及優化工藝條件驗證
經Box-Behnken試驗設計,Design-Export 8.0.6軟件分析得出最優條件:酶解pH 6.88、時間4.10 h、溫度49.94 ℃。此條件下酶解液中多肽含量為6.778 8 mg/mL。將工藝參數調整為:酶解時間4.1 h、溫度49.9 ℃、pH 6.88。在此工藝條件下測定的多肽含量為6.752 1 mg/mL。與預測值的相對誤差0.39%,比較接近。試驗可證明模型可靠,方程能較真實反映各因素對多肽含量影響的實際情況。
3 結論
試驗為利用中國苜蓿蛋白資源、提高苜蓿附加值,在單因素基礎上,進行響應面試驗對苜蓿蛋白酶解工藝進行優化,苜蓿多肽制備的最優條件為:加酶量3 750 U/g、酶解pH 6.88、酶解溫度49.9 ℃、酶解時間4.1 h。在此條件下,測得溶液中多肽的含量最高,達到6.752 1 mg/mL,與預測值兩者之間的相對誤差為0.39%,通過軟件建造的模型也能真實直觀反映情況,模型與實際情況貼近吻合,響應面的數據處理真實有效,具有實際使用價值,為苜蓿進一步開發利用提供理論依據。

